脂质代谢(Lipid metabolism,LM)是细胞中脂质合成与降解的过程,包括用于获取能量的脂肪分解、储存以及结构和功能性脂质的合成,其主要功能是将脂质运输到外周组织中使用或将脂质运送回肝脏内进行再循环和清除[1-4]。按照功能划分,脂质代谢过程大致由三个部分组成:外源性脂质吸收、内源性脂质合成以及逆向胆固醇转运。外源性脂质吸收主要是指膳食摄入脂质的吸收过程,是机体脂质的重要来源;内源性脂质合成是在肝脏中通过一系列复杂且精密的过程合成脂质,在机体总脂质中具有较大占比,尤其是胆固醇的合成是一个十分重要的生命过程;逆向胆固醇转运是各组织细胞清除胆固醇并将其转运回肝脏的过程,是机体进行胆固醇再调节的重要途径,对人体健康具有重要意义[5-7]。脂质代谢是机体的重要代谢过程,脂质代谢紊乱会导致体内总胆固醇(Total Cholesterol,TC)、甘油三酯(Triglyceride,TC)和低密度脂蛋白胆固醇(Low Density Lipoprotein Cholesterol,LDL-C)升高以及高密度脂蛋白胆固醇(High Density Lipoprotein Cholesterol,HDL-C)的降低,诱导高脂血症、动脉粥样硬化、非酒精性脂肪肝、糖尿病、肝硬化等多种疾病的发生,严重危害着人们的生命健康[8-9]。人类白细胞分化抗原36(Cluster of Differentiation 36,CD36)是一种在单核细胞、巨噬细胞中高度表达的清道夫受体(Scavenger receptor,SR),作为调节脂肪酸摄取的一个重要蛋白,CD36主导脂肪酸跨膜转运过程,在脂质代谢中发挥着重要的作用。
1 CD36分子简介CD36属于B族清道夫受体家族(Scavenger Receptor Class B,SR-B),是一种高度糖基化的双跨膜蛋白,也被称作脂肪酸转运酶(Fatty Acid Transporter,FAT)、血小板膜糖蛋白Ⅳ(Platelet Membrane Glycoprotein Ⅳ,GPIV)、血清颗粒蛋白(Serum Granule Protein 88,GP88)和B类2型清道夫受体(Scavenger Receptor Class B type 2,SR-B2),是一种具有多种配体识别位点的多功能清道夫受体[10-13]。
1.1 清道夫受体家族SR是由DNA上一段不连锁基因片段共同编码的膜蛋白组成的多功能跨膜受体,能够识别多种配体,包括HDL、乙酰化LDL、脂肪酸(Fatty Acid,FA)、磷脂及凋亡细胞等[14-17]。1979年,Brown和Goldstein团队在巨噬细胞表面发现存在某种结合位点,使巨噬细胞能够摄取和清除乙酰化的低密度脂蛋白(Low-density Lipoprotein,LDL),但是该位点无法识别天然的LDL,后来将该位点命名为清道夫受体1[18]。之后,陆续发现其他清道夫受体,共同组成了SR家族[19]。到目前为止,SR家族可以分为10大类,其中SR-C族仅存在于黑腹果蝇中,其他为哺乳动物所有[20]。2017年,美国国家过敏和传染病研究所(National Institute of Allergy and Infectious Diseases,NIAID)及国立卫生研究院(National Institutes of Health,NIH)组织邀请Khoury等来自5个国家的15位专家对SR家族进行系统分类,将来自哺乳动物的SR分为SR-A ~ SR-L共11个族(不包含SR-C)[21]。
1990年,Kodama团队首次于牛的肺部组织中成功提取出SR-A[22]。SR-A由N末端、跨膜区域、α螺旋、间隔区域、胶原蛋白及富含半胱氨酸的C末端6个区域构成,也是第一个被人工合成的清道夫受体[22]。SR-B是SR家族中研究地最为清楚的一类,也是已知唯一一种具有双跨膜结构的清道夫受体。SR-B主要可以分为三类,SR-B1(SRBⅠ或CD36L1)、SR-B2(CD36)和SR-B3(LIMP2)[21]。目前,关于SR-C、SR-D等SR家族其他清道夫受体地报道比较少,有待对其进行更进一步探索和研究。
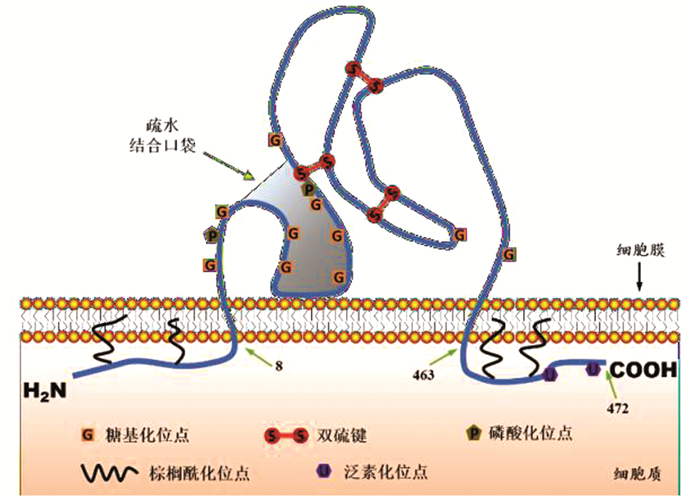
1.2 CD36基因及CD36蛋白分子特征作为B族清道夫受体家族的CD36位于人类CD36基因位于第七号染色体的长臂上(7q21.11),长约46 kb,由17个外显子和18个内含子组成,开放阅读框(Open Reading Frame,ORF)长为1419 bp,编码472个氨基酸,选择性剪接产生四种蛋白质亚型[14, 23-24]。CD36蛋白由两个跨膜结构域、一个包含配体结合位点的胞外结构域以及N末端(NH2终端)和C末端(COOH终端)的短胞质尾组成[10, 25](见图 1)。CD36蛋白的N末端和C末端位于细胞膜内部,直接朝向胞质,中段则在细胞膜外形成一个可以同多种配体相结合的多重颈环结构[10]。CD36是一种多功能的跨膜蛋白,在不同组织细胞(如巨噬细胞、血小板、骨骼肌细胞、心肌细胞以及肝细胞等)中会产生不同类型的转录物,且会经历多种翻译后修饰,包括磷酸化、糖基化、棕榈酸化、乙酰化、泛素化和二硫键等。经过修饰后的蛋白相对分子质量为78~88 kD不等,这些修饰调控CD36在各种细胞中的表达、成熟和定位,并影响其功能。研究发现,CD36蛋白的N末端经过糖基化修饰后,会使细胞增加对脂肪酸的吸收、利用;在血小板中,CD36蛋白分子经过磷酸化修饰后,会抑制细胞对脂肪酸的摄取[26-27]。
|
图 1 CD36蛋白结构示意图 Figure 1 Structure of CD36 protein |
在蛋白分子胞内结构中,CD36的N末端和C末端各有两个棕榈酰化位点,并且C末端还有两个泛素化位点,这些结构为CD36锚定在磷脂双分子层上起到了关键作用[14]。CD36蛋白分子的胞外结构域是一个高度糖基化的多重颈环结构,其上具有10个糖基化位点、3对二硫键和2个磷酸化位点,并形成了一个疏水结合口袋,这使得CD36可以同多种物质相互作用,如氧化低密度脂蛋白(Oxidized Lowdensity Lipoprotein, ox-LDL)、长链脂肪酸(Long Chain Fatty Acid,LCFA)、病原体微生物及凋亡细胞等[24]。CD36蛋白分子具有的这种可以识别结合多种物质的特殊胞外结构表明其可能具有多种独特的生理功能。
2 CD36与脂质代谢研究表明,CD36基因可以在多种细胞中表达,包括内皮细胞、心肌细胞、肾小管上皮细胞、肝细胞、脂肪细胞、血小板和巨噬细胞,并参与许多病理生理过程,包括免疫调节和代谢调节[14, 28]。例如,内皮细胞的细胞膜上的CD36优化组织中的脂肪酸摄取,它还促进肾小管上皮细胞中晚期氧化蛋白产物(Advanced Oxidation Protein Products, AOPPs)的摄取,这导致糖尿病肾病中的脂毒性和肾小管间质纤维化[28]。CD36蛋白可识别的配体大致分为三类:病原相关分子模式(Pathogen-associated Molecular Patterns,PAMPs)、ox-LDL等内源性衍生分子以及LCFA[14]。
2.1 CD36与免疫系统CD36在机体先天免疫系统中发挥重要作用。巨噬细胞是机体先天免疫的重要组成部分,可以识别并吞噬病原微生物来防止机体免受侵害,这种先天免疫反应需要巨噬细胞识别病原体的肽聚糖、脂多糖以及鞭毛蛋白等PAMRs。清道夫受体、Toll样受体(Toll-Like Receptors,TLRs)等是巨噬细胞识别PAMRs的模式识别受体(Pattern Recognition Receptors,PRRs)。清道夫受体CD36可以特异性识别多种病原微生物表面的PAMRs,增强细胞表面的黏附能力,同时介导巨噬细胞吞噬病原体,以维持机体的稳态[14, 29]。此外,CD36还在肌动蛋白骨架的重排中发挥重要作用,增强细胞的吞噬能力,从而在机体清除病原微生物的先天免疫系统中发挥重要作用。
2.2 CD36在脂质代谢中作用CD36作为受体和转运蛋白在脂质代谢过程中发挥重要作用。除了作为“清道夫”辅助巨噬细胞吞噬病原微生物外,CD36还可作为LCFA受体蛋白在脂质代谢过程中发挥重要作用[15, 30]。Laugerette等研究发现,大鼠对脂质的味觉感受与CD36相关联,与野生型大鼠相比,敲除CD36基因的大鼠不再对富含LCFA的溶液表现出喜好行为,同时敲除CD36基因的大鼠的消化液的分泌量和组成也发生了改变[31-32]。Benton等发现敲除CD36基因的小鼠对骨骼肌LCFA的吸收率远低于野生型小鼠,在将CD36基因重新转入CD36基因缺陷型小鼠体内,其对LCFA的吸收恢复到和野生型小鼠相同水平[33]。
CD36已经成为LCFA转运的特异性受体。通过对大鼠脂肪细胞的研究,Abumrad发现CD36是长链脂肪酸(LCFA)转运所必需的脂肪酸转位酶[34]。用棕榈酸(Palmitic Acid,PA)处理小鼠足细胞MPC5后发现,MPC5中CD36蛋白表达上调,并导致脂质蓄积、ROS产生和细胞凋亡,诱发肾脏疾病[35]。使用高浓度葡萄糖溶液喂养小鼠,检测到肾脏细胞中PPARγ水平上调,并促进CD36表达,增加了肾小管细胞对游离脂肪酸的摄取,导致细胞中脂质的过量沉积[36]。
上述研究结果都证明了CD36蛋白在脂质代谢过程中发挥着重要的枢纽作用[34]。研究发现,CD36蛋白分子中的127~279序列被认为是LCFA的结合位点,这一结构位于CD36的胞外结构域中[21]。此外,CD36可以促进LCFA在心脏、肝脏、骨骼肌以及脂肪等细胞中的易位,从而有利于LCFA的氧化分解,为细胞提供更多能量[10]。
2.3 CD36与动脉粥样硬化CD36作为脂蛋白受体在动脉粥样硬化的形成中发挥关键作用。动脉粥样硬化(Atherosclerosis,AS)是心脑血管疾病的最主要病因,严重威胁着人体的生命健康[30, 37]。在正常的巨噬细胞中,存在着脂质代谢的负反馈调节机制。当巨噬细胞通过LDL受体识别吞噬LDL且细胞内脂质过量时,会激活该负反馈调节机制,此时LDL受体表达和细胞内胆固醇合成受到抑制,避免了细胞内脂质过量蓄积,防止了泡沫细胞的形成[15, 38-39]。
而ox-LDL则不然,当巨噬细胞通过CD36等清道夫受体识别内吞ox-LDL后,此时不存在脂质代谢的负反馈调节机制,就会使得巨噬细胞大量吞噬脂质导致细胞内脂质过量蓄积,导致细胞泡沫样变,形成泡沫细胞;泡沫细胞在动脉内壁聚集从而形成动脉斑块,造成动脉粥样硬化的发生,从而诱发多种心脑血管疾病[24]。同时,ox-LDL在通过CD36被巨噬细胞内吞进入胞内后,会激活过氧化物酶增殖活化受体γ(Peroxisome Proliferator-activated Receptor-γ,PPARγ),PPARγ会进一步促进CD36蛋白的表达,从而导致更多的ox-LDL进入细胞,加速泡沫细胞的形成[28]。
2.4 CD36与心血管疾病研究已经发现,CD36在脂质代谢过程中发挥着重要的作用,可以识别并吞噬脂肪酸、胆固醇等脂质分子,对机体的脂质稳态也具有重要的作用。心血管疾病是一类重要的生理性疾病,已经成为我国居民身体健康的第一大杀手,而心血管疾病的发生与脂质稳态密切相关,机体脂质水平异常容易诱发多种心血管疾病。作为维持机体脂质稳态中的重要脂代谢相关分子,CD36在心血管疾病中发挥着重要作用[28]。
研究表明,减少CD36在肌膜上的分布,从而抑制LCFAs的摄取,有助于改善心功能。在心肌细胞中,CD36的持续低水平可能有助于心肌细胞维持能量平衡[40]。在耗氧水平相同的情况下,葡萄糖比脂类提供更多的能量,是维持心肌功能的首选[41-42]。因此,CD36的减少有利于缺氧时代谢底物从脂肪酸转化为葡萄糖,维持细胞的能量平衡。此外,缺血心肌细胞中脂肪酸氧化率降低到基础状态的5%,相对较低的CD36通过减少脂肪酸的吸收来阻止胞浆中甘油三酯的积累[43]。心肌细胞中高浓度的脂肪酸会触发胰岛素抵抗和心肌细胞凋亡,降低再灌注期缺血心功能的恢复[43-44]。因此,缺血时CD36水平的降低会避免甘油三酯的过度积累,是心肌细胞生存、免疫损伤的重要方式。
与CD36的降低有利于心肌细胞的能量产生和免疫损伤相反,巨噬细胞中CD36的降低已被证明不利于心肌细胞死亡后的修复。CD36的缺失会导致吞噬受体与核受体的减少,从而影响心脏巨噬细胞的吞噬功能,加剧心肌缺血引起的心脏破裂[45-46]。研究发现,CD36受体阻滞剂可抑制心肌细胞死亡后巨噬细胞的吞噬并抑制心肌重构[46]。因此,巨噬细胞中CD36表达量的减少或功能障碍可加重心肌梗死[47]。尽管CD36在内皮细胞中比在心肌细胞中表达更丰富,但内皮细胞CD36在缺血性心肌疾病中的作用尚不清楚。
2.5 CD36与癌症肿瘤细胞需要重新连接其代谢途径以调节营养摄取和代谢以维持能量产生。脂质是肿瘤代谢能量来源的重要组成部分,脂肪酸作为信号分子调节代谢途径,脂肪酸摄取是细胞运输脂肪酸进行膜生物合成、能量储存和信号通路激活的关键过程[48-49]。肿瘤细胞依赖于各种转运蛋白来介导脂质的运输以进行氧化或激活致癌信号传导途径[50]。CD36是一种存在于细胞表面的膜糖蛋白,可与脂肪酸结合,促进其转运以利用脂质。近期研究发现,CD36可以通过调节脂肪酸代谢来调节肿瘤的发展[48]。研究发现,在多种癌症类型中观察到CD36表达上调,包括急性髓性白血病,乳腺癌,结肠直肠癌,胃癌等[51]。体外和体内研究证实CD36通过多种分子机制参与肿瘤生长,转移,耐药性的调节[52]。
3 CD36级联多种信号通路参与脂质代谢作为脂肪酸识别和转运的重要蛋白,CD36在脂质代谢过程中发挥着重要的枢纽作用,并可以通过级联其他信号通路参与调节脂质代谢过程。CD36可以级联AMPK、mTOR、MAPK等信号通路,调节ox-LDL、LCFA、FA等脂质跨膜转运,改变细胞内脂质蓄积状态;同时,CD36可以间接调节细胞内脂肪酸β-氧化过程,参与细胞内脂质代谢调控。
3.1 CD36与AMPK通路AMP-活化蛋白激酶(AMP-activated Protein Kinase,AMPK)是调控细胞内能量稳态的重要激酶,是真核生物细胞和有机体代谢的中心调节剂之一,负责监管细胞内的能量的输入和输出,维持细胞生理活动的平稳运转[53]。活化的AMPK诱导FA转运体CD36在细胞膜上募集,并失活乙酰辅酶-A羧化酶2,降低β-氧化抑制剂丙二酰辅酶-A的水平,上调LCFA的β-氧化。骨骼肌中AMPK信号的失调使细胞内调节FA利用的能力降低,导致脂质积累[53]。
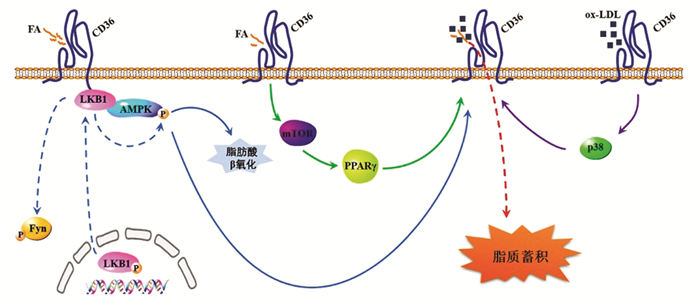
肌肉中AMPK的激活涉及到上游肝激酶B1(Liver Kinase B1,LKB1)催化α-亚基苏氨酸172(T172)的磷酸化。研究发现,在肌细胞等几种细胞类型中,CD36的表达会抑制AMPK的活化,使其保持静息状态,但是可以通过FA介导AMPK的激活[54]。这些双重效应反映了在AMPK激酶LKB1和酪氨酸蛋白激酶Fyn的蛋白复合物中存在CD36[55]。这个复合物使得Fyn磷酸化LKB1并使其隔离在细胞核中,阻碍LKB1激活AMPK。当FA与CD36相互作用时,可以使Fyn从蛋白复合物中分离出来,空间上削弱其对LKB1的接近并使LKB1磷酸化,从而使LKB1从细胞核进入到胞质中,激活AMPK,影响FA的摄取和氧化[1](见图 2)。之后,活化的AMPK会使更多的CD36在细胞膜上定位,导致细胞内脂质蓄积[28, 56]。
|
图 2 CD36级联信号通路参与脂质代谢示意图 Figure 2 Schematic diagram of CD36 cascade signal paticipating in lipid metabolism 注:图中虚线表示物质和基团转移,实线表示相互作用。 |
哺乳动物雷帕霉素靶蛋白(Mammalian Target Of Rapamycin,mTOR)属于磷脂酰肌醇激酶相关激酶(Phosphatidylinositol Kinase-related Kinase,PIKK)超家族,是调控细胞生长和增殖的重要因子[57]。在细胞中,mTOR会形成两种不同的功能复合物,mTORC1和mTORC2。mTORC1对雷帕霉素敏感性强,少量雷帕霉素就会抑制mTORC1活性,降低其功能,而mTORC2则对雷帕霉素不敏感。当受到炎症或营养信号因子刺激后,mTORC1就会调控PPARγ、PPARα、真核起始因子4E(Eukaryotic Initiation Factor 4E,eIF4E)等下游相关信号因子,引发信号级联反应,发挥作用[58]。
王川使用PA处理小鼠肝脏细胞,发现可以激活mTOR信号通路并提高肝脏细胞中CD36表达量,引起脂质蓄积,诱发炎症;此外,使用mTORC1特异性抑制剂雷帕霉素处理肝脏细胞,则会抑制CD36的表达[59]。PPARγ是调节目标基因表达的核内受体转录因子超家族成员,主要在免疫系统和脂肪组织表达,与机体免疫、胰岛素抵抗和脂肪细胞分化关系密切,是近年来研究热点[60]。
PPARγ具有脂肪组织特异性,能被脂肪酸及外源性过氧化物酶体增殖剂激活,而调控某些参与脂质代谢的酶的表达,PPARγ过量表达会造成脂肪组织堆积,导致人体肥胖[58]。PPARγ作为脂质代谢中的重要的转录因子,同时也可以作为mTOR的下游信号分子参与脂质代谢调控[61]。研究发现,使用mTOR激动剂后,PPARγ的表达明显增加,巨噬细胞内脂蛋白脂酶表达增加。Li等研究发现,胃饥饿素可通过激活mTOR-PPARγ信号通路,促进肝细胞的脂肪合成,这表明mTOR激活PPARγ对细胞内的脂质蓄积具有重要意义[62]。同时,激活的PPARγ又会促进CD36的表达。
Ahn等研究发现给患有牙龈假单胞菌感染的小鼠喂食高脂膳食(High-fat Diet,HFD)会使CD36下游转录因子PPARγ的表达显著上调,之前的大量研究已经证明,CD36-PPARγ通路通过增加肝脏中游离脂肪酸的摄取和甘油三酯的合成,对HFD诱导的非酒精性脂肪肝起着至关重要的作用,这些研究共同证明,PPARγ表达增加导致CD36表达升高,从而加重HFD诱导的脂肪肝[57]。上述结果揭示了CD36和mTOR信号通路在脂质代谢中的作用,CD36通过mTOR信号通路激活PPARγ,促进细胞中脂质合成,同时活化的PPARγ又促进CD36的表达,造成脂质蓄积,形成自发性链式反应,最终导致细胞中脂质代谢紊乱(见图 2)。
3.3 CD36与MAPK信号通路丝裂原活化蛋白激酶通路(Mitogen-Activated Protein Kinase,MAPK)是真核生物信号传递网络中的重要途径之一,是细胞增殖、分化、凋亡以及正常条件和病理条件下应激反应的关键信号通路[63]。MAPK是一组进化保守的丝氨酸-苏氨酸激酶,包括4个不同的蛋白:胞外调节蛋白激酶(Extracellular Regulated Protein Kinase,ERK)、p38丝裂原活化蛋白激酶(p38 mitogen-Activated Protein Kinase,p38 MAPK)、c-Jun氨基末端激酶(c-Jun N-terminal Kinase,JNK)以及胞外调节蛋白激酶5(Extracellular Regulated Protein Kinase 5,ERK5),分别代表四条经典的MAPK信号通路,其磷酸化水平决定了活性程度[64]。
在机体血脂异常情况下,CD36可以通过激活氧化ERK5加快促凝剂磷脂酰丝氨酸与血小板表面接触,随后凝血酶原复合物被募集,产生纤维蛋白,最终促进动脉血栓形成[64]。Yun等在研究4-羟基壬烯醛(4-hydroxynonenal,HNE)和5-脂氧合酶(5-lipoxygenase,5-LO)在动脉粥样硬化中关系时发现,HNE增强了小鼠巨噬细胞CD36的表达并加快了ox-LDL的摄取,这一点可以通过干扰5-LO途径来抑制[65]。同时,使用HNE刺激巨噬细胞也会导致5-LO从胞质溶胶转移到核膜,并且可以增加5-LO主要下游产物白三烯B4(Leukotriene B4,LTB4)的形成。在不同的MAPK途径中,HNE主要激活巨噬细胞中的p38 MAPK,而p38 MAPK选择性抑制剂Adezmapimod (SB 203580)则可以抑制HNE诱导的LTB4产生。因此,HNE通过p38 MAPK途径介导的5-LO激活可能会增强CD36的表达和泡沫细胞的形成。Min等研究发现,使用ox-LDL处理RAW 264.7巨噬细胞,可以诱导p38 MAPK途径激活,促进CD36表达;姜黄素则可以抑制p38 MAPK途径激活,降低CD36表达,从而减少ox-LDL处理的RAW 264.7巨噬细胞中泡沫细胞生成(见图 2)[66]。
3.4 CD36与其他信号通路除此以外,CD36可以通过多种途径被调控表达[56, 67-68]。白细胞介素-4(Interleukin-4,IL-4)通过激活细胞内脂氧合酶和PPARγ配体PGJ2诱导巨噬细胞中CD36的表达[69]。在胃癌中,磷脂酰肌醇转移蛋白细胞质1(Phosphatidylinositol Transfer Protein Cytoplasmic 1,PITPNC1)上调PPARγ的RNA水平,PPARγ进而增强CD36和表达,从而提高FA吸收,促进FAO转移[70]。Mwaikambo等研究发现,缺氧通过缺氧诱导因子-1(Hypoxia Inducible Factor-1,HIF-1)和PI3K/AKT/mTOR通路上调视网膜上CD36的表达[71]。此外,研究发现非编码RNA调节CD36。在源自巨噬细胞的泡沫细胞中,miR-758-5p通过下调CD36 mRNA和蛋白水平降低细胞中的胆固醇摄取和脂质积累[72]。此外,ox-LDL通过(Nuclear Factor Kappa-B,NF-κB)途径增加长非编码RNA的转录,丰富了CD36启动子上β-连环蛋白的结合位点,并增加了泡沫细胞中脂质的摄取[69]。
4 总结与展望本文综述了CD36基因、蛋白结构和功能,表明了CD36在脂质代谢中发挥重要的枢纽作用,并系统性地总结了其级联多种信号通路参与脂质代谢的相关过程。CD36作为调节脂肪酸摄入的一个重要蛋白,在脂肪酸跨膜转运中起主导作用。如图 2所示,当细胞收到外界刺激时,CD36可直接参与AMPK信号通路活化,调节细胞内脂质蓄积;CD36通过mTOR信号通路激活PPARγ,促进细胞中脂质合成胞外脂质跨膜转运,证明了其在能量代谢和脂质蓄积过程中的重要作用;ox-LDL等信号分子会通过CD36激活p38 MAPK等信号通路,引起细胞内脂质代谢紊乱、炎症反应并诱发心血管疾病。但是,关于CD36表达阈值的研究较少,CD36作为受体介导LCFA信号,级联信号通路促进胞内酯化的分子机制尚不明确。此外,关于SR-A和SR-B1等其他清道夫受体参与脂质代谢过程的报道相对较少,有待进一步研究。目前,已经证实,CD36在肿瘤的生长、转移过程中发挥着中重要作用。CD36在脂质吸收、免疫识别、炎症、分子粘附和细胞凋亡中起着至关重要的作用,这些都影响着癌症的发生、发展和进展。CD36的调控和定位受复杂的信号通路控制,可能为肿瘤治疗提供潜在的药物靶点。CD36翻译后修饰,包括棕榈酰化、磷酸化和糖基化,调节CD36的易位和配体结合,这也可能为调节肿瘤细胞代谢提供有潜力的靶点。
| [1] |
CHORNER Z, BARBEAU P, CASTELLANI L, et al. Dietary α-linolenic acid supplementation alters skeletal muscle plasma membrane lipid composition, sarcolemmal FAT/CD36 abundance, and palmitate transport rates[J]. American Journal of Physiology-Regulatory Integrative and Comparative Physiology, 2016, 311(6): R1234-R1242. DOI:10.1152/ajpregu.00346.2016 (  0) 0) |
| [2] |
POZNYAK A, GRECHKO A V, POGGIO P, et al. The Diabetes Mellitus-Atherosclerosis Connection: The Role of Lipid and Glucose Metabolism and Chronic Inflammation[J]. International Journal of Molecular Sciences, 2020, 21(5): 1835. DOI:10.3390/ijms21051835 (  0) 0) |
| [3] |
叶健强, 蒋立, 王继文. 微粒体甘油三脂转运蛋白MTP的结构和功能研究概况[J]. 生物信息学, 2005, 3(3): 140-143. DOI: 0.3969/j.issn.1672-5565.2005.03.013. YE Jianqinag, JIANG Li, WANG Jiwen. Recent advance on microsomal triglyceride transfer protein[J]. Chinese Journal of Bioinformatics, 2005, 3(3): 140-143. DOI: 0.3969/j.issn.1672-5565.2005.03.013. (  0) 0) |
| [4] |
YANG L, HAN G, LIU Q, et al. Rice protein exerts a hypocholesterolemic effect through regulating cholesterol metabolism-related gene expression and enzyme activity in adult rats fed a cholesterol-enriched diet[J]. International journal of food sciences and nutrition, 2013, 64(7): 836-842. DOI:10.3109/09637486.2013.804038 (  0) 0) |
| [5] |
邵翅, 杨林. 调控胆固醇吸收的分子通路[J]. 生物信息学, 2015, 13(4): 239-243. SHAO Chi, YANG Lin. Molecular pathways of cholesterol absorption regulation[J]. China Journal of Bioinformatics, 2015, 13(4): 239-243. DOI:10.3969/j.issn.1672-5565.2015.04.06 (  0) 0) |
| [6] |
肖航, 冯平, 周岐海. 长寿与衰老相关分子机制研究进展[J]. 生物信息学, 2019, 17(4): 195-206. XIAO Hang, FENG Ping, ZHOU Qihai. Recent advances in molecular mechanisms related to longevity and aging[J]. Chinese Journal of Bioinformatics, 2019, 17(4): 195-206. DOI:10.12113/j.issn.1672-5565.201901007 (  0) 0) |
| [7] |
PŁÓCIENNIKOWSKA A, HROMADA-JUDYCKA A, BORZ CKA K, et al. Co-operation of TLR4 and raft proteins in LPS-induced pro-inflammatory signaling[J]. Cellular and Molecular Life Sciences, 2015, 72(3): 557-581. DOI:10.1007/s00018-014-1762-5 (  0) 0) |
| [8] |
周明学, 徐浩, 史大卓, 等. 西洋参茎叶总皂苷对载脂蛋白E基因敲除小鼠血脂及脂质代谢相关基因周脂素和CD36表达的影响[J]. 中国动脉硬化杂志, 2007, 15(12): 881-884. ZHOU Mingxue, XU Hao, SHI Dazhuo, et al. The effect of panax quinquefolius saponin on the gene expressions of perilipin and CD36 assosciated with lipid metabolism of apolipoprotein E-gene knockout mice[J]. Chinese Journal of Arteriosclerosis, 2007, 15(12): 881-884. DOI:10.3969/j.issn.1007-3949.2007.12.001 (  0) 0) |
| [9] |
SIMSEK B, EGELI B H, SELTE A, et al. Inflammatory hypothesis of atherogenesis: Will colchicine be added to the armamentarium in the prevention of coronary artery disease?[J]. American Heart Journal Plus: Cardiology Research and Practice, 2021, 9: 100057. DOI:10.1016/j.ahjo.2021.100057 (  0) 0) |
| [10] |
WANG H, FRANCO F, TSUI Y, et al. CD36-mediated metabolic adaptation supports regulatory T cell survival and function in tumors[J]. Nature Immunology, 2020, 21(3): 298-308. DOI:10.1038/s41590-019-0589-5 (  0) 0) |
| [11] |
FENG W W, WILKINS O, BANG S, et al. CD36-mediated metabolic rewiring of breast cancer cells promotes resistance to HER2-targeted therapies[J]. Cell Reports, 2019, 29(11): 3405-3420. DOI:10.1016/j.celrep.2019.11.008 (  0) 0) |
| [12] |
GLATZ J F C, NABBEN M, LUIKEN J J F P. CD36 (SR-B2) as master regulator of cellular fatty acid homeostasis[J]. Current Opinion in Lipidology, 2022, 33(2): 103-111. DOI:10.1097/MOL.0000000000000819 (  0) 0) |
| [13] |
TANASE C, ENCIU A M, CODRICI E, et al. Fatty Acids, CD36, Thrombospondin-1, and CD47 in Glioblastoma: Together and/or Separately?[J]. International Journal of Molecular Sciences, 2022, 23(2): 604. DOI:10.3390/ijms23020604 (  0) 0) |
| [14] |
杨晓茹, 陈宇浩, 郝慧芳. CD36在炎症反应和脂质代谢中的作用[J]. 生命科学, 2019, 31(11): 1192-1199. YANG Xiaoru, CHEN Yuhao, HE Huifang. Chinese Bulletin of Life SciencesThe role of CD36 in inflammatory response and lipid metabolism[J]. Chinese Bulletin of Life Sciences, 2019, 31(11): 1192-1199. DOI:10.13376/j.cbls/2019147 (  0) 0) |
| [15] |
GLATZ J F C, LUIKEN J J F P, NABBEN M. CD36 (SR-B2) as a target to treat lipid overload-induced cardiac dysfunction[J]. Journal of Lipid and Atherosclerosis, 2020, 9(1): 6678. DOI:10.12997/jla.2020.9.1.66 (  0) 0) |
| [16] |
LI H, YANG L, YANG H, et al. Rice protein regulates HDL metabolism-related gene expression and enzyme activity in adult rats[J]. Food Bioscience, 2014, 8: 1-7. DOI:10.1016/j.fbio.2014.08.001 (  0) 0) |
| [17] |
彭雪, 杨林, 刘巧红, 等. 大米蛋白调控成熟期大鼠LDLR基因及蛋白表达[J]. 生物信息学, 2013, 11(2): 120-123. PENG Xue, YANG Lin, LIU Qiaohong, et al. Rice protein affects gene and protein expressions of LDLR in adult rats[J]. Chinese Journal of Bioinformatics, 2013, 11(2): 120-123. DOI:10.3969/j.issn.1672-5565.2013.02.08 (  0) 0) |
| [18] |
PRABHUDAS M, BOWDISH D, DRICKAMER K, et al. Standardizing scavenger receptor nomenclature[J]. Journal of Immunology, 2014, 192(5): 1997-2006. DOI:10.4049/jimmunol.1490003 (  0) 0) |
| [19] |
ZHANG Y, LIU H, SHI S, Et al. CD36 inhibition partially attenuates myocardial injury in diabetic rats with ischemic postconditioning[J]. BMJ Open Diabetes Research & Care, 2022, 10(5): e2879. DOI:10.1136/bmjdrc-2022-002879 (  0) 0) |
| [20] |
ZANI I, STEPHEN S, MUGHAL N, et al. Scavenger receptor structure and function in health and disease[J]. Cells, 2015, 4(2): 178-201. DOI:10.3390/cells4020178 (  0) 0) |
| [21] |
PRABHUDAS M R, BALDWIN C L, BOLLYKY P L, et al. A consensus definitive classification of scavenger receptors and their roles in health and disease[J]. Journal of immunology, 2017, 198(10): 3775-3789. DOI:10.4049/jimmunol.1700373 (  0) 0) |
| [22] |
NECULAI D, SCHWAKE M, RAVICHANDRAN M, et al. Structure of LIMP-2 provides functional insights with implications for SR-BⅠ and CD36[J]. Nature, 2013, 504(7478): 172-176. DOI:10.1038/nature12684 (  0) 0) |
| [23] |
黄晓妍, 黎嘉琳, 冀慎英, 等. 糖脂转运蛋白家族新成员人类GLTPD2的生物信息学分析[J]. 生物信息学, 2021, 19(3): 216-222. HUANG Xiaoyan, LI Jialin, JI Shenying, et al. Bioinformatics analysis of human GLTPD2, a new member of the glycolipid transfer protein family[J]. Chinese Journal of Bioinformatics, 2021, 19(3): 216-222. DOI:10.12113/202004012 (  0) 0) |
| [24] |
ZHAO L, LI Y, DING Q, et al. CD36 senses dietary lipids and regulates lipids homeostasis in the intestine[J]. Frontiers in Physiology, 2021, 12: 669279. DOI:10.3389/fphys.2021.669279 (  0) 0) |
| [25] |
CHEN Y, ZHANG J, CUI W, et al. CD36, a signaling receptor and fatty acid transporter that regulates immune cell metabolism and fate[J]. Journal of Experimental Medicine, 2022, 219(6): e20211314. DOI:10.1084/jem.20211314 (  0) 0) |
| [26] |
MARTIN C, CHEVROT M, POIRIER H, et al. CD36 as a lipid sensor[J]. Physiology & Behavior, 2011, 105(1): 36-42. DOI:10.1016/j.physbeh.2011.02.029 (  0) 0) |
| [27] |
LI Y, HUANG X, YANG G, et al. CD36 favours fat sensing and transport to govern lipid metabolism[J]. Progress in Lipid Research, 2022, 88: 101193. DOI:10.1016/j.plipres.2022.101193 (  0) 0) |
| [28] |
SHU H, PENG Y, HANG W, et al. The role of CD36 in cardiovascular disease[J]. Cardiovascular Research, 2022, 118(1): 115-129. DOI:10.1093/cvr/cvaa319 (  0) 0) |
| [29] |
WANG S, DENG S, CAO Y, et al. Overexpression of toll-like receptor 4 contributes to phagocytosis of Salmonella Enterica serovar typhimurium via phosphoinositide 3-kinase signaling in sheep[J]. Cellular Physiology and Biochemistry, 2018, 49(2): 662-677. DOI:10.1159/000493032 (  0) 0) |
| [30] |
ZHAO L, VARGHESE Z, MOORHEAD J F, et al. CD36 and lipid metabolism in the evolution of atherosclerosis[J]. British Medical Bulletin, 2018, 126(1): 101-112. DOI:10.1093/bmb/ldy006 (  0) 0) |
| [31] |
LAUGERETTE F. CD36 involvement in orosensory detection of dietary lipids, spontaneous fat preference, and digestive secretions[J]. Journal of Clinical Investigation, 2005, 115(11): 3177-3184. DOI:10.1172/JCI25299 (  0) 0) |
| [32] |
SUNDARESAN S, ABUMRAD N A. Dietary lipids inform the gut and brain about meal arrival via CD36-mediated signal transduction[J]. Journal of Nutrition, 2015, 145(10): 2195-2200. DOI:10.3945/jn.115.215483 (  0) 0) |
| [33] |
BENTON C R, HAN X, FEBBRAIO M, et al. Inverse relationship between PGC-1α protein expression and triacylglycerol accumulation in rodent skeletal muscle[J]. Journal of Applied Physiology, 2006, 100(2): 377-383. DOI:10.1152/japplphysiol.00781.2005 (  0) 0) |
| [34] |
FEBBRAIO M, HAJJAR D, SILVERSTEIN R. CD36: A class B scavenger receptor involved in angiogenesis, atherosclerosis, inflammation, and lipid metabolism[J]. Journal of Clinical Investigation, 2001, 108(6): 785-791. DOI:10.1172/JCI14006 (  0) 0) |
| [35] |
HUA W, HUANG H, TAN L, et al. CD36 mediated fatty acid-induced podocyte apoptosis via oxidative stress[J]. PLoS One, 2015, 10(5): e127507. DOI:10.1371/journal.pone.0127507 (  0) 0) |
| [36] |
FENG Lei, GU Chengwu, LI Yanxia, et al. High glucose promotes CD36 expression by upregulating peroxisome proliferator-activated receptor γ levels to exacerbate lipid deposition in renal tubular cells[J]. BioMed Research International, 2017, 2017: 1414070. DOI:10.1155/2017/1414070 (  0) 0) |
| [37] |
CHISTIAKOV D A, BOBRYSHEV Y V, OREKHOV A N. Macrophage-mediated cholesterol handling in atherosclerosis[J]. Journal of Cellular and Molecular Medicine, 2016, 20(1): 17-28. DOI:10.1111/jcmm.12689 (  0) 0) |
| [38] |
CHEN D D, HUI L L, ZHANG X C, et al. NEAT1 contributes to ox-LDL-induced inflammation and oxidative stress in macrophages through inhibiting miR-128[J]. Journal of Cellular Biochemistry, 2019, 120(2): 2493-2501. DOI:10.1002/jcb.27541 (  0) 0) |
| [39] |
GYAMFI J, YEO J H, KWON D, et al. Interaction between CD36 and FABP4 modulates adipocyte-induced fatty acid import and metabolism in breast cancer[J]. NPJ Breast Cancer, 2021, 7(1): 129. DOI:10.1038/s41523-021-00324-7 (  0) 0) |
| [40] |
ANGIN Y, STEINBUSCH L K M, SIMONS P J, et al. CD36 inhibition prevents lipid accumulation and contractile dysfunction in rat cardiomyocytes[J]. Biochemical Journal, 2012, 448(1): 43-53. DOI:10.1042/BJ20120060 (  0) 0) |
| [41] |
FUKUSHIMA A, MILNER K, GUPTA A, et al. Myocardial energy substrate metabolism in heart failure: From pathways to therapeutic targets[J]. Current Pharmaceutical Design, 2015, 21(25): 3654-3664. DOI:10.2174/1381612821666150710150445 (  0) 0) |
| [42] |
UMBARAWAN Y, SYAMSUNARNO M R A A, KOITABASHI N, et al. Glucose is preferentially utilized for biomass synthesis in pressure-overloaded hearts: evidence from fatty acid-binding protein-4 and -5 knockout mice[J]. Cardiovascular Research, 2018, 114(8): 1132-1144. DOI:10.1093/cvr/cvy063 (  0) 0) |
| [43] |
JELENIK T, FLÖGEL U, ÁLVAREZ-HERNÁNDEZ E, et al. Insulin Resistance and Vulnerability to Cardiac Ischemia[J]. Diabetes, 2018, 67(12): 2695-2702. DOI:10.2337/db18-0449 (  0) 0) |
| [44] |
ADRIAN L, LENSKI M, TÖDTER K, et al. AMPK prevents palmitic acid-induced apoptosis and lipid accumulation in cardiomyocytes[J]. Lipids, 2017, 52(9): 737-750. DOI:10.1007/s11745-017-4285-7 (  0) 0) |
| [45] |
DEHN S, THORP E B. Myeloid receptor CD36 is required for early phagocytosis of myocardial infarcts and induction of Nr4a1-dependent mechanisms of cardiac repair[J]. The FASEB Journal, 2018, 32(1): 254-264. DOI:10.1096/fj.201700450R (  0) 0) |
| [46] |
DELEON-PENNELL K Y, TIAN Y, ZHANG B, et al. CD36 is a matrix metalloproteinase-9 substrate that stimulates neutrophil apoptosis and removal during cardiac remodeling[J]. Circulation: Cardiovascular Genetics, 2016, 9(1): 14-25. DOI:10.1161/CIRCGENETICS.115.001249 (  0) 0) |
| [47] |
LINDSEY M L, JUNG M, YABLUCHANSKIY A, et al. Exogenous CXCL4 infusion inhibits macrophage phagocytosis by limiting CD36 signalling to enhance post-myocardial infarction cardiac dilation and mortality[J]. Cardiovascular Research, 2019, 115(2): 395-408. DOI:10.1093/cvr/cvy211 (  0) 0) |
| [48] |
SNAEBJORNSSON M T, JANAKI-RAMAN S, SCHULZE A. Greasing the wheels of the cancer machine: The role of lipid metabolism in cancer[J]. Cell Metab, 2020, 31(1): 62-76. DOI:10.1016/j.cmet.2019.11.010 (  0) 0) |
| [49] |
GLATZ J, WANG F, NABBEN M, et al. CD36 as a target for metabolic modulation therapy in cardiac disease[J]. Expert Opin Ther Targets, 2021, 25(5): 393-400. DOI:10.1080/14728222.2021.1941865 (  0) 0) |
| [50] |
RUAN C, MENG Y, SONG H. CD36: An emerging therapeutic target for cancer and its molecular mechanisms[J]. Journal of Cancer Research and Clinical Oncology, 2022, 148(7): 1551-1558. DOI:10.1007/s00432-022-03957-8 (  0) 0) |
| [51] |
LADANYI A, MUKHERJEE A, KENNY H A, et al. Adipocyte-induced CD36 expression drives ovarian cancer progression and metastasis[J]. Oncogene, 2018, 37(17): 2285-2301. DOI:10.1038/s41388-017-0093-z (  0) 0) |
| [52] |
PASCUAL G, DOMÍNGUEZ D, ELOSÚA-BAYES M, et al. Dietary palmitic acid promotes a prometastatic memory via Schwann cells[J]. 2021, 299(7885): 485-490. DOI: 10.1038/s41586-021-04075-0.
(  0) 0) |
| [53] |
WU W, WANG S, LIU Q, et al. AMPK facilitates intestinal long-chain fatty acid uptake by manipulating CD36 expression and translocation[J]. The FASEB Journal, 2020, 34(4): 4852-4869. DOI:10.1096/fj.201901994R (  0) 0) |
| [54] |
SAMOVSKI D, SUN J, PIETKA T, et al. Regulation of AMPK activation by CD36 links fatty ccid Uptake to β-oxidation[J]. Diabetes, 2015, 64(2): 353-359. DOI:10.2337/db14-0582 (  0) 0) |
| [55] |
LI Y, YANG P, ZHAO L, et al. CD36 plays a negative role in the regulation of lipophagy in hepatocytes through an AMPK-dependent pathway[J]. Journal of Lipid Research, 2019, 60(4): 844-855. DOI:10.1194/jlr.M090969 (  0) 0) |
| [56] |
ZHANG X, FAN J, LI H, et al. CD36 signaling in diabetic cardiomyopathy[J]. Aging and Disease, 2021, 12(3): 826-840. DOI:10.14336/AD.2020.1217 (  0) 0) |
| [57] |
AHN J, JI W, OH S, et al. Porphyromonas gingivalis exacerbates the progression of fatty liver disease via CD36-PPARγ pathway[J]. BMB Reports, 2021, 54(6): 323-328. DOI:10.5483/BMBRep.2021.54.6.050 (  0) 0) |
| [58] |
LIU Jing, ZHAO Hang, YANG Linlin, et al. The role of CD36-Fabp4-PPARγ in skeletal muscle involves insulin resistance in intrauterine growth retardation mice with catch-up growth[J]. BMC Endocrine Disorders, 2022, 22(1): 10. DOI:10.1186/s12902-021-00921-4 (  0) 0) |
| [59] |
王川. 高脂及炎症状态激活mTOR信号通路致肝脏CD36翻译效率升高[D]. 重庆: 重庆医科大学, 2014. DOI: 10.7666/d.Y2690452. WANG Chuan. High fat and inflammation increases hepatic CD36 translational efficiency via activation of the mTOR signalling pathway[D]. Chongqing: Chongqing Medical University, 2014. DOI: 10.7666/d.Y2690452. (  0) 0) |
| [60] |
许恒勇, 王继文, 蒋立. PPAR基因在脊椎动物发育过程中的功能研究[J]. 生物信息学, 2004, 2(1): 41-45. XU Hengyong, WANG Jiwen, JIANG Li. PPAR expression and function during vertebrate development[J]. Chinese Journal of Bioinformatics, 2004, 2(1): 41-45. DOI:10.3969/j.issn.1672-5565.2004.01.010 (  0) 0) |
| [61] |
FESTUCCIA W T, BLANCHARD P, BELCHIOR T, et al. PPARγ activation attenuates glucose intolerance induced by mTOR inhibition with rapamycin in rats[J]. American Journal of Physiology-Endocrinology and Metabolism, 2014, 306(9): E1046-E1054. DOI:10.1152/ajpendo.00683.2013 (  0) 0) |
| [62] |
LI Z, XU G, QIN Y, et al. Ghrelin promotes hepatic lipogenesis by activation of mTOR-PPARγ signaling pathway[J]. Proceedings of the National Academy of Sciences, 2014, 111(36): 13163-13168. DOI:10.1073/pnas.1411571111 (  0) 0) |
| [63] |
PRASAD G V R K, DHAR V, MUKHOPADHAYA A. Vibrio cholerae Ompu mediates CD36-dependent reactive oxygen species generation triggering an additional pathway of MAPK activation in macrophages[J]. Journal of Immunology, 2019, 202(8): 2431-2450. DOI:10.4049/jimmunol.1800389 (  0) 0) |
| [64] |
YANG M, KHOLMUKHAMEDOV A, SCHULTE M L, et al. Platelet CD36 signaling through ERK5 promotes caspase-dependent procoagulant activity and fibrin deposition in vivo[J]. Blood Advances, 2018, 2(21): 2848-2861. DOI:10.1182/bloodadvances.2018025411 (  0) 0) |
| [65] |
YUN M R, IM D S, LEE S J, et al. 4-Hydroxynonenal enhances CD36 expression on murine macrophages via p38 MAPK-mediated activation of 5-lipoxygenase[J]. Free Radical Biology and Medicine, 2009, 46(5): 692-698. DOI:10.1016/j.freeradbiomed.2008.12.013 (  0) 0) |
| [66] |
MIN K, UM H J, CHO K, et al. Curcumin inhibits oxLDL-induced CD36 expression and foam cell formation through the inhibition of p38 MAPK phosphorylation[J]. Food and Chemical Toxicology, 2013, 58: 77-85. DOI:10.1016/j.fct.2013.04.008 (  0) 0) |
| [67] |
KARUNAKARAN U, ELUMALAI S, MOON J, et al. Cd36 signal transduction in metabolic diseases: Novel insights and therapeutic targeting[J]. Cells, 2021, 10(7): 1833. DOI:10.3390/cells10071833 (  0) 0) |
| [68] |
ULUG E, NERGIZ-UNAL R. Dietary fatty acids and CD36-mediated cholesterol homeostasis: potential mechanisms[J]. Nutrition Research Reviews, 2021, 34(1): 64-77. DOI:10.1017/S0954422420000128 (  0) 0) |
| [69] |
WANG J, LI Y. CD36 tango in cancer: signaling pathways and functions[J]. Theranostics, 2019, 9(17): 4893-4908. DOI:10.7150/thno.36037 (  0) 0) |
| [70] |
LUO Xiaoqing, ZHENG Enze, WEI Li, et al. The fatty acid receptor CD36 promotes HCC progression through activating Src/PI3K/AKT axis-dependent aerobic glycolysis[J]. Cell Death & Disease, 2021, 12(4): 328. DOI:10.1038/s41419-021-03596-w (  0) 0) |
| [71] |
MWAIKAMBO B R, YANG C, CHEMTOB S, et al. Hypoxia up-regulates CD36 expression and function via hypoxia-inducible factor-1-and phosphatidylinositol 3-kinase-dependent mechanisms[J]. Journal of Biological Chemistry, 2009, 284(39): 26695-26707. DOI:10.1074/jbc.M109.033480 (  0) 0) |
| [72] |
LI B, XIA L, LIU J, et al. miR-758-5p regulates cholesterol uptake via targeting the CD36 3'UTR[J]. Biochemical and Biophysical Research Communications, 2017, 494(1-2): 384-389. DOI:10.1016/j.bbrc.2017.09.150 (  0) 0) |
 2023, Vol. 21
2023, Vol. 21


