衰老是一个复杂的生理过程,主要表现为生物学功能随时间下降、对多种压力的抗性下降及对各种疾病的易感性增加[1]。研究显示线粒体状态、营养感应、细胞间通讯、干细胞更新和组织再生能力等分子标志与衰老密切相关[2]。衰老研究的主要目标在于发展干预措施,延缓衰老相关疾病的发生,进而延长个体的健康寿命[3],阐明衰老的分子机制,寻找相应的抗衰老药物及其作用靶点,对实现这一目标至关重要。
多球壳菌素(Myriocin),分子式C21H39NO6,是昆虫病原真菌冬虫夏草的代谢物,又名ISP-1和Thermozymocidin,它能够特异抑制神经鞘脂合成第一步反应限速酶—丝氨酸棕榈转移酶(SPT)活性,从而降低神经鞘脂前体物鞘氨醇的合成[4]。我们前期研究显示多球壳菌素可显著延长芽殖酵母[5]和裂殖酵母[6]的寿命,为进一步阐明多球壳菌素延长酵母细胞寿命的作用机制,本研究利用生物信息学分析了多球壳菌素对对数期芽殖酵母细胞转录组的影响,并对部分生信分析结果进行了功能验证。生信分析和功能验证实验均发现多球壳菌素处理介导了线粒体相关信号通路和功能,本研究为下一步深入阐明多球壳菌素的抗衰老机制提供了依据和线索。
1 材料与方法 1.1 生物信息学分析 1.1.1 实验材料与原始数据实验菌种、培养基及处理均参照文献[5]。菌种为野生型芽殖酵母(Saccharomyces cerevisiae)DBY746;培养基为SDC(Synthetic Dextrose Complete);实验处理为:在菌种生长对数期(OD600nm=2.0)时收集处理组(300 ng/mL Myr,记为M组)和无药物处理组(-Myr,记为C组)的细胞,得到对数期无药物处理组(C1)与300 ng/mL Myr处理组(M1)。然后提取细胞总RNA并进行基因芯片检测,得到微阵列MAS5信号值作为原始数据。
1.1.2 主成分分析(Principal Component Analysis, PCA)首先,通过R语言及R Studio下的扩展包“psych”,对每个样本所有探针信号值数据做降维处理,提取3个主成分;再通过扩展包“rgl”,将三个主成分的因子载荷(loadings)作为三维坐标,进行可视化。
1.1.3 差异表达基因(Differentially Expressed Genes, DEGs)通过使用R语言下的“Bioconductor”扩展包分析基因芯片数据,得到原始差异表达基因列表。保留Column ID、Gene Symbol、Gene Title、p-value、q-value、Fold-Change、Fold-Change (Description)7个指标。并以q value < 0.05为筛选条件,剔除不符的探针。再通过在线程序DAVID (Database for Annotation, Visualization and Integrated Discovery, 6.8版本)将基因注释补充完整,同时利用在线软件YEASTRACT (Yeast Search for Transcriptional Regulators And Consensus Tracking)添加全部基因的开放阅读框(Open reading frame, ORF)与基因标记(Gene Symbol),最后剔除无注释的基因,获得最终的差异表达基因列表。
1.1.4 热图(Heatmap)通过R语言(3.3版本)及R Studio下的扩展包“heatmap.2”对探针的信号值进行读取并对其进行可视化。
1.1.5 基因本体聚类(GO Terms Analysis)利用在线程序DAVID中的Functional Annotation Clustering工具,分别对基因差异列表中上调差异基因与下调差异基因进行基因本体聚类,并以Benjamin < 0.05为阈值筛选所获得的聚类,从而得到最终的Go Terms分析结果。
1.1.6 信号通路分析(Pathways Analysis)利用在线程序DAVID中的Functional Annotation Clustering工具,分别对基因差异列表中上调差异基因与下调差异基因进行信号通路聚类,同样以Benjamin < 0.05为阈值筛选聚类簇,从而获得最终的信号通路结果。
1.2 多球壳菌素对线粒体功能的影响 1.2.1 菌株、培养基及生长条件从-80 ℃取出所需芽殖酵母菌株(DBY746),活化于YPD固体平板上,30 ℃培养2~3 d。取新鲜平板菌落3~5个,接种于2.5 mL培养基中制备饱和过夜培养物(Saturated Overnight Culture,SONC)并测定其OD600nm值。向盛有25 mL SDC培养基中的150 mL三角瓶中加入配制好的多球壳菌素储液,使其最终浓度为300 ng/mL,另一瓶中加入相同体积的95%的乙醇,轻微振荡混匀后向培养基中加入一定体积的SONC培养液,保证菌液起始浓度为OD600nm=0.05,置于30 ℃恒温培养振荡箱中,220 rmp振荡培养。
1.2.2 ROS的测定在OD600nm=2.0时取0.5 OD的细胞,5 000 rpm离心4 min去除上清,加入1 mL无菌水重悬浮细胞,而后加入二氢乙锭(Dihydroethidium,DHE)染料并使其终浓度为30 μM,30 ℃避光条件下振荡培养30 min,后用PBS(137 mM NaCl, 2.7 mM KCl, 10 mM Na2HPO4, 1.8 mM KH2PO4, pH 7.4)洗涤细胞3次,最后加入100 μL PBS悬浮细胞,置于荧光显微镜下观察,统计视野中被染色细胞数量并计算其占所有比例。
1.2.3 线粒体跨膜电位的测定在OD600nm=2.0时取0.5 OD的菌液,5 000 rpm离心4 min去除上清液,并加入1 mL无菌水重悬浮细胞,而后加入罗丹明123(Rhodamine 123,Rh123)染料使其终浓度为10 μM,30 ℃避光条件下振荡培养60 min,然后用PBS洗涤细胞3次,最后加入100 μL PBS悬浮细胞,置于荧光显微镜下观察,统计视野中被染色细胞数量并计算其所占比例。
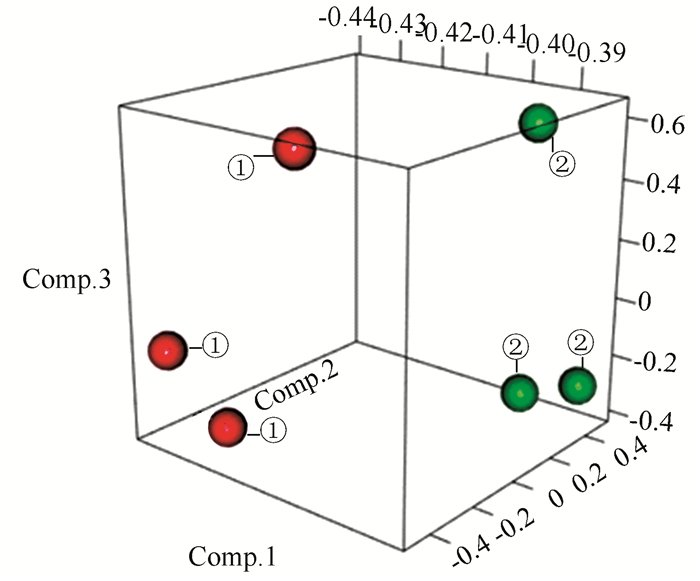
2 结果 2.1 生物信息学分析结果 2.1.1 主成分分析主成分分析数据见表 1,其可视化结果如图 1所示。对两个处理的三个主成分进行统计学差异分析,可得出多球壳菌素处理组与无药物处理组(M1 VS C1)在提取主成分1及主成分2中呈现出显著性差异(P值分别为0.039及0.001)。
| 表 1 主成分分析数据 Table 1 PCA data |
|
图 1 主成分分析 Figure 1 Principle component analysis 注:①代表无药物处理组; ②代表多球壳菌素处理组对数期;Comp.1、Comp.2、Comp.3分别代表样本的主成分1、2、3的因子载荷。 |
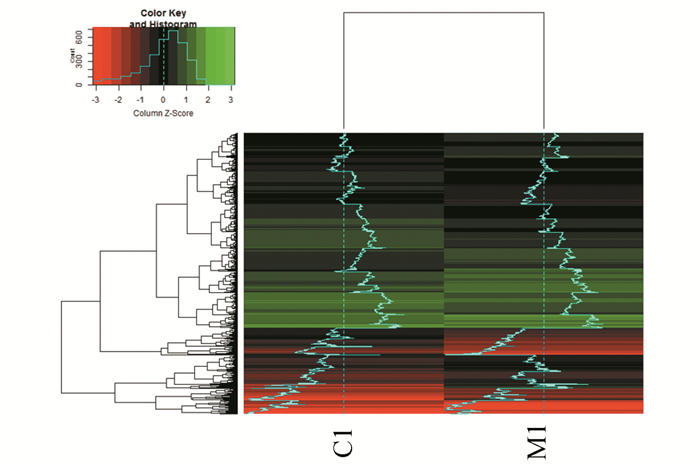
分析得到多球壳菌素处理后差异表达基因数目如表 2,相比于无药物处理组,有1 648个基因(包括上调基因843个,下调基因805个)发生显著性差异表达。通过pearson分析生成聚类热图,对原始数据转化后验证其为正态分布,其分层聚类结果如图 2。
| 表 2 差异表达基因数目 Table 2 The number of differentially expressed genes (DEGs) |
|
图 2 热图分析 Figure 2 Heatmap analysis 注:红色代表基因上调,绿色代表基因下调,折线越偏离基线表示基因上调(基线左侧)或下调(基线右侧)的越明显(详见电子版:http://swxxx.alljournals.cn/ch/index.aspx)。 |
C1与M1表达上调基因聚类结果如图 3(a)所示,分析结果显示:多球壳菌素处理导致6条生物过程,8条细胞组成及3条分子功能发生改变,其中生物过程主要包括:氧化还原过程(GO:0055114 oxidation-reduction process)、三羧酸循环(GO:0006099 tricarboxylic acid cycle)等。细胞组成聚类主要有:过氧化物酶体(GO:0005777 peroxisome)、线粒体(GO:0005739 mitochondrion)等。分子功能聚类主要包括:氧化还原酶活性(GO:0016491 oxidoreductase activity)、蛋白激酶活性(GO:0004672 protein kinase activity)等。C1与M1表达下调基因聚类结果如图 3(b)所示,分析结果主要涉及:生物过程12条,细胞组成6条,分子功能7条,其中生物过程主要有:蛋白质糖基化(GO:0006486 protein glycosylation)、跨膜运输(GO:0055085 transmembrane transport)等。细胞组成聚类主要有:内质网(GO:0005783 endoplasmic reticulum)、膜(GO:0016021 integral component of membrane)等。分子功能聚类主要包括:转移酶活性(GO:0016757 transferase activity, transferring glycosyl groups)、磷酸二氢盐-甘露糖-蛋白质甘露糖基转移酶Pmt1p-Pmt2p二聚体复合物(GO:0004169 dolichyl-phosphate-mannose-protein mannosyltransferase activity)等。生物学过程大多发生于线粒体区域,分子功能也与线粒体密切相关,细胞组成中均涉及线粒体,由此可见,线粒体很可能是多球壳菌素调控衰老的一个靶点。

|
图 3 GO聚类分析 Figure 3 GO clustering analysis 注:图中下方为通路名称;左纵坐标为通路所包含基因数目;右纵坐标为-lg(Benjamini)值该值越大表示该通路发生的差异越显著。 |
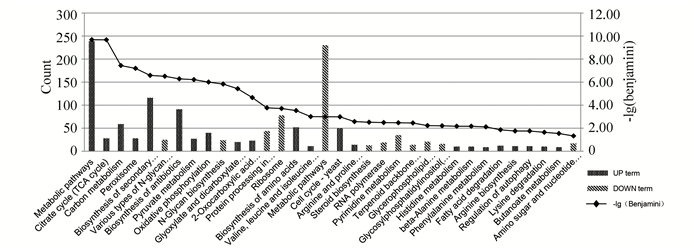
通路分析结果如图 4所示,筛选后得到:表达上调基因通路涉及17条,表达下降的通路涉及7条,其中上调通路有:代谢途径(sce01100 Metabolic pathways)、氧化磷酸化(sce00190 Oxidative phosphorylation)等,下调通路有:糖基化磷脂酰肌醇锚定蛋白的生物合成(sce00563 Glycosylphosphatidylinositol(GPI)-anchor biosynthesis)、N-聚糖的生物合成(sce00510 N-Glycan biosynthesis)等。这些通路与线粒体密切相关,由此可见多球壳菌素会影响线粒体相关功能进而影响酵母衰老过程。
|
图 4 信号通路分析 Figure 4 Signaling pathway analysis 注:图下方为通路名称;左纵坐标为通路所包含基因数目;右纵坐标为-lg(Benjamini)值,该值越大表示该通路发生的差异越显著。 |
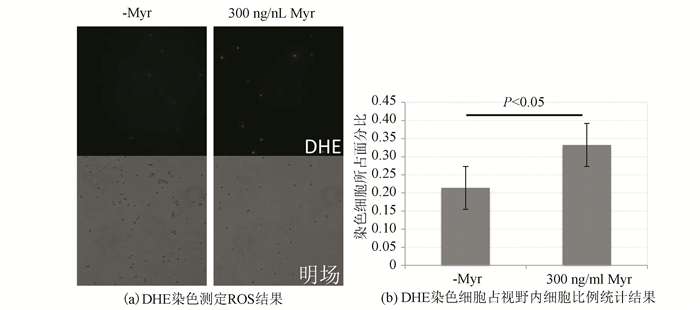
多球壳菌素处理组和非药物处理组细胞的ROS产生量如图 5(a)所示,多球壳菌素处理的对数期细胞ROS含量明显高于无药物处理组。经对每个样本三个不同视野里的染色细胞进行统计学分析可获得图 5(b)所示结果,该结果显示实验数据集的离散程度较小,显示多球壳菌素可以显著增加对数期细胞的ROS含量。
|
图 5 ROS的测定 Figure 5 Measurement of ROS 注:红色细胞为被DHE着色的细胞(详见电子版:http://swxxx.alljournals.cn/ch/index.aspx)。 |
多球壳菌素处理组和非药物处理组细胞的线粒体膜电位的结果如图 6(a)所示,对数期时,300 ng/mL多球壳菌素处理的细胞的MMP明显高于无药物处理组的细胞。对染色细胞比例进行统计学分析,可获得图 6(b)所示结果,显示多球壳菌素可以显著增强对数期细胞的线粒体膜电位。
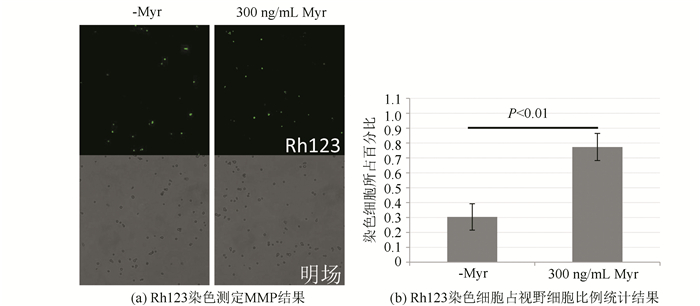
|
图 6 线粒体膜电位的测定 Figure 6 Measurement of mitochondrial membrane potential 注:绿色细胞为被Rh123着色的细胞,比例越大代表细胞线粒体膜电位越大(详见电子版:http://swxxx.alljournals.cn/ch/index.aspx)。 |
主成分分析显示多球壳菌素处理组与不加药处理组在转录组水平呈显著差异,生信分析结果与Huang等[5]在芽殖酵母实验中得到的一致。
多球壳菌素处理对数期细胞导致1 648个基因的差异表达(FDR < 0.05,Fold Change > 1.5),其中843个基因显著上调,805个基因显著下调,其中Fold Change较大或较小的基因有:AAC3、AQR1、JEN1、TKL2、SPG1等。其中AAC3基因为ADP/ATP载体蛋白编码基因,其活性将显著影响酿酒酵母的生长[7]。AQR1是参与氨基酸分泌的内膜转运蛋白编码基因,此蛋白在酿酒酵母内部结构中均有发现,在各个细胞器膜与质膜间起运输作用[8]。JEN1为唾液酸转运蛋白,与转录的抑制、mRNA降解、蛋白质降解有关,其可以调节酿酒酵母乳酸的输出,对酵母的寿命调控起重要作用[9]。由此可知,天然产物多球壳菌素将显著影响与酿酒酵母寿命相关的基因。而显著变化的基因中有一部分与线粒体的生物过程相关。
根据差异基因本体聚类分析得出,多球壳菌素会对生物过程、细胞组成、分子功能等多个方面产生影响,其中影响较大的有过氧化物酶体、氧化磷酸化和三羧酸循环等。通过通路分析,得到基因在所涉及的代谢网络中的具体位置,发现多球壳菌素会对代谢途径、氧化磷酸化通路等途径产生较大影响,这些生物学特性均与线粒体相关,现已证实,缺乏线粒体或其功能不全将会严重影响酵母细胞达到标准的生命周期的能力[10-11],线粒体在寿命调控机制中起重要作用[12]。
因此,研究多球壳菌素作用于线粒体途径将有利于揭示其抗衰老的机制,线粒体ROS与线粒体跨膜电位是衡量酿酒酵母是否处于凋亡的重要指标,对验证生物信息学分析得到的多球壳菌素作用在线粒体相关分子功能、细胞组分、生物过程和信号通路的靶点有重要作用。
3.4 线粒体相关功能验证功能验证实验结果显示,在对数期,多球壳菌素处理可以显著增加细胞ROS的产生并增强线粒体膜电位。ROS主要由线粒体呼吸作用产生[13],前人研究结果显示对数期ROS的适当升高可以延长寿命[2, 13],我们结果也显示多球壳菌素处理对数期细胞增加ROS含量,推测多球壳菌素上调对数期细胞氧化磷酸化和三羧酸循环等线粒体相关通路。线粒体膜电位是凋亡激活的指标之一,其在细胞凋亡早期病理变化以前就开始下降[14],而多球壳菌素处理在对数期显著增强MMP,因而可能延后了细胞凋亡,从而延长了酵母细胞的寿命。
因此我们推测介导呼吸作用可能是多球壳菌素延缓细胞衰老的基本途径且它对平衡ROS和MMP十分重要,后续的相关验证实验也将针对ATP水平、呼吸链中的酶含量等进行,进一步探究多球壳菌素对线粒体呼吸作用的影响。
4 结论线粒体功能失调是衰老的标志之一,本研究结果显示,多球壳菌素可以靶向对数期细胞线粒体而延长芽殖酵母细胞寿命,本结论为多球壳菌素介导寿命调控的深入分子机制研究奠定了一定基础。后期,将继续开展多球壳菌素对稳定期细胞线粒体功能的影响相关研究,以期对多球壳菌素介导线粒体功能调控细胞衰老的机制有更全面和清晰的认识。
| [1] |
HE S, SHARPLESS N E. Senescence in health and disease[J]. Cell, 2017, 169(6): 1000-1011. DOI:10.1016/j.cell.2017.05.015 (  0) 0) |
| [2] |
LOPEZ-OTIN C, BLASCO M A, PARTRIDGE L, et al. , The hallmarks of aging[J]. Cell, 2013, 153(6): 1194-217. DOI:10.1016/j.cell.2013.05.039 (  0) 0) |
| [3] |
KUMAR S, LOMBARD D B. Finding ponce de leon's pill: challenges in screening for anti-aging molecules[J]. F1000 Research, 2016, 5. DOI:10.12688/f1000research.7821.1 (  0) 0) |
| [4] |
LIU J, HUANG X, WITHERS B R, et al. Reducing sphingolipid synthesis orchestrates global changes to extend yeast lifespan[J]. Aging Cell, 2013, 12(5): 833-841. DOI:10.1111/acel.12107 (  0) 0) |
| [5] |
HUANG X, LIU J, DICKSON R C. Down-regulating sphingolipid synthesis increases yeast lifespan[J]. PLoS Genetics, 2012, 8(2): e1002493. DOI:10.1371/journal.pgen.1002493 (  0) 0) |
| [6] |
高杰, 朱荣, 黄新河. 多球壳菌素延长裂殖酵母细胞寿命可能机制研究[J]. 天然产物研究与开发, 2017, 29(6): 917-923. DOI:10.16333/j.1001-6880.2017.6.003 (  0) 0) |
| [7] |
DRGON T, SABOVA L, NELSON N, et al. ADP/ATP translocator is essential only for anaerobic growth of yeast Saccharomyces cerevisiae[J]. FEBS Letters, 1991, 289(2): 159-162. DOI:10.1016/0014-5793(91)81059-H (  0) 0) |
| [8] |
VELASCO I, TENREIRO S, CALDERON I L, et al. , Saccharomyces cerevisiae Aqr1 is an internal-membrane transporter involved in excretion of amino acids[J]. Eukaryot Cell, 2004, 3(6): 1492-503. DOI:10.1128/ec.3.6.1492-1503.2004 (  0) 0) |
| [9] |
PACHECO A, TALAIA G, SÁPESSOA J, et al. Lactic acid production in Saccharomyces cerevisiae is modulated by expression of the monocarboxylate transporters Jen1 and Ady2[J]. FEMS Yeast Research, 2012, 12(3): 375-381. DOI:10.1111/j.1567-1364.2012.00790.x (  0) 0) |
| [10] |
AERTS A M, ZABROCKI P, GOVAERT G, et al. , Mitochondrial dysfunction leads to reduced chronological lifespan and increased apoptosis in yeast[J]. FEBS Letters, 2009, 583(1): 113-117. DOI:10.1016/j.febslet.2008.11.028 (  0) 0) |
| [11] |
BONAWITZ N D, RODEHEFFER M S, SHADEL G S. Defective mitochondrial gene expression results in reactive oxygen species-mediated inhibition of respiration and reduction of yeast life span[J]. Molecular & Cellular Biology, 2006, 26(13): 4818-29. DOI:10.1128/mcb.02360-05 (  0) 0) |
| [12] |
SMITH D L, MCCLURE J M, MATECIC M, et al. , Calorie restriction extends the chronological lifespan of Saccharomyces cerevisiae independently of the Sirtuins[J]. Aging Cell, 2007, 6(5): 649-662. DOI:10.1111/j.1474-9726.2007.00326.x (  0) 0) |
| [13] |
GOLDBERG A A, BOURQUE S D, KYRYAKOV P, et al. Effect of calorie restriction on the metabolic history of chronologically aging yeast l[J]. Experimental Gerontology, 2009, 44(9): 555-571. DOI:10.1016/j.exger.2009.06.001 (  0) 0) |
| [14] |
LOBANOVA E G, KONDRAT'EVA E V. Measurement of mitochondrial membrane potential in leukocyte suspension by fluorescent spectroscopy[J]. Bulletin of Experimental Biology & Medicine, 2014, 157(2): 288-290. DOI:10.1007/s10517-014-2547-4 (  0) 0) |
 2018, Vol. 16
2018, Vol. 16


