自1921年以来,胰岛素被发现以后,就成为了治疗糖尿病的主要手段。但目前糖尿病不能根治,患者只能终生依赖药物。传统的降血糖药物多为人工合成的化合物,如α-葡萄糖苷酶抑制剂(阿卡波糖,米格列醇,伏格列波糖)被认为是治疗糖尿病的一线治疗药物[1-2]。其他口服降血糖药包括胰岛素增敏剂,例如降低肝脏中葡萄糖产生的双胍类(如二甲双胍)[3-4]和增加肌肉对胰岛素敏感性的噻唑烷二酮类(例如格列酮类)[5]。胰岛素促分泌剂如磺酰脲类(如格列吡嗪和格列美脲)[6-7]和美格列奈类[8-9];葡萄糖依赖性促胰岛素多肽(例如胰高血糖素样肽-1)[10]和二肽基肽酶Ⅳ抑制剂(格列奈类)[11]等药物均可用于糖尿病的治疗。但是,在30%~40%的患者中,一方面由于口服降血糖药引起人体生物化学过程的改变,产生各种副作用,包括胃肠和肝脏疾病[12]。另一方面,由于长时间使用和重复给药导致治疗成本高。由于现有的治疗药物具有许多的局限性,迫切需要开发低成本、高效益且更安全有效的新型抗糖尿病药物[13]。肽类药物因其具有明显优点,为未来降糖药的研发提供了新方向和新思路。首先,肽类多是内源性肽或其他天然肽,结构清楚,作用机制明确;其次,它们与一般小分子药物相比,活性更高、用药剂量更小、毒副作用更低,而且代谢终产物为氨基酸;第三,它们与蛋白质相比,几乎没有免疫原性,而且可以化学合成,产品纯度高,质量可控;第四,肽往往能规避胃肠道消化,克服蛋白质分子被消化酶破坏从而不能口服的弊端。因此,本综述旨在汇总各种来源的降糖肽的最新文献,并分析其未来用于生产有效治疗糖尿病药物的潜力。
2 降糖肽的分类及制备方法降糖肽来源广泛,种类多样,国内外有大量关于降血糖多肽的报道。按来源分类,降血糖多肽可分为植物来源型、动物来源型、乳源生物以及激素类;按制备方法分类,可分为天然多肽和合成多肽,其中天然多肽又可分为内源性多肽和外源性多肽(即食源性多肽)。
2.1 天然肽目前,已经发现了7 000多种天然肽,它们通常在人体生理学中具有重要作用,包括激素,神经递质,生长因子,离子通道配体或抗感染药物[14],其中降血糖多肽占据相当大一部分。
在亚洲,非洲和南美古代,苦瓜(Momordica charantia,MC)已被用于糖尿病的治疗。许多研究结果表明,苦瓜具有良好的降血糖特性,尤其是用于Ⅱ型糖尿病的治疗。苦瓜中主要的降血糖活性成分是肽和生物碱,例如多肽-P、多肽-K和苦瓜甙。多肽-P首先从苦瓜种子中纯化出来,后来在一些水果和组织中被发现。1981年,研究发现多肽-P是一种分子量约为11 000 Da的蛋白质,含有166个氨基酸。已经进行的动物实验和临床试验证明多肽-P具有降血糖活性[15-16]。通过使用随机扩增多态性DNA(RAPD)和简单重复序列重复序列(ISSR)分子标记将从不同区域收集的19份苦瓜材料聚类为三组。采用免疫印迹(Western blot,WB)方法检测各种材料中多肽-P的含量。WB结果显示在6月和7月收获的MC种质中检测到多肽-P,其中深绿色果实(接近深绿色)具有低度的多肽-P,而白色或浅绿色的果实(接近白色绿色)具有高含量的多肽-P。但在9月和10月收集的八个种质未检测到多肽-P。该实验小组的研究结果表明,苦瓜的种质,收获时期或收获期天气对多肽-P的含量有影响[17]。多肽-p也显示在青少年和成熟发病的糖尿病患者中具有降血糖作用。之后从苦瓜的种子中分离出的多肽-k(PPK)也具有降低血糖水平的活性,其比多肽-p更有效并且有助于预防糖尿病。
据报道,普通豆类生物活性肽具有抗高血压,抗炎症,抗氧化和抗癌潜能。然而,很少有研究评估普通豆肽的抗糖尿病潜力。在Luis Mojica和Elvira Gonzalez de Mejia之前的一项调查中,对来自微生物和哺乳动物来源的几种蛋白水解酶的抗糖尿病能力进行了系统评估,使用风味酶,木瓜蛋白酶,碱性蛋白酶,嗜热菌蛋白酶,胰蛋白酶,胰凝乳蛋白酶,蛋白酶K或胃蛋白酶以三种比率(1:20, 1:30, 1:50 E/S)和三次水解(2,3,4小时),使用α-淀粉酶或α-葡糖苷酶的抑制百分数作为优化参数,考虑响应面分析输出,发现碱性蛋白酶是生产具有抗糖尿病潜力的黑豆蛋白组分最好的酶,并且黑豆蛋白通过阻断葡萄糖转运蛋白GLUT2和SGLT1表现出显着的降血糖作用。黑豆蛋白质组分可以作为生物活性化合物的廉价替代食物来源,用作糖尿病患者血糖水平的治疗成分,并且是天然成分,可能无副作用[18]。各种生物活性肽级分也已经从斑豆蛋白中分离出来。结果显示低分子量部分(即 < 3KDa)表现出显著的抗糖尿病和抗氧化活性。鉴定了六肽序列的抗氧化活性,七肽序列通过降低α-淀粉酶的活性来发挥抗糖尿病作用[19]。
燕麦产品的抗糖尿病作用及其可能的作用机制之前已有报道[20]。较高剂量的燕麦肽通过减少食物摄入量,刺激胰岛素分泌,增强胰岛素敏化作用而具有显着的降血糖活性[21]。有实验研究,通过向高糖动物模型饲喂燕麦多肽,证明燕麦多肽可有效改善糖尿病小鼠体重减轻、多食和多饮的症状。其通过提高胰岛素敏感性和促进肝糖原的合成,起到降低糖尿病小鼠血糖水平的作用。燕麦多肽的体内降血糖功能验证,为开发燕麦功能性食品和保健药品提供了理论基础。
2.2 合成肽Anis课题组报道了关于调节G蛋白偶联受体激酶(GRK 2/3:KRX-683107和KRX-683124)的新型短肽合成的研究。此外,这些肽在Ⅱ型糖尿病小鼠的不同模型中进行葡萄糖调节研究,并表现出抗糖尿病潜力[22]。
胰高血糖素样肽1(GLP-1)是体内重要的肠肽激素, 在调节体内葡萄糖稳态中起重要作用。它通过促进胰岛素分泌、抑制胰高血糖素产生以及减慢餐后胃排空降低血糖。2005年FDA批准皮下使用的艾塞那肽(Exendin-4)是GLP-1的长效类似物, 具有比GLP-1更持久的生物学活性和更强的降血糖作用, 是一种治疗Ⅱ型糖尿病的新型药物。Irwin等人(2015)合成了D-Ala(8)胰高血糖素样肽-1(GLP-1),一种与抗凝血酶Ⅲ(ATⅢ)结合的载体五糖缀合的肽[23]。实验证明该肽通过刺激胰岛素,改善糖化血红蛋白(HbA1c)和糖耐量而对糖尿病的控制效果显着。
2.3 制备方法天然肽一般从动植物中提取,以燕麦多肽的制备为例,将燕麦粉脱脂风干后,用碱法提取出蛋白质,再用不同的蛋白酶,如中性蛋白酶、碱性蛋白酶、木瓜蛋白酶、复合蛋白酶等酶进行水解,得到的多种多肽,再用如α-淀粉酶、葡萄糖苷酶、DPP-Ⅳ酶等酶类对其生物活性进行研究。其次还可以使用酶法提取多肽,酶法提取时蛋白质可以水解为短肽链,提高了蛋白质的消化率,能够更多地保留蛋白质的营养价值。膜分离纯化蛋白的过程不仅是一个筛分的过程,其分离纯化蛋白的程度还取决于分离过程中条件的控制和膜表面的物化性质。目前还有其他辅助技术,如超声技术,它能显著提高目的物质的提取率和提取速度,一方面,超声作用促使溶剂更大程度的渗入细胞中,从而加快物质传递;另一方面使细胞壁破裂,便于目的物质的释放[24]。
从目前的研究来看,酶法提取率高,反应条件温和,更适合将来的工业化生产;碱提酸沉法和酶法基本都能满足食品工业对蛋白纯度的要求,但为获得纯度较高的产品,还需结合膜分离、柱色谱纯化等技术;单一方法提取率较低,复合提取法能够结合不同方法的优点,最大限度地将蛋白提取出来,其中酶法提取与膜分离纯化相结合有比较好的发展前景。今后应该对新技术和新方法做进一步的研究:1)蛋白质的前处理技术,如超微粉碎、超临界流体萃取技术等;2)新型辅助技术,如超声波、微波、高压电场辅助提取等;3)新型干燥技术,如真空冷冻干燥、喷雾干燥等;4)新型提取技术,如物理提取方法、固定化酶提取技术、膜分离技术等。
合成肽一般通过自动肽合成仪来完成,人们可以利用生物体内分离、生物技术及化学合成等方法获得多种活性肽, 尤其是化学合成过程中能够方便改变多肽的一级结构、加入特殊氨基酸、对多肽末端进行修饰等。多肽合成总的来说分成两种:固相多肽合成和液相多肽合成。过去的多肽合成是在溶液中进行的称为液相合成法。从1963年Merrifield首次提出了固相多肽合成方法(SPPS)以来,经过不断的改进和完善,到今天固相法已成为多肽和蛋白质合成中的一个常用技术,表现出了经典液相合成法无法比拟的优点,从而大大的减轻了每步产品提纯的难度。
3 降糖肽的降糖机制苦瓜含有的几种生物活性化合物,具有非常好的降血糖潜力,其活化腺苷单磷酸激活的蛋白激酶(AMPK),其以调节能量代谢和使糖受体中受损的葡萄糖摄取而闻名[25]。其降血糖机制可能是抑制小肠黏膜α-葡萄糖苷酶活性,活性多肽分子主要对寡糖与酶之间的结合产生竞争性抑制(见图 1),通过氢键、极性和疏水性作用于酶,通过结合酶催化位点上的氨基酸来影响酶原有的活性,减少葡萄糖摄入;提高骨骼肌己糖激酶活性,加速葡萄糖磷酸化过程进而提高体内葡萄糖代谢和利用;保护或修复胰岛β细胞,促进胰岛素分泌。
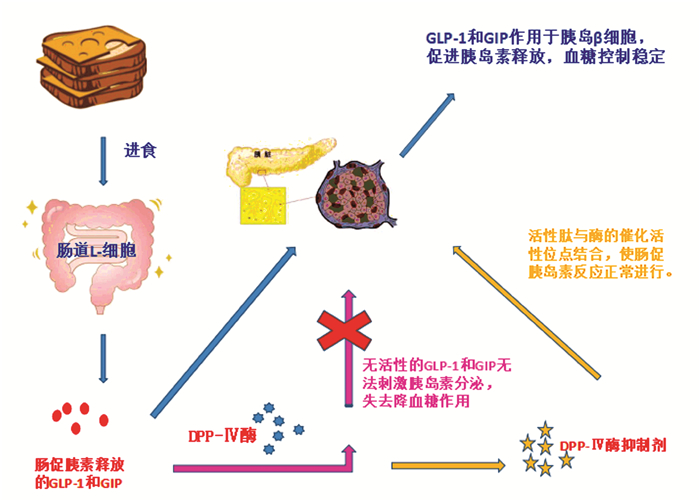
|
图 1 DPP-Ⅳ酶的作用机制 Figure 1 Action mechanism of the DPP-Ⅳ enzyme |
燕麦的多肽水解物具有DPP-Ⅳ抑制活性,其作用机制如图一所示,DPP-Ⅳ酶是一种丝氨酸氨基(外切)肽酶, 具有从多肽和蛋白质N末端去除X-Pro或X-Ala二肽的特异性, 作用于胰高血糖素样肽-1(GLP-1)和葡萄糖依赖性促胰岛素分泌多肽(GIP)使其无法刺激胰岛素分泌,从而失去降低血糖的作用。对于DPP-Ⅳ酶的抑制主要通过活性肽与其催化活性位点:ASP192,GLU192和ARG253结合,使酶的结构发生一定的改变,无法作用于GIP和GLP-1的二肽尾,提高内源性GLP-1和GIP的水平,促进胰岛β细胞释放胰岛素,同时抑制胰岛α细胞分泌胰高血糖素,从而提高胰岛素水平,降低血糖,是目前治疗糖尿病的主攻方向之一。
豇豆肽能降低正常和糖尿病小鼠血液中葡萄糖的含量,并表现出胰岛素样性质[26]。此外,这些肽具有与牛胰岛素相似的氨基酸序列[27]。进一步研究表明,豇豆肽导致Akt的磷酸化,Akt实际上是一种蛋白激酶B(PKB),它是丝氨酸或苏氨酸特异性蛋白激酶,负责细胞凋亡,葡萄糖代谢和细胞增殖等各种细胞过程。
据报道,牛奶和其他食物来源的生物活性肽可调节糖尿病的分子靶点,如抑制α-葡萄糖苷酶和DPP-Ⅳ酶,刺激胰岛素分泌,降低肠道葡萄糖的吸收和改善外周组织中的葡萄糖摄取(Patil,Mandal,& Tomar,2015)。表一例举了目前已经发现的部分降血糖多肽,包括其来源,以及作用机制。
| 表 1 多种降糖肽来源及其作用机制 Table 1 Sources of various hypoglycemic peptides and their action mechanisms |
在过去的十年中,多肽在医学和生物技术领域获得了广泛的应用,而且由于商业原因,治疗性多肽的研究目前也正在经历复兴。目前已有60多种肽类药物被FDA批准用于营销,而临床前试验中肽类药物的数量约为140种。在一些临床试验研究中,艾塞那肽BID与常用的抗糖尿病药物相比具有显着的重要性[36]。为了提高依西奈肽(Exendin-4)的治疗潜力,其螺旋度在产品名为E6的血清蛋白结合基序中得到了改善[38]。当透皮给药进行体内研究时,这显示出更令人印象深刻的药代动力学和药物动力学图谱。同样,艾塞那肽和磺酰脲之间进行比较研究。结果显示,与艾塞那肽相比,磺酰脲类在最大有效剂量下也未显示出显着的活性[39]。对733例患者进行了另一项类似的研究,其中评估了二甲双胍磺酰脲与艾塞那肽相比的组合。与二甲双胍-磺酰脲联合治疗相比,该研究支持了艾塞那肽的既往研究结果,并且降低了HbA1c和葡萄糖浓度,从而达到了显着的降血糖效果[40]。
5 结论最近几年,肽类作为降血糖药物已经引起广泛关注。多种肽类药物进入市场,数百种新型治疗肽处于临床前和临床开发阶段。这一成功的关键因素是多肽的有效且具体安全的作用模式。我们相信,多肽药物的未来发展将继续建立在天然多肽的优势基础之上,应用传统的合理设计来改善它们的缺点,如化学和物理性质。利用生物信息学结合分子生物学技术研究与抗糖尿病活性相关的肽的结构特征,将成为开发丰富天然蛋白中新肽的有力工具。此外,使用人体模型或临床试验进行研究的研究成果将来也是进一步应用的必要条件。来自于天然食品的降血糖多肽虽然有诸多优势,但仍存在一些问题。第一,将蛋白质水解成为多肽的过程比较容易,但并不是所有肽段都具有降糖的功能活性,分离提纯具有高的降糖活性的多肽片段较难;第二,多肽类物质经历体内消化等过程,不能够保证其功能活性不受到影响;第三,多肽类活性物质对于存贮的条件及环境要求较高,未经处理难于长期保存。基于这些问题,关于降血糖多肽作为药品或保健品治疗糖尿病的研究还需继续深入。
| [1] |
CHINIWALA N, JABBOUR S. Management of diabetes mellitus in the elderly[J]. Current Opinion in Endocrinology, Diabetes and Obesity, 2011, 18(2): 148-152. DOI:10.1097/MED.0b013e3283444ba0 (  0) 0) |
| [2] |
KAWAMORI R, TAJIMA N, WAMOTO Y, et al. Voglibose for prevention of type 2 diabetes mellitus: a randomised, double-blind trial in Japanese individuals with impaired glucose tolerance[J]. Lancet, 2009, 373(9675): 1607-1614. DOI:10.1016/S0140-6736(09)60222-1 (  0) 0) |
| [3] |
COLLIER C A, BRUCE C R, SMITH A C, et al. Metformin counters the insulin-induced suppression of fatty acid oxidation and stimulation of triacylglycerol storage in rodent skeletal muscle[J]. American Journal of Physiology Endocrinology and Metabolism, 2006, 291(1): 182-189. DOI:10.1152/ajpendo.00272.2005 (  0) 0) |
| [4] |
DEUK Y, KEUNGYU K, YONGSOO P, et al. Metformin inhibits hepatic gluconeogenesis through AMP-activated protein kinase-dependent regulation of the orphan nuclear receptor SHP[J]. Diabetes, 2008, 57(2): 306-314. DOI:10.2337/db07-0381 (  0) 0) |
| [5] |
YKIJARVINEN H. Thiazolidinediones[J]. New England Journal of Medicine, 2004, 351(11): 1106-1118. DOI:10.1056/NEJMra041001 (  0) 0) |
| [6] |
RONALD I, SHORR W, RAY J, et al. Individual sulfonylureas and serious hypoglycemia in older people[J]. Journal of the American Geriatrics Society, 1996, 44(7): 751-755. DOI:10.1111/j.1532-5415.1996.tb03729.x (  0) 0) |
| [7] |
STAA T, ABENHAIM L, MONETTE J. Rates of hypoglycemia in users of sulfonylureas[J]. Journal of Clinical Epidemiology, 1997, 50(6): 735-741. DOI:10.1016/S0895-4356(97)00024-3 (  0) 0) |
| [8] |
FUHLENDORFF J, RORSMAN P, KOFOD H, et al. Stimulation of insulin release by repaglinide and glibenclamide involves both common and distinct processes[J]. Diabetes, 1998, 47(3): 345-351. DOI:10.2337/diabetes.47.3.345 (  0) 0) |
| [9] |
BLICKLE J. Meglitinide analogues: a review of clinical data focused on recent trials[J]. Diabetes and Metabolism, 2006, 32(2): 113-120. DOI:10.1016/S1262-3636(07)70257-4 (  0) 0) |
| [10] |
TAHRANI A, BAILEY C, PRATO S, et al. Management of type 2 diabetes: new and future developments in treatment[J]. The Lancet, 2011, 378(9786): 182-197. DOI:10.1016/j.amjmed.2012.05.008 (  0) 0) |
| [11] |
PRATLEY R, SALSALI A. Inhibition of DPP-4: a new therapeutic approach for the treatment of type 2 diabetes[J]. Current Medical Research and Opinion, 2007, 23: 919-931. DOI:10.1185/030079906X162746 (  0) 0) |
| [12] |
SOMSAK L. Glucose derived inhibitors of glycogen phosphorylase[J]. Comptes Rendus Chimie, 2011, 14(2): 211-223. DOI:10.1016/j.crci.2010.09.004 (  0) 0) |
| [13] |
SHEN X L, LIU H, XIANG H, et al. Combining biochemical with 1 H NMR-based metabolomics approach unravels the antidiabetic activity of genipin and its possible mechanism[J]. Journal of Pharmaceutical and Biomedical Analysis, 2016, 129: 80-89. DOI:10.1016/j.jpba.2016.06.041 (  0) 0) |
| [14] |
FOSGERAU K, HOFFMANN T. Peptide therapeutics: current status and future directions[J]. Drug Discovery Today, 2015, 20(1): 122-128. DOI:10.1016/j.drudis.2014.10.003 (  0) 0) |
| [15] |
JAIN R, CHAWRAI S. Advancements in the anti-diabetes chemotherapeutics based on amino acids, peptides, and peptidomimetics[J]. Mini Reviews in Medicinal Chemistry, 2005, 5(5): 469-477. DOI:10.2174/1389557053765583 (  0) 0) |
| [16] |
SINGH J, CUMMING E, MANOHARAN G, et al. Medicinal chemistry of the anti-diabetic effects of Momordica charantia: active constituents and modes of actions[J]. Open Medicinal Chemistry Journal, 2011, 5(2): 70-77. DOI:10.2174/1874104501105010070 (  0) 0) |
| [17] |
TIAN M, ZENG X Q, SONG H L, et al. Molecular diversity and hypoglycemic polypeptide-P content of Momordica charantia in different accessions and different seasons[J]. Journal of the Science of Food and Agriculture, 2015, 95(6): 1328-1335. DOI:10.1002/jsfa.6826 (  0) 0) |
| [18] |
LUIS M, MEJIA ELVIRA G, ANGELES G, et al. Evaluation of the hypoglycemic potential of a black bean hydrolyzed protein isolate and its pure peptides using in silico, in vitro and in vivo approaches[J]. Journal of Functional Foods, 2017, 31: 274-286. DOI:10.1016/j.jff.2017.02.006 (  0) 0) |
| [19] |
JIN H, ZHANG Y J, JIANG J X, et al. Studies on the extraction of pumpkin components and their biological effects on blood glucose of diabetic mice[J]. Journal of Food & Drug Analysis, 2013, 21(2): 184-189. DOI:10.1016/j.jfda.2013.05.009 (  0) 0) |
| [20] |
SHEN R L, CAI F L, DONG J L, et al. Hypoglycemic effects and biochemical mechanisms of oat products on streptozotocin-induced diabetic mice[J]. Journal of Agricultural and Food Chemistry, 2011, 24(59): 8895-8900. DOI:10.1021/jf200678q (  0) 0) |
| [21] |
ZHANG H J, WANG J, LIU Y, et al. Peptides derived from oats improve insulin sensitivity and lower blood glucose in streptozotocin-induced diabetic mice[J]. Journal of Biomedical Sciences, 2015, 4: 1-7. DOI:10.4172/2254-609X.100007 (  0) 0) |
| [22] |
ANIS Y, LESHEM O, REUVENI H, et al. Antidiabetic effect of novel modulating peptides of G-protein-coupled kinase in experimental models of diabetes[J]. Diabetologia, 2004, 47(7): 1232-1244. DOI:10.1007/s00125-004-1444-1 (  0) 0) |
| [23] |
IRWIN N, IRWIN N, PATTERSON S, et al. Synthesis and evaluation of a series of long-acting glucagon-like peptide-1 (GLP-1) pentasaccharide conjugates for the treatment of type 2 diabetes[J]. Chemmedchem, 2015, 10(8): 1424-1434. DOI:10.1002/cmdc.201500140 (  0) 0) |
| [24] |
WANG L F, WANG Y J. Rice starch isolation by neutral protease and high-intensity ultrasound[J]. Journal of Henan Agricultural Sciences, 2004, 39(2): 291-296. DOI:10.1016/j.jcs.2003.11.002 (  0) 0) |
| [25] |
CHATURVEDI P. Antidiabetic potentials of Momordica charantia: multiple mechanisms behind the effects[J]. Journal of Medicinal Food, 2012, 15(2): 101-7. DOI:10.1089/jmf.2010.0258 (  0) 0) |
| [26] |
XAVIER-FILHO J, OLIVERIA AEA, SILVA L B D, et al. Plant insulin or glucokinin: a conflicting issue[J]. Brazilian Journal of Plant Physiology, 2003, 15(2): 67-78. DOI:10.1590/S1677-04202003000200002 (  0) 0) |
| [27] |
VENANCIO T, OLIVEIRA A, SILVA L, et al. A protein with amino acid sequence homology to bovine insulin is present in the legume Vigna unguiculata (cowpea)[J]. Brazilian Journal of Medical and Biological Research, 2003, 36(9): 1167-1173. DOI:10.1590/S0100-879X2003000900004 (  0) 0) |
| [28] |
JAN F, KUMAR S, JHA R. Effect of boiling on the antidiabetic property of enzyme treated sheep milk casein[J]. Veterinary World, 2016, 9(10): 1152-1156. DOI:10.14202/vetworld.2016.1152-1156 (  0) 0) |
| [29] |
JIANG N, ZHANG S J, ZHU J, et al. Hypoglycemic, hypolipidemic and antioxidant effects of peptides from red deer antlers in streptozotocin-induced diabetic mice[J]. Tohoku Journal of Experimental Medicine, 2015, 236(1): 71-9. DOI:10.1620/tjem.236.71 (  0) 0) |
| [30] |
ZAMBROWICZ A, ECKERT E, POKORA M, et al. Antioxidant and antidiabetic activities of peptides isolated from a hydrolysate of an egg-yolk protein by-product prepared with a proteinase from Asian pumpkin (Cucurbita ficifolia)[J]. RSC Advances, 2015, 5(5): 10460-10467. DOI:10.1039/C4RA12943A (  0) 0) |
| [31] |
YU Z P, YIN Y G, ZHAO W Z, et al. Anti-diabetic activity peptides from albumin against α-glucosidase and α-amylase[J]. Food Chemistry, 2012, 135(3): 2078-2085. DOI:10.1016/j.foodchem.2012.06.088 (  0) 0) |
| [32] |
NGOH Y Y, GAN C Y. Enzyme-assisted extraction and identification of anti-oxidative and α-amylase inhibitory peptides from Pinto beans (Phaseolus vulgariscv. Pinto)[J]. Food Chemistry, 2016, 190: 331-337. DOI:10.1016/j.foodchem.2015.05.120 (  0) 0) |
| [33] |
赵荣涛, 王宁丽, 魏鉴腾, 等. 牡蛎蛋白酶解多肽降糖及抗氧化活性评价[J]. 食品工业科技, 2018(3): 28-31. ZHAO Rongtao, WANG Ningli, WEI Jianteng, et al. Evaluation of hypoglycemic and antioxidant activity for peptides from oyster protein[J]. Science and Technology of Food Industry, 2018(3): 28-31. DOI:10.13386/j.issn1002-0306.2018.03.006 (  0) 0) |
| [34] |
OSEGUERA-TOLEDO M, MEJIA E G O, REYNOSO-CAMACHO R, et al. Proteins and bioactive peptides[J]. Nutrafoods, 2014, 13(4): 147-157. DOI:10.1007/s13749-014-0052-z (  0) 0) |
| [35] |
XIA E Q, ZHU S S, HE M J, et al. Marine peptides as potential agents for the management of type 2 diabetes mellitus—a prospect[J]. Marine Drugs, 2017, 15(4): 88. DOI:10.3390/md15040088 (  0) 0) |
| [36] |
REN Y, LIANG K, JIN Y Q, et al. Identification and characterization of two novel α-glucosidase inhibitory oligopeptides from hemp (Cannabis sativa L.) seed protein[J]. Journal of Functional Foods, 2016, 26: 439-450. DOI:10.1016/j.jff.2016.07.024 (  0) 0) |
| [37] |
GALLWITZ B, GUZMAN J, DOTTA F, et al. Exenatide twice daily versus glimepiride for prevention of glycaemic deterioration in patients with type 2 diabetes with metformin failure (EUREXA): an open-label, randomised controlled trial[J]. The Lancet, 2012, 379(9833): 2270-2278. DOI:10.1016/S0140-6736(12)60479-6 (  0) 0) |
| [38] |
YANG P Y, ZOU H, CHAO E, et al. Engineering a long-acting potent GLP-1 analog for microstructure-based transdermal delivery[J]. Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(15): 4140-4145. DOI:10.1073/pnas.1601653113 (  0) 0) |
| [39] |
BUSE J B, HENRY R R, HAN J, et al. Effects of exenatide (exendin-4) on glycemic control over 30 weeks in sulfonylurea-treated patients with type 2 diabetes[J]. Diabetes Care, 2004, 27(11): 2628-35. DOI:10.2337/diacare.27.11.2628 (  0) 0) |
| [40] |
KENDALL D M, RIDDLE M C, ROSENSTOC J, et al. Effects of exenatide (exendin-4) on glycemic control over 30 weeks in patients with type 2 diabetes treated with metformin and a sulfonylurea[J]. Diabetes Care, 2005, 28(5): 1083-1091. DOI:10.2337/diacare.28.5.1083 (  0) 0) |
 2018, Vol. 16
2018, Vol. 16


