2. 河南工程学院 资源环境学院,郑州 451191;
3. 西南大学 植物保护学院,重庆 400715
2. College of Resources and Environmental Sciences College, Henan University of Engineering, Zhengzhou 451191, China;
3. College of Plant Protection, Southwest University, Chongqing 400716, China
微生物种类复杂,较多是不可培养的,土壤微生物的生长繁殖需要物质、能量的输入,其能量来源主要为作物脱落的枝叶,根系残留物及分泌物,他们会随着季节的更替残留在土壤中[1],发生一系列生物物理化学变化,一部分降解成复杂的有机物成为土壤的难降解碳而固定,另一部分有机物会作为土壤微生物的能量来源与碳素来源,重新进入生物圈进行碳循环。
目前关于土壤根系微生物的碳代谢研究主要为解释土壤碳循环的途径及对不同影响因子的响应[1-2]。环境微生物方向主要研究在特定根系分泌物存在下,土壤不同区域微生物量,微生物种类的响应现象与机制(如采用高通量测序法表征微生物种群演替),根系微生物群落内部微生态的调控机理(如微生物群落内部),微生物与植物的生态依存关系等[3]。这些方面的深入研究将加深未来对农业作物各种植物病理、生理现象的理解,虽然目前这些研究信息还有些零散,缺乏系统性,但会逐步缩小对局部微生态预测,判断,调控的误差,使各种微生物生态调控更加精细,准确。
对微生物区系研究所选取的方法,目前有很多,主要分为对DNA遗传物质解析,RNA表达蛋白解析,代谢功能解析(如各种酶的活性)。通过提取总DNA,RNA,高通量测序后检索数据库得到微生物群落的遗传结构,定性与定量蛋白表达[4],成为一种广泛采用的方法。作为一种先进的方法,高通量测序具有很多优点,但在DNA提取与PCR扩增过程中由于会出现偏好性[5-6],在结果中会出现类似放大镜的扭曲效应,产生高估或低估某些种群数量的现象,对功能基因表达量也会产生误判。作为对微生物群落代谢功能解析的一种方法,碳代谢指纹图谱描绘微生物种群的碳源偏好性,是对微生物群落宏基因组碳代谢能力的一种评估[7-8],也是一种数学映射,并且在环境因子确定的条件下,这种映射是双射,即微生物群落的碳代谢指纹图谱是受微生物群落宏基因组决定的,这正是碳代谢指纹图谱对微生物群落遗传结构聚类分析的理论依据,而为了真实反映微生物群落的异同,足够的有意义的碳源选择将是微生物群落聚类分析准确性的关键因素,目前,在这方面的应用研究较少。同时,基因库(DNA),基因表达与环境行为中存在一种时滞效应,从而将基因表达与环境行为建立因果关系有一定难度,较难建立模型。碳代谢指纹图谱可以视为多元函数式的联立,在初值相同情况下,群落碳代谢能力相差较大,映射产生的向量差异较大,但群落碳代谢能力相似时,能映射出相似的向量,这时微生物群落可以种群结构差异较大,但却具有相似的碳代谢能力。
本文以实际大田烟株根系土壤微生物为研究对象,实验室条件下对其施以不同的碳源营养,研究群落生物量对碳源种类的响应,通过选取同一地点不同年份,相同生长时期的根系微生物样品,通过碳代谢指纹图谱研究不同年代根系微生物结构的演替现象,研究其深层次的生物、物理学原因。本文采用的15种碳源基于Biolog-Eco板中碳源种类设立,Biolog-Eco板采用了31种碳源,这31种化合物在土壤中分布较广泛,但Biolog-Eco板作为一种商业产品,在使用中并未标明各种碳源物质量,实验细节不明晰,在我们基于Biolog-Eco板机理,在实验室定量制作时发现,某些碳源常温下溶解度低或需要高(低)pH,或表面活性剂方可正常溶解,这必然引入外源物质,或由于物理化学条件苛刻不能代表土壤中微生物真实活性,为了对碳源物质的量进行标准化,不引入更多的外源物质,故将部分碳源舍去,实验中采用15种碳源。在前期的实验基础上,已在白果坪烟株茎部分离出三株病原菌,其表现为对L-丝氨酸,L-苏氨酸利用率较高,对其他13种碳源利用与水对照相比无显著差异。
1 材料与方法 1.1 实验土样和药品实验土样来自于中国重庆市彭水县润溪乡。取样位置分别为润溪乡白果坪烟草实验站区块,经度107°57′36″,纬度29°08′21″,海拔1 354 m。该试验田常年烟草青枯病、黑胫病高发,根据试验站记录,2011~2013年8月中旬青枯病三级以上(含三级)发病率均接近100%,另一取样地点为润溪乡樱桃井农户田,经度108°29′55.91″,纬度29°22′31.85″,海拔1 379 m,该田块常年种植烟草,但烟草青枯病、黑胫病未曾发生,采样时间如表 1,土样来源为根系土和垄间土。烟株种植方式,两个地点均为烟垄南北朝向,北高南低,起垄栽培,垄间距1 m,垄高30 cm,施肥与用药方式与当地烟农栽培方式一致,7月烟株发病较少,所取烟株根系土均为正常健康烟株,8月7日烟株发病明显,取青枯病发病三级根系土研究(烟株根部5~7个叶片出现青枯症状判读为青枯三级)。采样方式:采根系土时,拔取烟草植株,晃动直至除去根系外层黏附不紧的土壤,留下距离根系较近的土壤,适度抖动使土壤脱落,采样袋保存;对于垄间土,取表面无植物生长,垂直取表面以下15 cm左右的土壤,混匀。试验田土壤物理化学性质如表 2,土壤样品采样于2014年4月,采样地点为白果坪烟田,樱桃井烟田,采样方法为试验田块对角五点采样,取土壤表层0~20 cm圆柱形土壤样品,所取土壤样品混合均匀后测定理化性质。
| 表 1 取样时间位置表 Table 1 Sampling time and location table |
| 表 2 彭水烟田土壤理化性质测定 Table 2 The physical and chemical properties of tobacco field soils in Pengshui |
实验使用的15种碳源:i-赤藓糖醇(C4H10O4)、α-环式糊精(C36H60O30)、L-精氨酸(C6H14N4O2)、吐温40(C22H42O6)、乳糖(C12H22O11·H2O)、L-苹果酸(C4H6O5)、L-苏氨酸(C4H9NO3)、甘露醇(C6H14O6)、D-木糖(C5H10O5)、衣康酸(C5H6O4)、D-纤维二糖(C12H22O11)、葡萄糖(C6H12O6)、L-丝氨酸(C3H7NO3)、腐胺(C4H12N2)、L-苯丙氨酸(C9H11NO2)。15种碳源配置浓度是根据培养微生物所添加碳原子的摩尔数计算的,碳原子的摩尔浓度为0.667 mol/L。
Multiskan GO全波长酶标仪,FA2004N电子天平,GZH-280B型培养箱,恒温培养摇床,高压蒸汽灭菌锅,超净工作台,多孔移液器,分装板,96孔培养板等。
1.3 样品的测定称取2 g土壤样品原样(未处理)于已灭过菌的装有50 mL超纯水的锥形瓶中,并贴上相应土样的编号,置于摇床振荡30 min,取出静置10 min,吸取上清液2 mL于已灭菌的培养皿中,再向其中添加8 mL无菌超纯水稀释,1 min内分装入96孔微孔培养板,每孔每个处理三个重复。
将分装好的微孔板放入酶标仪,测定并保存590 nm的光吸收初值。微孔板放入恒温培养箱内培养温度设定为28 ℃,培养箱内空气含水量饱和,每12 h测一次光吸收值。
1.4 数据处理同一重复土样对不同碳源测得的OD590值分别取平均值,不同碳源培养的微生物量在7 d内的OD590值集中起来,以时间为横坐标,以OD590值为纵坐标,做出了14种土样对15种碳源因子吸收利用的生长曲线。聚类分析,主成分分析选用软件为SPSS 19.0,选择15种碳源72 h的OD590为变量,各变量值保存两位有效数字,变量无标准化,聚类方法为组间连接法,度量标准为Euclidean距离法,进行聚类分析。主成分分析采用相关性矩阵,抽取特征值大于1,最大收敛性迭代次数25,得出成分矩阵图。
2 结果与分析 2.1 样品生长曲线分析从图 1可以观察到,样品14-7BG,14-7BL,14-7YG主要碳源利用为L-苏氨酸,L-苯丙氨酸,腐胺,D-纤维二糖,吐温40。样品14-8BG,14-8BL,14-8YG主要碳源利用为吐温40,L-苏氨酸,腐胺,乳糖,L-苯丙氨酸。
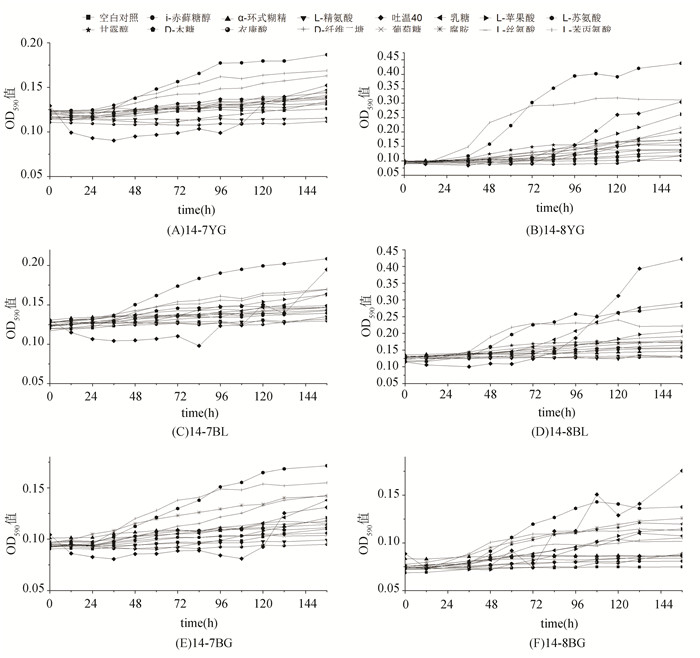
|
图 1 2014年各土壤样品不同碳源微生物生长曲线OD590值的变化 Figure 1 The changes of OD590 value of microbial growth curve in different soil samples in 2014 |
从图 2可以观察到,样品15-7BG,15-7BL,15-7YG,15-7YL主要碳源来源为吐温40,D-纤维二糖,L-苏氨酸,D-木糖,L-苯丙氨酸,腐胺。样品15-8BGD,15-8BL,15-8YG,15-8YL主要碳源来源为吐温40,D-纤维二糖,L-苹果酸。
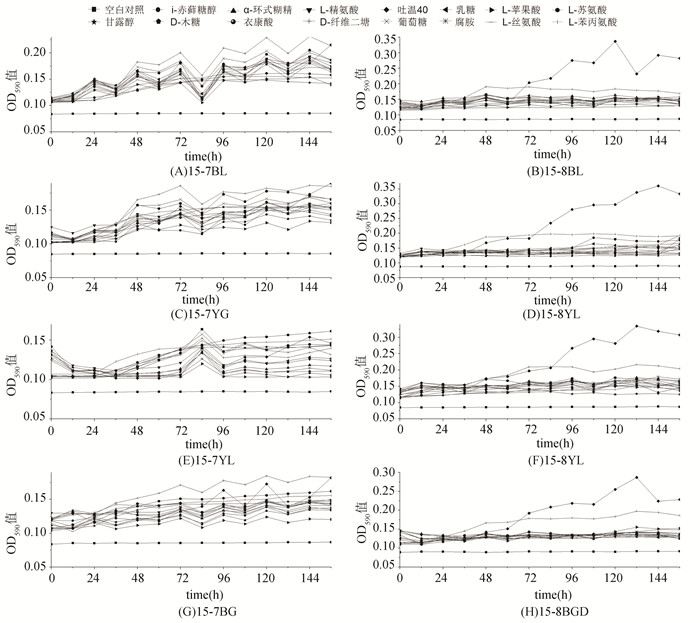
|
图 2 2015年各土壤样品不同碳源微生物生长曲线OD590值的变化 Figure 2 The changes of OD590 value of microbial growth curve in different soil samples in 2015 |
从所作的14个生长曲线得到,生长曲线的延迟期多集中在0~24 h,对不同的碳源培养基,24~72 h为指数生长期,72 ~144 h为稳定期,144 h后少量样品OD590值的快速下降,但大多数样品仍停留在稳定期。空白对照OD590值最低,随着培养时间增加无明显升高,从碳源利用情况来看,在所有样品中,吐温40均可以得到广泛利用,L-苏氨酸,D-纤维二糖,L-苯丙氨酸,腐胺四种碳源的利用情况比较较好。L-苹果酸,乳糖只在少数样品中得到明显利用,其生长曲线呈现出很明显的上升趋势。
2.2 样品生物群落碳源代谢相似性分析SPSS软件根据72 h碳源代谢特征图谱聚类分析得出五个最近聚类(见图 3),分别为:1)15-8BGD与15-8YG,2)15-7BG与15-7YG,3)15-7BL,15-8BL与15-8YL;4)14-7BL,14-7YG与15-7YL,5)14-7BG与14-8BG。14-8BL与14-8YG与其他土样聚类较远。青枯病常发生烟田根系土壤碳源代谢聚类分析并未聚到一类。烟草根系土较易聚在一类,垄间土较易聚在一类,2014,4015年相似样品未能聚在一类,表明不同年份间烟田微生物群落碳代谢能力差异较明显。
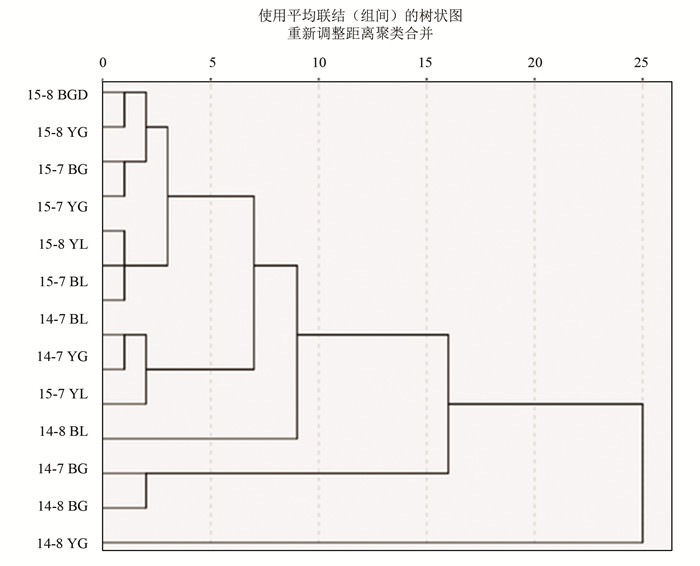
|
图 3 不同土壤样品微生物群落聚类分析图 Figure 3 Cluster analysis of microbial communities in different soil samples |
对15种碳源进行主成分分析:L-苏氨酸,L-苯丙氨酸与第二主成分成正相关,甘露醇主成分1与主成分二系数相当,其他碳源与第一主成分正相关。
| 表 3 成分得分系数矩阵 Table 3 Component score coefficient matrix |
在碳代谢测定过程中,培养周期7 d,培养板上盖反复打开后,空气微生物可能会对样品产生感染,培养过程的空白对照在培养过程中OD590均无明显上升,表明实验中受空气微生物污染可忽略,各培养板中的水对照也均无OD590的明显上升,表明样品来源的碳素营养较少,可忽略。相似的微生物群落指的是微生物的种类构成相似,各种类的丰富度相似,微生物在细胞周期的分布相似,具有相似的生理代谢功能,在不同物质混溶的稀溶液中,由于光的量子性,其光吸收是可加的,故微生物群落结构可以用连续光谱的光吸收来表征,本实验数据仅采用了OD590数值进行分析,进行聚类分析时选择未对数据进行标准化,即在聚类结果中考虑了生物量的原因,如果聚类分析中采用经过标准化的数据,则聚类分析时将不考虑生物量的因素,或加大生物种类及其丰富度的权重,同时标准化的方法又有很多,如单个样品不同指标的标准化,还是所有样品所有指标的共同标准化,均会带来不同的聚类结果。
实验中共采用了15种碳源来表征土壤微生物群落碳代谢指纹图谱,碳源可分为5类:1)氨基酸类:L-精氨酸,L-苏氨酸,L-丝氨酸,L-苯丙氨酸;2)单糖类:乳糖,D-木糖,葡萄糖,i-赤藓糖醇,甘露醇;3)羧酸类:L-苹果酸,衣康酸;4)多聚物类:α-环式糊精,吐温40,D-纤维二糖;5)胺类:腐胺。实验中选取的碳源与Biolog公司推出的BIOLOG-Eco培养板中碳源具有一定重复。目前研究已知,20种氨基酸可通过分解代谢形成5种产物进入柠檬酸循环,释放能量,或用于合成菌体物质,实验中选择的4种氨基酸代表了三种氨基酸代谢途径,其中L-苏氨酸,L-苯丙氨酸,在10个土壤样品中OD590较高,表现出较高的同化作用,L-丝氨酸,精氨酸未能形成强的同化作用。L-苏氨酸,L-丝氨酸分解后形成乙酰-CoA进入柠檬酸循环,L-苏氨酸较L-丝氨酸多一个甲基,分子量更大,被动扩散跨膜阻力较大,在实验中却表现出较高的同化能力;在细胞中L-苯丙氨酸碳骨架分解中先形成酪氨酸,可通过两种途径进行分解,一种是经乙酰乙酰-CoA形成乙酰-CoA,或进入延胡索酸途径,两种途径的产物最后均可进入柠檬酸循环;精氨酸是通过a-酮戊二酸途径进入柠檬酸循环,在实验中L-苯丙氨酸,精氨酸表现出的同化能力较低,影响氨基酸同化的原因非常复杂的,它包括氨基酸跨膜转运,降解,合成中涉及到的相关蛋白质的酶活[9],是群落基因组表达的一种宏观映射,实验结果表明相关蛋白可能缺失或功能活力较低。吐温40是聚氧乙烯山梨醇酐单棕榈酸酯,实验中添加吐温40的培养孔随着培养时间增加,OD590增加明显,环境中关于吐温40被同化的研究较少,机理尚不明晰,赵磊等分离出耐高吐温80浓度的假单胞菌,实验中吐温40的质量百分比为1.22%,张甲耀分离得到的假单胞菌对质量百分比为5.0%的吐温80仍具有较好的降解能[10],Biolog-Eco板中碳源种类同时包括吐温80,吐温40为聚氧乙烯山梨醇酐单棕榈酸酯,聚氧乙烯山梨醇酐单油酸酯,二者的脂肪酸组成不同,在实验中用来作为多聚物的代表。D-纤维二糖,在自然界不单独存在,水解后形成葡萄糖,其糖苷键为β糖苷键,部分土壤样品在添加D-纤维二糖的微孔中得到较高的光吸收,而在添加同摩尔葡萄糖碳原子的微孔中光吸收反而较小,需要通过进一步实验进行解释,大多数微生物均有葡萄糖偏好性,本实验中添加葡萄糖的微孔光吸收有增加,但相对其他碳源增加较少,Biolog-Eco板中添加的是1-磷酸葡萄糖,试验中关于葡萄糖的设置可再进行优化,在今后的试验中可同时添加1-磷酸葡萄糖与葡萄糖,进行对比试验。在采用Biolog-Eco板分析微生物群落的碳源偏好性,实验技术人员仅了解碳源种类,对于碳源浓度,培养基中其他物质种类均不了解,缺乏对其碳代谢深入分析的依据,本研究在培养基的成分方面具有准确的认知,在这个方向仍需要做更多工作。
不同时间点各个样品特定波长的光吸收均可测定得出,实验中我们共测定了六个波长的光吸收,本文分析采用的数据为590 nm的光吸收数据,这些数据构成了各个样品微生物群落增长的光吸收指纹图谱,单个微孔板中微生物群落的培养属于分批培养,经历适应期,指数期,稳定期,衰亡期,微孔板各微孔中适应期微生物组成较少,并未起到选择作用,由于指数期生长的微生物是对该碳源适应的微生物,起到了选择与信号放大作用,故采用指数期或稳定期微生物群落的光吸收指纹图谱,本实验中,大多数样品在72 h的时间均为指数期生长,故采用培养72 h的OD590数据进行聚类分析。2015年设立了4个对照样品15-7BL,15-7YL,15-8BL,15-8YL,均是烟田垄间土(无植物覆盖)作为对照,其中15-7BL,15-8BL,15-8YL聚为一类且聚类距离相同,而15-7YL聚类距离较远。2015年样品15-7BG,15-7YG聚为一类,15-8BGD,15-8YG聚为一类,以上两类又聚为一大类,这四个样品均为根系土,15-7BG,15-7YG是7月18采集的样品,15-8BGD,15-8YG是8月7日采集的样品,在这个聚类中,不同时间的样品首先聚类,相同时间不同地点的样品后聚类,这些样品均为同一年的烟草根系土壤,聚为一大类,在这个聚类分析中,青枯病原菌的存在并未对聚类结果产生决定作用,即含有青枯病病原菌的土壤并未聚类在一起。15-7BG,15-8BGD,14-7BG,14-8BGD由于其常年发生青枯病害,青枯病原菌在土壤中应较广泛存在[11],而15-7YG,15-8YG土壤在已知年限中从未发生青枯病害,则其土壤中不应含有青枯病原菌,即常发病烟田与不发病烟田应有较大可能具有较大的微生物结构差异[12],但代谢结构差异的数据在聚类分析中体现的结果并未反映出这种微生物群落结构的结构差异,15-7BG,15-8BGD,14-7BG,14-8BGD并未聚成一大类,表明培养板中的15种碳源对烟株根系的青枯菌无特殊选择性,需要进行其他碳源培养实验,从而把受青枯菌污染的土壤与未受青枯菌污染的土壤分类开,青枯菌作为一种广泛传播的病原菌种[13],可以广泛侵染茄科作物,造成青枯菌在植物茎部大量繁殖,其他微生物无此功能,原因应该是该菌种在侵染烟草植株后,在某些环境因子压力下能利用某类或某些类营养因子快速繁殖菌[14],本实验在培养板设计碳源及选择压力时未充分考虑这些要素,在将来的试验中,应收集更多的青枯菌生理代谢数据,进一步有针对性的设计碳源与选择压力[15],在聚类原理的思考中,OD590吸收值是由培养孔中培养物不同蛋白,多糖成分的光吸收共同贡献的[16],本实验的结果同时也表明重庆彭水白果坪常发病烟田与樱桃井未发病烟田土壤中微生物碳源代谢能力差别不显著,重庆彭水樱桃井烟田中某些微生物替代了白果坪常发病烟田土壤青枯菌的碳源代谢生态位,进而具有竞争抑制青枯菌繁殖的潜力。
| [1] |
王振宇, 吕金印, 李凤民, 等. 根际沉积及其在植物-土壤碳循环中的作用[J]. 应用生态学报, 2006, 17(10): 1963-1968. WANG Zhenyu, LV Jinyin, LI Fengmin, et al. A rhizodeposition and its role in carbon cycling in plant-soil system[J]. Chinese Journal of Applied Ecology, 2006, 17(10): 1963-1968. DOI:10.3321/j.issn:1001-9332.2006.10.036 (  0) 0) |
| [2] |
柯跃进, 胡学玉, 易卿, 等. 水稻秸秆生物炭对耕地土壤有机碳及其CO2释放的影响[J]. 环境科学, 2014, 35(1): 93-99. KE Yuejin, HU Xueyu, YI Qing, et al. Impacts of rice straw biochar on organic carbon and CO2 release in arable soil[J]. Environmental Science, 2014, 35(1): 93-99. DOI:10.13227/j.hjkx.2014.01.015 (  0) 0) |
| [3] |
潘根兴, 周萍, 李恋卿. 固碳土壤学的核心科学问题与研究进展[J]. 土壤学报, 2007, 44(2): 327-337. PAN Genxing, ZHOU Ping, LI Lianqing. Core issues and research progresses of soil science of C sequestration[J]. Acta Pedologica Sinica, 2007, 44(2): 327-337. DOI:10.3321/j.issn:0564-3929.2007.02.020 (  0) 0) |
| [4] |
MANTER D K, DELGADO J A, HOML D G, et al. Pyrosequencing reveals a highly diverse and cultivar-specific bacterial endophyte community in potato roots[J]. Microbial Ecology, 2010, 60(1): 157-166. DOI:10.1007/s00248-010-9658-x (  0) 0) |
| [5] |
GUO F, ZHANG T. Biases during DNA extraction of activated sludge samples revealed by high throughput sequencing[J]. Applied Microbiology and Biotechnology, 2013, 97(10): 4607-4616. DOI:10.1007/s00253-012-4244-4 (  0) 0) |
| [6] |
WATANAROJANAPORN N, LONGTONGLANG A, BOONKERD N, et al. Biases for detecting arbuscular mycorrhizal fungal mixture by terminal restriction fragment length polymorphism (T-RFLP)[J]. World Journal of Microbiology and Biotechnology, 2014, 30(1): 77-86. DOI:10.1007/s11274-013-1423-0 (  0) 0) |
| [7] |
BELVISO S, GIORDANO M, AMBROSOLI R, et al. Assessment of lactic acid bacteria sensitivity to terpenoids with the Biolog methodology[J]. Dairy Science and Technology, 2014, 94(2): 195-203. DOI:10.1007/s13594-013-0151-4.DOI:10.1007/s12010-014-1131-8 (  0) 0) |
| [8] |
GRYTA A, FRAC M, OSZUST K. The application of the Biolog-Eco plate approach in ecotoxicological evaluation of dairy sewage sludge[J]. Applied Biochemistry and Biotechnology, 2014, 174(4): 1434-1443. DOI:10.1007/s12010-014-1131-8 (  0) 0) |
| [9] |
KIM L, HAMDI A, STANCU A D, et al. Selective membrane transport of amino acids by functionalised calix arenes[J]. Journal of Inclusion Phenomena and Macrocyclic Chemistry, 2010, 66(1): 55-59. DOI:10.1007/s10847-009-9622-x (  0) 0) |
| [10] |
赵磊, 张甲耀, 许振文, 等. 吐温80降解菌的分离及其性能的初步研究[J]. 环境科学与技术, 2006, 29(1): 4-6. ZHAO Lei, ZHANG Jiayao, XU Zhenwen, et al. A bacterium degrading nonionic surfactant tween 80: screening and its biodegradation characteristics[J]. Environmental Science and Technology, 2006, 29(1): 4-6. DOI:10.3969/j.issn.1003-6504.2006.01.002 (  0) 0) |
| [11] |
CHEN Y J, LIN Y S, TSENG K J, et al. Vine cuttings as possible initial inoculum sources of Ralstonia solanacearum race 1 biovar 4 on vegetable sweet potato in fields[J]. European Journal of Plant Pathology, 2014, 140(1): 83-95. DOI:10.1007/s10658-014-0445-2 (  0) 0) |
| [12] |
LI J G, REN G D, JIA Z J, et al. Composition and activity of rhizosphere microbial communities associated with healthy and diseased greenhouse tomatoes[J]. Plant and Soil, 2014, 380(1-2): 337-347. DOI:10.1007/s11104-014-2097-6 (  0) 0) |
| [13] |
SINGH D, SINHA S, YADAV D K, et al. Detection of Ralstonia solanacearum from asymptomatic tomato plants, irrigation water, and soil through non-selective enrichment medium with hrp gene-based Bio-PCR[J]. Current Microbiology, 2014, 69(2): 127-134. DOI:10.1007/s00284-014-0566-z (  0) 0) |
| [14] |
DIGONNET C, MARTINEZ Y, DENANCé N, et al. Deciphering the route of Ralstonia solanacearum colonization in Arabidopsis thaliana roots during a compatible interaction: focus at the plant cell wall[J]. Planta, 2012, 236(5): 1419-1431. DOI:10.1007/s00425-012-1694-y (  0) 0) |
| [15] |
VARBANETS L D, VASILEV V N, BROVARSKAYA O S, et al. Characterization of lipopolysaccharides from Ralstonia solanacearum[J]. Microbiology, 2003, 72(1): 12-17. DOI:10.1023/A:1022261619561 (  0) 0) |
| [16] |
张世芝, 张明锦, 吴启勋. 基于信息理论的分光光度法用于药材秦艽的指纹识别[J]. 计算机与应用化学, 2008, 25(2): 151-154. ZHANG Shizhi, ZHANG Mingjin, WU Qixun. The spectrophtometry based on information theories applied to fingerprint recognition of Gentiana straminea Maxim[J]. Computers and Applied Chemistry, 2008, 25(2): 151-154. DOI:10.3969/j.issn.1001-4160.2008.02.007 (  0) 0) |
 2018, Vol. 16
2018, Vol. 16


