2. 长治医学院中心实验室,山西 长治 046000;
3. 长治医学院附属和济医院 医务科,山西 长治 046000
2. Central Laboratory of Changzhi Medical College, Changzhi 046000, China;
3. Medical Department, Heji Hospital Affiliated to Changzhi Medical College, Changzhi 046000, China
近年来,肝癌(Hepatocellular carcinoma, HCC)的致死率逐渐攀升,已成为中国第二大致死癌症[1]。由于目前缺乏特异且敏感的分子标志物,临床上治疗肝癌通常使用手术切除、化疗和放疗等手段,这些手段的复发或转移几率高,肝癌患者预后不佳,总体生存率低至25%~39 %[2]。因此,寻找有效的诊断及预后标志物有助于改善肝癌患者生存状况。临床病理学分析显示,RPS6KB1的表达水平与肝癌患者的肿瘤体积、组织病理学分类和血清AFP水平密切相关[3]。
核糖体蛋白S6激酶β1(Ribosomal protein S6 kinase β1, RPS6KB1),亦被称为PS6K或S6K。近期研究发现,RPS6KB1在卵巢癌、乳腺癌、非小细胞肺癌、前列腺癌和结直肠癌等固体肿瘤中常常过量表达,且与癌症患者预后差、生存状况不佳呈正相关[4-6]。RAS/MAPK和PI3K/AKT信号途径作为mTOR的主要上游调控网络,能够激活mTOR-RPS6KB1途径。p38MAPK能够通过mTOR-RPS6KB1-MDM2途径调控p53稳定性,推测RPS6KB1为致癌基因[7-8]。但RPS6KB1的致癌机制和诊断预后的价值尚未完全阐明,针对该分子的基因治疗手段也尚未见报道。
越来越多证据表明,在多种实体瘤中,RPS6KB1是一个有价值的诊断和预后标志物,也是一个潜在的基因治疗分子靶点。研究人员对30对肝癌组织和癌旁正常组织中RPS6KB1的表达情况进行分析,发现肝癌组织中该蛋白表达水平显著升高。在低分化和中分化组织中RPS6KB1过量表达,在高分化组织中其表达水平较低[3]。因此,RPS6KB1作为肝癌的一个潜在分子标志物和基因治疗靶点,它的生理功能及其参与的信号通路值得深入研究。本文使用生物信息学分析方法,研究RPS6KB1蛋白的理化性质和结构功能,可为进一步研究RPS6KB1的作用机制及其作为肝癌治疗潜在靶点提供思路。
1 材料与方法 1.1 RPS6KB1蛋白序列的获得使用美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)的蛋白质数据库(https://www.ncbi.nlm.nih.gov/),以“RPS6KB1+物种名”为关键词,搜索得到人RPS6KB1蛋白的氨基酸序列信息。在哺乳动物中,核糖体蛋白S6激酶家族(ribosomal protein S6K,S6 kinase)包括S6K1和S6K2,其中S6K1由RPS6KB1基因编码,S6K1又被称为S6Kα;S6K2由RPS6KB2基因编码,S6K2又被称为S6Kβ[9]。本文的分析对象是RPS6KB1异构体α(Accession number:NP_003152)。
1.2 系统进化树构建在NCBI中,进行BLASTp同源搜索,得到RPS6KB1在不同物种中的同源蛋白质序列。使用Clustal2.1软件进行同源蛋白间的多重序列比对。使用MEGA6软件,Neighbor-joining方法,设置Boot-strap分析重复数为1 000,构建系统进化树[10],并计算进化距离。
1.3 组织表达特异性和亚细胞定位预测使用NCBI的UniGene数据库中EST结果对RPS6KB1在正常组织和癌变组织中的表达情况进行分析。使用PSORTII(https://psort.hgc.jp/)进行RPS6KB1的亚细胞定位预测。
1.4 理化性质分析将RPS6KB1蛋白序列输入到ExPASy数据分析系统中,使用ProtParam(http://web.expasy.org/protparam/)工具,对RPS6KB1的分子式、分子量、等电点、酸碱性和稳定性等理化性质进行分析。使用Protscale工具(http://web.expasy.org/protscale/)对RPS6KB1的亲疏水性进行分析。使用SignalP 4.1(http://www.cbs.dtu.dk/services/SignalP/)分析RPS6KB1有无切割位点和信号肽,TMHMM 2.0工具(http://www.cbs.dtu.dk/services/TMHMM/)分析RPS6KB1有无跨膜区域。
1.5 二级结构和高级结构分析使用SOPMA工具(https://npsa-prabi.ibcp.fr/cgi-bin/secpred_sopma.pl)预测RPS6KB1的二级结构及各成分所占比例。使用NCBI的Conserved Domain数据库分析结构域。使用SWISS-MODEL建模服务器(https://swissmodel.expasy.org/)预测三维结构。
1.6 磷酸化位点分析使用PhosphoSitePlus工具(http://www.phosphosite.org/homeAction.action)对RPS6KB1的磷酸化位点进行分析。
1.7 相互作用蛋白预测使用STRING数据库(http://string-db.org/),设置为高置信度0.7,数量限制在10个以内,构建与RPS6KB1相互作用的蛋白网络。
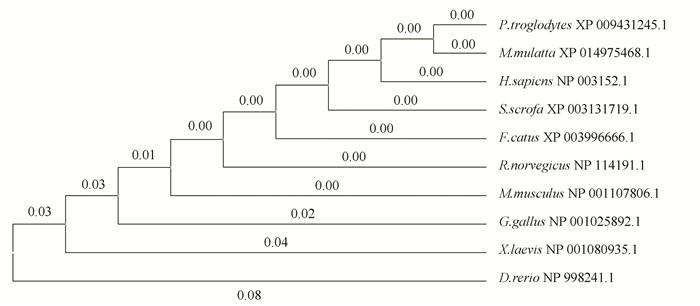
2 结果与分析 2.1 RPS6KB1蛋白多序列比对和进化关系分析在NCBI数据库中搜索到人RPS6KB1蛋白在哺乳动物、两栖类和鱼类中的同源序列。人RPS6KB1蛋白的氨基酸序列与猕猴、黑猩猩、野猪、猫、大鼠、小鼠、鸡、非洲爪蟾和斑马鱼的相似性分别为98.68 %、96.00 %、99.62 %、95.43 %、99.43 %、99.43 %、92.95 %、87.05 %和80.72 %。图 1中系统进化树分支上的数字代表进化距离。结果表明,人RPS6KB1蛋白与其他几种哺乳动物氨基酸序列相似性较大,组成一支,而与两栖类和鱼类的序列相似性较小。人与猕猴和野猪的同源性最高,与非洲爪蟾和斑马鱼的进化距离最远,分别为0.07和0.08。我们推测,RPS6KB1蛋白在进化过程中高度保守。
|
图 1 人RPS6KB1蛋白与其同源序列比对的系统进化树 Figure 1 Phylogenetic tree of human RPS6KB1 protein and its homologous sequence alignment |
由NCBI的UniGene数据库中EST结果可知,RPS6KB1在以下正常组织中均有表达,拷贝数分别是:乳腺178,淋巴结122,胃62,膀胱66,食管49,心脏44,肝34,肺32,肌肉65,神经64。由此推测,RPS6KB1在多数组织中均有表达,特异性不强。其中在乳腺中拷贝数最高。有研究者发现,尽管RPS6KB1在多数实体瘤中均有过量表达,其在乳腺癌中过表达水平最高[6]。PSORTII预测,RPS6KB1定位于细胞核的可能性最大(39.1 %),其次可能定位于线粒体(30.4 %)、细胞质(17.4 %)、过氧化酶体(8.7 %)和膜泡(4.3 %)。据此推测,RPS6KB1主要存在于细胞核中,而在其他亚细胞结构中也可能动态存在发挥生理功能。Lai等发现,RPS6KB1的激活与Mdm2发生细胞质滞留有密切关系。使用siRNA敲除RPS6KB 1或用雷帕霉素抑制RPS6KB1表达,能使Mdm2发生核易位,促进p53泛素化并降解。另一方面,RPS6KB1被激活后,能与Mdm2形成更紧密的复合体,抑制Mdm2入核发挥作用[11]。
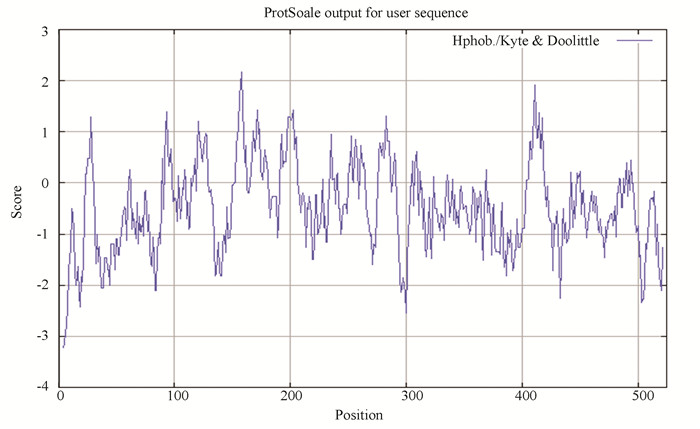
2.3 RPS6KB1蛋白质的理化性质人RPS6KB1基因位于17号染色体上(17q23.1),共有19个外显子,编码产物NP_003152为该基因的蛋白质共识编码序列。RPS6KB1蛋白含有525个氨基酸,分子式为C2632H4120N724O777S25,分子量为59 139.55 Da,理论等电点预测为6.21,分类为酸性蛋白质。在哺乳动物网织红细胞内半衰期为30 h,不稳定系数为51.00,分类为不稳定蛋白质。脂肪系数为73.39,总的平均亲水性为-0.491。ProtScale在线工具预测知,RPS6KB1亲水性最强的位点是第5位的精氨酸,分值为-3.222;疏水性最强的位点是第158位的亮氨酸,分值为2.178。由图 2可知,RPS6KB1蛋白的亲水区域多于疏水区域,分类为亲水蛋白质。
|
图 2 ProtScale分析RPS6KB1蛋白的亲疏水性 Figure 2 Hydrophobicity profile of the RPS6KB1 protein analyzed by ProtScale |
SignalP 4.0预测RPS6KB1蛋白不含切割位点,无信号肽序列(见图 3),说明该蛋白不是分泌蛋白。TMHMM 2.0预测RPS6KB1无跨膜结构域(见图 4),其中RPS6KB1蛋白位于膜外(outside)的概率几乎为100 %,跨膜区域(transmembrane)和位于膜内(inside)的概率几乎为0。紫色粗线用来标识多肽链中跨膜区域所在位置,因RPS6KB1蛋白没有跨膜区域,所以在粗线上不显示相应标记。

|
图 3 RPS6KB1蛋白的信号肽分析结果 Figure 3 The analysis result of RPS6KB1 signal peptide |

|
图 4 RPS6KB1蛋白跨膜结构分析 Figure 4 Trans-membrane domain analysis of RPS6KB1 |
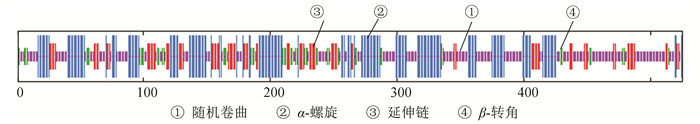
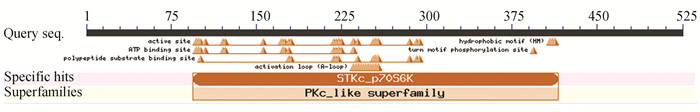
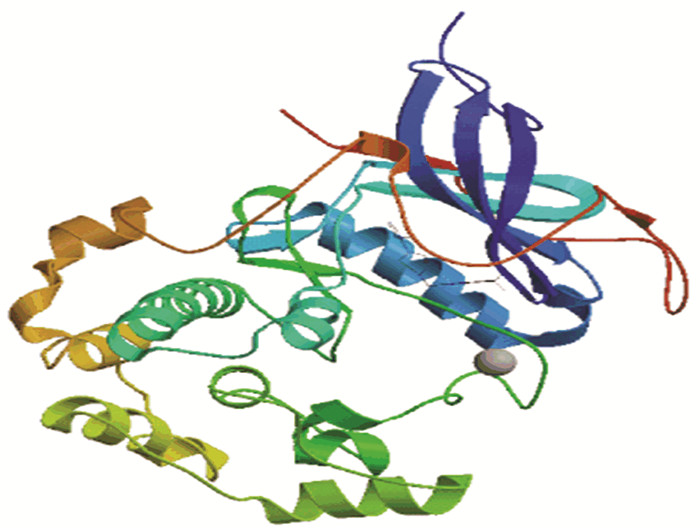
在RPS6KB1蛋白质的二级结构中,随机卷曲(图中①)占40 %,α-螺旋(图中②)占33.33 %,延伸链(图中③)占17.33 %,β-转角(图中④)占9.33 %(见图 5)。NCBI的Conserved Domain数据库预测RPS6KB1蛋白属于PKc_like超家族,含有一个STKc结构域,该结构域能够催化磷酸基团从ATP转移到蛋白底物的丝氨酸/苏氨酸残基上,从而使蛋白底物磷酸化(见图 6)。使用SWISS-MODEL建模服务器预测RPS6KB1蛋白三维结构(见图 7),GMQE为0.67,QMEAN为-1.81,序列相似度为61 %,覆盖率为65 %,该模型结构合理。
|
图 5 SOPMA预测RPS6KB1蛋白二级结构 Figure 5 Predicted secondary structure of RPS6KB1 protein by SOPMA |
|
图 6 RPS6KB1蛋白保守结构域 Figure 6 Conserved domain of RPS6KB1 protein |
|
图 7 RPS6KB1三维结构预测 Figure 7 Three dimensional structure prediction of RPS6KB1 |
使用PhosphoSitePlus分析RPS6KB1翻译后修饰情况,发现赖氨酸会发生乙酰化和泛素化修饰,精氨酸会发生甲基化修饰,丝氨酸、苏氨酸和酪氨酸会发生磷酸化修饰。有文献报道,RPS6KB1的C末端Lys516能够发生乙酰化,且乙酰化修饰有利于增强蛋白稳定性。RPS6KB1至少有八个磷酸化位点,包括催化结构域中的Thr229,连接区域的Ser371,Thr389和Ser404,以及自抑制结构域中的Ser411,Ser418,Thr421和Ser424[12]。目前认为RPS6KB1的激活首先由mTORC1磷酸化Thr421/Ser424位点和T389位点,接着PDK1使Thr229位点磷酸化[12]。进一步研究磷酸化程度及动态变化情况,有利于加深对RPS6KB1蛋白功能的理解。
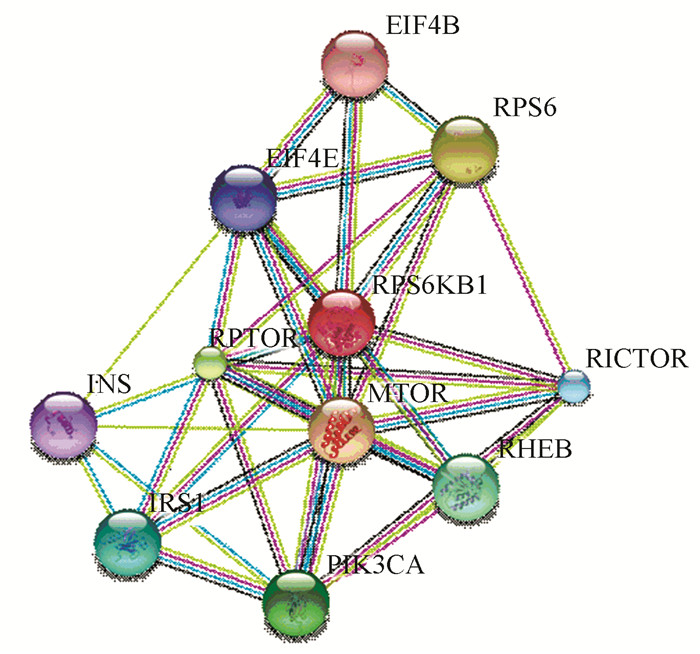
2.5 RPS6KB1蛋白质相互作用分析使用STRING数据库搜索与RPS6KB1相互作用的蛋白质信息,构建RPS6KB1蛋白相互作用网络(见图 8)。与RPS6KB1相互作用的蛋白质主要包括mTOR(mechanistic target of rapamycin)信号途径相关蛋白:mTOR、RPTOR(Regulatory associated protein of mTOR, complex 1)、RICTOR(RPTOR independent companion of mTOR, complex 2)、RHEB(Ras homolog enriched in brain);PI3K信号途径相关蛋白:PIK3CA(Phosphatidylinositol-4, 5-bisphosphate 3-kinase, catalytic subunit alpha);蛋白质合成相关蛋白:RPS6(Ribosomal protein S6)、EIF4E(Eukaryotic translation initiation factor 4E)、EIF4B(Eukaryotic translation initiation factor 4B)以及调控胰岛素水平相关蛋白:INS(Insulin)、IRS1(Insulin receptor substrate 1)。值得关注的是,RPS6KB1与mTOR信号途径多种蛋白存在相互作用。
|
图 8 STRING预测RPS6KB1蛋白相互作用网络 Figure 8 Protein-protein interaction network for RPS6KB1 predicted by STRING |
根据STRING预测结果,推测RPS6KB1是mTOR信号途径的关键效应物,也是mTOR的主要底物。在许多癌细胞中,PI3K/AKT/mTOR信号途径紊乱,促进细胞生长、增殖和存活。mTOR是一种丝氨酸/苏氨酸激酶,能够磷酸化RPS6KB1将其激活,活化的RPS6KB1进一步磷酸化RPS6、EIF4E和EIF4B,调控翻译起始复合体活化及转录翻译过程[13]。mTOR作为一种保守的蛋白激酶,是调控细胞生长和增殖的关键分子,能够直接或间接调控细胞周期相关蛋白和代谢相关蛋白磷酸化,也能够通过磷酸化转录因子(如:RPS6KB1)调控癌变过程中相关基因的表达[9]。因此,评估mTOR下游效应物及其在肝癌发生发展中的作用,探索mTOR信号途径中基因突变的临床相关性,开发针对mTOR的抑制剂值得进一步关注。研究发现,干扰RPS6KB1表达并不影响小鼠的存活和繁殖,但对小鼠生长,尤其在胚胎发育阶段有显著影响。在胚胎发育阶段,敲除RPS6KB1发现小鼠体内单个细胞体积变小,其整体的身体尺寸也变小[14]。然而,用Rapamycin(mTOR抑制剂)处理小鼠却能够延长其寿命,表明mTOR-RPS6KB1在促进衰老方面也发挥作用[15]。因此,mTOR-RPS6KB1途径如何调控两个看似相反的生命过程(增殖和衰老),值得进一步探索。
根据STRING预测结果,RPS6KB1与调控胰岛素水平相关蛋白也存在相互作用。RPS6KB1能够磷酸化IRS-1,使其失活或降解,从而扰乱RPS6KB1缺陷小鼠体内的糖代谢过程[16]。通过调控癌细胞粘附、存活和侵袭转移关键蛋白(如:细胞周期蛋白D1、PDCD4、FAK、E-钙粘蛋白、β-连环蛋白和组织转谷氨酰胺酶2),RPS6KB1在癌细胞转移过程中发挥作用[17]。通过调控缺氧诱导因子1α和血管内皮生长因子的表达,RPS6KB1在肿瘤生长和血管新生过程中发挥作用[18]。由此可知,RPS6KB1通过调控胰岛素敏感性、代谢、细胞周期和蛋白质合成,在细胞生长和增殖方面扮演重要角色。此外,RPS6KB1表达异常会增加罹患癌症、Ⅱ型糖尿病、超重和衰老的可能性[19]。
RPS6KB1作为肝癌潜在的分子标志物和治疗靶点,本文通过生物信息学方法,构建RPS6KB1的系统进化树,分析RPS6KB1蛋白的组织特异性、亚细胞定位、理化性质、高级结构及相互作用蛋白质,为全面认识RPS6KB1,研究其功能及mTOR信号途径在肝癌发生发展中的作用提供一定的基础,为进一步开发针对RPS6KB1的靶向药物和基因治疗方法提供思路。
4 结论1) RPS6KB1的理论分子量为59 139.55 Da,理论等电点为6.21,分类为酸性蛋白质。不稳定系数为51.00,总平均亲水性为-0.491,预测为亲水蛋白质;
2) RPS6KB1的二级结构主要为随机卷曲,属于PKc_like超家族,含有一个STKc结构域。无信号肽和跨膜区域。存在磷酸化、乙酰化和泛素化位点;
3) RPS6KB1表达的组织特异性不强,定位于细胞核的可能性最大;
4) 系统进化树显示,人RPS6KB1蛋白与哺乳动物氨基酸序列相似性较大,组成一支,而与两栖类和鱼类的序列相似性较小。推测该蛋白在进化过程中高度保守;
5) 与RPS6KB1相互作用的蛋白主要是mTOR信号途径相关蛋白,PI3K信号途径相关蛋白,蛋白质合成相关蛋白以及调控胰岛素水平相关蛋白。
| [1] |
TORRE L A, BRAY F, SIEGEL R L, et al. Global cancer statistics, 2012[J]. Ca A Cancer Journal for Clinicians, 2015, 65(2): 87-108. DOI:10.3322/caac.21262 (  0) 0) |
| [2] |
KISHI Y, HASEGAWA K, SUGAWARA Y, et al. Hepatocellular carcinoma: current management and future development-improved outcomes with surgical resection[J]. International Journal of Hepatol, 2011, 2011: 728103. DOI:10.4061/2011/728103 (  0) 0) |
| [3] |
LI P D, ZHANG W J, ZHANG M Y, et al. Overexpression of RPS6KB1 predicts worse prognosis in primary HCC patients[J]. Medical Oncology, 2012, 29(5): 3070-3076. DOI:10.1007/s12032-012-0268-y (  0) 0) |
| [4] |
ZHANG Y, NI H J, CHENG D Y. Prognostic value of phosphorylated mTOR/RPS6KB1 in non-small cell lung cancer[J]. Asian Pacific Journal Cancer Prevention, 2013, 14(6): 3725-3728. DOI:10.7314/APJCP.2013.14.6.3725 (  0) 0) |
| [5] |
SLATTERY M L, LUNDGREEN A, HERRICK J S, et al. Genetic variation in RPS6KA1, RPS6KA2, RPS6KB1, RPS6KB2, and PDK1 and risk of colon or rectal cancer[J]. Mutation Research, 2011, 706(1-2): 13-20. DOI:10.1016/j.mrfmmm.2010.10.005 (  0) 0) |
| [6] |
YAMNIK R L, DIGILOVA A, DAVIS D C, et al. S6 kinase 1 regulates estrogen receptor alpha in control of breast cancer cell proliferation[J]. Journal of Biological Chemistry, 2009, 284(10): 6361-6369. DOI:10.1074/jbc.M807532200 (  0) 0) |
| [7] |
SHAW R J, CANTLEY L C. Ras, PI(3)K and mTOR signalling controls tumour cell growth[J]. Nature, 2006, 441(7092): 424-430. DOI:10.1038/nature04869 (  0) 0) |
| [8] |
ZONCU R, EFEYAN A, SABATINI D M. mTOR: from growth signal integration to cancer, diabetes and ageing[J]. Nature Reviews Molecular Cell Biology, 2011, 12(1): 21-35. DOI:10.1038/nrm3025 (  0) 0) |
| [9] |
MAGNUSON B, EKIM B, FINGAR D C. Regulation and function of ribosomal protein S6 kinase (S6K) within mTOR signaling networks[J]. Biochemical Journal, 2012, 441(1): 1-21. DOI:10.1042/BJ20110892 (  0) 0) |
| [10] |
TAMURA K, DUDLEY J, NEI M, et al. MEGA4: molecular evolutionary genetics analysis(MEGA) software version 4.0[J]. Molecular Biology and Evolution, 2007, 24(8): 1596-1599. DOI:10.1093/molbev/msm092 (  0) 0) |
| [11] |
LAI K P, LEONG W F, CHAU J F, et al. S6K1 is a multifaceted regulator of Mdm2 that connects nutrient status and DNA damage response[J]. EMBO Journal, 2010, 29(17): 2994-3006. DOI:10.1038/emboj.2010.166 (  0) 0) |
| [12] |
BAHRAMI-B F, ATAIE-KACHOIE P, POURGHOLAMI M H, et al. p70 Ribosomal protein S6 kinase(Rps6kb1): an update[J]. Journal of Clinical Pathology, 2014, 67(12): 1019-1025. DOI:10.1136/jclinpath-2014-202560 (  0) 0) |
| [13] |
LAPLANTE M, SABATINI D M. mTOR signaling in growth control and disease[J]. Cell, 2012, 149(2): 274-293. DOI:10.1016/j.cell.2012.03.017 (  0) 0) |
| [14] |
SHIMA H, PENDE M, CHEN Y, et al. Disruption of the p70(s6k)/p85(s6k) gene reveals a small mouse phenotype and a new functional S6 kinase[J]. EMBO Journal, 1998, 17(22): 6649-6659. DOI:10.1093/emboj/17.22.6649 (  0) 0) |
| [15] |
SELMAN C, TULLET J M, WIESER D, et al. Ribosomal protein S6 kinase 1 signaling regulates mammalian life span[J]. Science, 2009, 326(5949): 140-144. DOI:10.1126/science.1177221 (  0) 0) |
| [16] |
AGUILAR V, ALLIOUACHENE S, SOTIROPOULOS A, et al. S6 kinase deletion suppresses muscle growth adaptations to nutrient availability by activating AMP kinase[J]. Cell Metabolism, 2007, 5(6): 476-487. DOI:10.1016/j.cmet.2007.05.006 (  0) 0) |
| [17] |
AKAR U, OZPOLAT B, MEHTA K, et al. Targeting p70S6K prevented lung metastasis in a breast cancer xenograft model[J]. Molecular Cancer Therapeutics, 2010, 9(5): 1180-1187. DOI:10.1158/1535-7163.MCT-09-1025 (  0) 0) |
| [18] |
BIAN C X, SHI Z, MENG Q, et al. P70S6K 1 regulation of angiogenesis through VEGF and HIF-1alpha expression[J]. Biochemical Biophysical Research Communications, 2010, 398(3): 395-399. DOI:10.1016/j.bbrc.2010.06.080 (  0) 0) |
| [19] |
ESPEILLAC C, MITCHELL C, CELTON-MORIZUR S, et al. S6 kinase 1 is required for rapamycin-sensitive liver proliferation after mouse hepatectomy[J]. Journal of Clinical Investigation, 2011, 121(7): 2821-2832. DOI:10.1172/JCI44203 (  0) 0) |
 2018, Vol. 16
2018, Vol. 16

