氧化应激是由细胞过度产生的活性氧(Reactive oxygen species,ROS)和亲电体引起的,而过量的ROS又可以诱导自由基链反应,破坏细胞生物大分子如蛋白质、脂质和DNA等,并诱发一系列生活习惯性疾病,如心脑血管疾病、老化、Ⅱ型糖尿病、癌症等[1-3]。机体为控制ROS水平并防止其积累,形成了一套复杂的抗氧化防御体系,其中核因子NF-E2相关因子(Nuclear factor-erythroid 2-related factor 2,Nrf2)是一种重要的氧化还原敏感性转录因子,其通过诱导调控细胞内Ⅱ相解毒酶和抗氧化酶的组成型和诱导型表达,有利于改善机体氧化应激状态,促进细胞存活以及维持细胞的氧化还原稳态。本文主要是对Nrf2抗氧化的功能及其分子调控机制进行综述。
1 Nrf2的结构及激活Nrf2蛋白在机体的多种组织(如肝、肾、脾、心等)的细胞内均有表达,且该蛋白分子包含Neh1~Neh7的7个结构域。其中,Neh1具有DNA结合基序。Neh3、Neh4和Neh5能够结合共激活因子,是Nrf2的反式激活结构域。Neh2、Neh6和Neh7均能调节Nrf2的稳定性,其中又以Neh2为主,其含有2个可以结合胞浆蛋白Kelch样环氧氯丙烷相关蛋白-1(Kelch-like ECH-associated protein-1,Keap1)的位点,命名为ETGE和DLG,从而负调控Nrf2转录活性[4]。
在正常生理情况下,Nrf2被Keap1锚定在细胞质中,而Keap1作为滞蛋白3(Cullin 3,Cul3)依赖性E3泛素连接酶复合物的作用底物,能够促使Nrf2发生泛素化且被蛋白酶体快速降解。但当细胞受到ROS或亲电体的攻击时,Nrf2从Keap1中解离且快速转位进入细胞核,先与小Maf蛋白形成异二聚体,再结合抗氧化反应元件(Antioxidant response element,ARE),转录激活受Nrf2调控的抗氧化酶基因表达[5-6]。
2 Nrf2抗氧化功能Nrf2调控Ⅱ相解毒酶和抗氧化酶基因的协调和全面表达,同时,Nrf2抗氧化性能也是保护组织免受由急性肺损伤、高氧和紫外(UV)光引起的氧化损伤所需要的。
Nrf2(-/-)小鼠模型为研究Nrf2对体内细胞保护基因表达的影响提供了有价值的手段。尽管Nrf2(-/-)小鼠本身不显示显著的表型,但这些动物对氧化应激条件敏感性增强。Nrf2(-/-)小鼠细胞内保护型基因的组成型和诱导型表达减少,但星形胶质细胞和神经元对氧化应激的敏感性增强。给小鼠注入线粒体复合物Ⅱ抑制剂可引起脑损伤,这种情况下,如果进一步破坏Nrf2表达则会加剧病变,而若移植Nrf2过表达的星形胶质细胞则会减小病变[7]。因此,这些研究证实了Nrf2是防御ROS的基础,且暗示了脑、肺、神经和其它慢性疾病的发病机制之一可能与Nrf2缺乏有关。
另外,通过联合使用实时电子顺磁共振成像和自旋探针动力学分析两种方法测量野生型和Nrf2(-/-)小鼠的氧化还原状态,揭示证实了Nrf2用于降低体内ROS水平。Nrf2(-/-)小鼠会形成更高水平的DNA加合物,并且在暴露于致癌物质后(如N-亚硝基化合物,黄曲霉毒素B1和苯并[a]芘等),引起癌症发病率升高。在Nrf2缺陷型小鼠中,癌症化学预防药物如吡噻硫酮和萝卜硫素丧失作用,表明Nrf2在癌症化学预防中起关键作用[8]。
3 Nrf2抗氧化的分子调控机制Nrf2要想发挥抗氧化性能,首先需要被激活,Nrf2在被诱导活化过程中受到一些相关的调控因子影响,随后,被激活的Nrf2诱导调控下游一系列的抗氧化因子表达。因此,在Nrf2抗氧化的调控因子范畴中,既包含前提激活相关的调控因子,又包含调节的下游抗氧化因子或抗氧化系统(如图 1),这里介绍其中比较典型重要的几种因子和抗氧化系统的作用及机制。
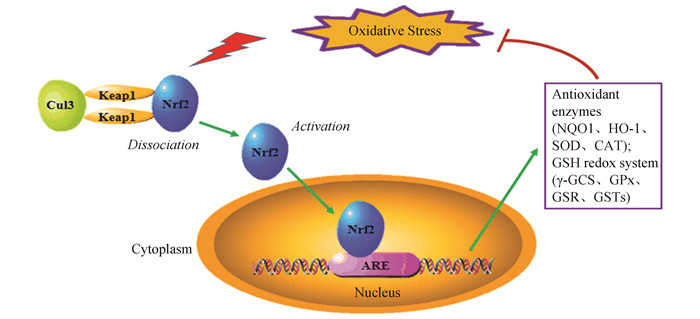
|
图 1 Nrf2抗氧化的分子调控通路 Figure 1 The molecular regulation pathways of Nrf2 antioxidant |
Nrf2与Keap1的联系性是通过其N末端Neh2结构域实现的,Neh2与Keap1相互作用,负调控Nrf2功能。Keap1具有2个特征域,即Broad Complex-Tramtrack-Bric'a'brac(BTB)的二聚化结构域和双甘氨酸重复(Double glycine repeat,DGR)结构域。此外,Keap1上还有三个结构域:N末端结构域(N-terminal region,NTR),干预区域(Intervening region,IVR),以及C-末端结构域(C-terminal region,CTR)。Keap1利用其DGR域与Nrf2的Neh2域结合。而Nrf2和Keap1之间的相互作用是通过以下经典的遗传实验得到证实的:实验采用Keap1(-/-)小鼠模型,发现其由于食道和胃肠道过度角化而在出生后3周内死亡,但是通过同时敲除Nrf2,可以将小鼠从致死性中拯救出来[9]。随后,采用小干扰RNA(siRNA)技术敲除人类细胞中Keap1的方法,证实了受ARE驱动的基因的上调[10]。实验结果均有力证实了Keap1是Nrf2的主要负调节器。
对于Nrf2与Keap1的结合及Nrf2-Keap1复合物对刺激物的反应,近来的研究还提出了一个“铰链与门闩(Hinge and latch)”的相互作用理论。研究发现,Nrf2的Neh2结构域含有2个Keap1结合位点:DLG基序和ETGE基序,能够形成一分子Nrf2和两分子Keap1的复合物。且这两个位点具有不同的结合亲和力:DLG基序对Keap1的亲和力比ETGE弱得多,这导致了DLG-Keap1的假设“门闩”式结合,其很容易被Keap1构象变化所扰乱。在正常情况下,Keap1与DLG结合并导致随后的Nrf2被泛素化及蛋白酶体降解;而在氧化应激状态下,Keap1失去与DLG的结合,可以阻止Nrf2发生泛素化及被蛋白酶体快速降解,新合成的Nrf2得以转移并聚集到细胞核内[11]。
Keap1是富含半胱氨酸的蛋白质,最初推测其巯基残基的修饰导致蛋白质构象变化。事实上,氧化应激和许多外源性化学物刺激的条件可能改变Keap1的半胱氨酸残基的还原状态并使Nrf2易位。研究证明,Keap1上Cys151、Cys273和Cys288对Keap1功能发挥起至关重要的作用。其中,位于IVR域的Cys273和Cys288对Keap1的抑制活性至关重要,当Cys273和Cys288发生氧化或共价修饰时,可以使依赖于Keap1的泛素化降低且使Nrf2的稳定性增强。而位于BTB域的Cys151被氧化或共价修饰时,可使Nrf2的抑制和泛素化减少,诱导Nrf2从Keap1中释放出来[8]。总之,这些结果表明Keap1是通过其关键位点的半胱氨酸残基还原状态的动态变化来响应氧化和环境胁迫的传感蛋白。
3.1.2 Cul3Cul3作为支架蛋白参与构成E3泛素连接酶复合物。对于Cul3和Nrf2之间的功能关系,一方面,通过采用显性抑制等位基因的过表达或Cul3特异性短发夹RNA的表达的方式来抑制Cul3,实验结果,通过脉冲追踪分析评估得到稳态Nrf2水平上升,Nrf2周转减少,另外通过Nrf2依赖性基因表达的分析评估得到Nrf2蓄积增加,Nrf2活性增强;另一方面,Cul3的过度表达会促使Nrf2发生多聚泛素化,从而降低Nrf2的蛋白水平,而Cul3的敲除(或显性抑制性Cul3表达)减少了Nrf2多聚泛素化[8]。
Cul3与Keap1的BTB域相互作用,促进正常生理条件下蛋白酶体对Nrf2的持续降解,这个过程中Keap1起到衔接Nrf2和Cul3间的桥梁作用[11]。而Keap1在其BTB域内预测的与Cul3相互作用的界面的突变则导致Neh2泛素化减少以及Keap1活性的下调[8]。
3.2 Nrf2调控的抗氧化因子 3.2.1 NQO1NAD(P)H:醌氧化还原酶1(NAD(P)H:quinone oxidoreductase 1,NQO1)是一种同源二聚体黄素酶,通过单步双电子还原反应,可以催化醌还原成氢醌,从而促进醌的排泄,否则醌通过单电子还原反应形成半氢醌,而半氢醌又能够通过氧化还原循环产生ROS,因此NQO1能够阻止环境胁迫剂对DNA造成氧化损伤。此外,NQO1通过维持泛醌和α-生育酚醌的还原形式,在保护内源性抗氧化剂中起重要作用[11]。
研究者通过给予Nrf2(-/-)小鼠以含有诱导剂BHA、乙氧喹、吡噻硫酮或吲哚-3-甲醇的膳食,并进行蛋白印迹法检测,发现其肝脏丧失了诱导NQO1蛋白表达的能力。此外,在Nrf2(-/-)小鼠的肝脏中,NQO1蛋白在正常生理条件下是不可检测的。相应地,对来自这些动物肝脏中的NQO1酶活性进行测试,也显示出这些突变小鼠在正常生理条件下功能蛋白的显著降低,虽然在BHA处理条件下观察到少量诱导。对Nrf2(-/-)小鼠的肝、肾、胃,小肠、大肠和肺中的NQO1 mRNA水平进行检测,发现NQO1的组成型和诱导型表达均减弱,而最明显的变化是Nrf2(-/-)小鼠在大多数组织中且正常生理条件下的NQO1 mRNA水平,低于同样条件下在野生型小鼠中观察到的20%。有时在Nrf2(-/-)小鼠的某些组织中观察到BHA对NQO1的适度诱导,但是鉴于正常条件下在突变小鼠中检测到的低水平的mRNA,由BHA产生的诱导意义是不确定的[12]。因此,Nrf2是正常内稳态和氧化应激条件下NQO1表达的中心控制因子。
3.2.2 HO-1血红素氧合酶1(Heme Oxygenase-1,HO-1)主要催化血红素分解代谢成亚铁、一氧化碳和胆绿素,是一种重要的抗氧化酶。一方面,血红素基团的降解有利于阻止其促氧化作用。另一方面,副产物胆绿素及其还原型胆红素具有有效的ROS清除活性,以抵御过氧化物、过氧亚硝酸盐、羟基和超氧化物自由基[13]。
HO-1 mRNA和蛋白表达可以在受到氧化应激和细胞损伤后上调,而Nrf2也可以直接调节HO-1启动子活性,因为对HO-1启动子的分析,鉴定出了其与ARE类似的结合位点。当体外暴露于各种有毒物质,包括马来酸二乙酯、百草枯和氯化镉,野生型而非Nrf2(-/-)腹膜巨噬细胞能够诱导HO-1mRNA和蛋白质表达[14]。此外,HO-1也被认为参与血管保护。HO-1的过度表达,可以对诸如动脉粥样硬化和心肌缺血-再灌注损伤等的心血管疾病,起防御保护作用。其中,心肌细胞经由Nrf2依赖性机制,产生的由诱导剂3H-1, 2-dithiole-3-thione(D3T)诱导的HO/HO-1的显著表达,可能是保护心肌细胞对抗氧化损伤的重要途径[15]。
3.2.3 SOD超氧化物歧化酶(Superoxide Dismutase, SOD)是机体内清除氧自由基,尤其是清除超氧阴离子自由基的一种重要的抗氧化酶[16]。
在一项研究中发现了SOD比较特别的一点,即总SOD的基础水平在Nrf2(-/-)和野生型心脏成纤维细胞间并没有差异,表明心脏成纤维细胞的SOD的基础表达不依赖于Nrf2的调控作用。但在D3T处理后,野生型成纤维细胞的SOD活性显著提高,而在Nrf2(-/-)细胞中SOD的D3T诱导活性完全消除,由此表明心脏成纤维细胞的SOD的诱导表达依赖于Nrf2的调控作用。同时,这一观察结果与之前的报道一致,即肝细胞中的MnSOD基因表达以Nrf2依赖性方式被D3T诱导,从而表达增强。然而,也有一些研究发现对野生型的巨噬细胞,心肌细胞进行D3T处理,却并不能诱导SOD表达。由此表明,在不同的细胞类型中,Nrf2似乎在调节SOD的诱导表达方面发挥着不同的作用[15, 17]。
3.2.4 CAT过氧化氢酶(Catalase, CAT)是催化H2O2分解产生H2O和O2的酶,由于H2O2是一种活性分子,能够导致羟基自由基的产生,因此CAT通过清除H2O2表现出抗氧化损伤的活性[18]。对Nrf2参与调节细胞CAT诱导表达的研究表明Nrf2(-/-)细胞中CAT的基础活性降低,但野生型心肌细胞经D3T处理后引起CAT显著诱导表达,并且这种诱导表达具有Nrf2依赖性。此外,心肌细胞经D3T处理诱导CAT蛋白表达具有浓度依赖性,然而在野生型心肌细胞中当D3T的处理浓度达到100μM时,虽然CAT蛋白水平进一步增加,却并没有导致CAT酶活性的额外增强,这表明D3T的较高浓度(100μM)对CAT酶活性产生负面影响。这个观点也与Nrf2(-/-)心肌细胞的观察一致,即经100 μM D3T处理后引起CAT酶活性显著降低而不影响其蛋白水平。而100 μM D3T如何抑制Nrf2(-/-)心肌细胞中的CAT酶活性目前尚不清楚[15]。
3.3 Nrf2调控的GSH氧化还原系统机体内的谷胱甘肽(L-γ-glutamyl-cysteinyl-glycine,GSH)氧化还原系统能够维持细胞氧化还原平衡,防止氧化损伤,同时在自由基清除中也起着重要作用。GSH氧化还原系统与Nrf2抗氧化间的联系首先表现在Nrf2调控GSH的生物合成,且主要是调控GSH生物合成的限速酶——γ-谷氨酰半胱氨酸合成酶(γ-glutamyl cysteine synthetase,γ-GCS)的基础和诱导表达。研究者通过给予Nrf2(-/-)心肌细胞以D3T处理,发现D3T介导的γ-GCS的蛋白和mRNA的诱导表达完全消除,表明Nrf2对于D3T介导的γ-GCS诱导表达以及随后的心肌细胞GSH含量升高至关重要。同时,γ-GCS的催化亚基GCLC的mRNA水平也以Nrf2依赖性方式在D3T诱导处理下增加[15]。
其次,Nrf2还调节GSH的再生。Nrf2控制谷胱甘肽过氧化物酶(Glutathione peroxidase,GPx)表达,其在过氧化物的解毒过程中利用GSH作为辅因子,将其氧化成氧化型谷胱甘肽(GSSG)。随后,Nrf2调控的另一种抗氧化酶——谷胱甘肽还原酶(glutathione reductase,GSR)又利用NADPH作为辅因子,将上述GPx作用产生的GSSG还原再生为GSH[19]。
另外,Nrf2还调控另一种Ⅱ相解毒酶——谷胱甘肽S转移酶(Glutathione-S-transferases,GSTs)的表达。GSTs在各种类型亲电试剂的解毒中发挥作用,特别是由致癌物、ROS和脂质过氧化产物的活化产生的亲电试剂。研究表明,Nrf2(-/-)小鼠中GSTs的mRNA和蛋白表达均减少,且Nrf2是BHA和乙氧喹介导的GSTs诱导表达所必需的。相反地,Keap1(-/-)小鼠中GSTs的许多亚型的mRNA表达显著增加[14]。由此,以上研究表明Nrf2在调控GSH氧化还原系统中起关键作用。
4 结论本文在阐述Nrf2抗氧化的分子调控机制过程中,主要围绕以下三点进行整理概括:1)描述Nrf2的结构及激活,以为后续对Nrf2抗氧化的分子调控机制的阐述做铺垫;2)概述Nrf2抗氧化功能,并指出本综述中主要研究对象:Nrf2(-/-)小鼠模型;3)重点阐述了Nrf2抗氧化通路中一些主要相关的调控因子,按照从上游到下游,从被激活到起作用的思路展开探讨。由此进一步证实了Nrf2蛋白在机体抵抗氧化应激损伤,维持细胞氧化还原内稳态中发挥着十分重要的作用。
通过本研究可以体会到目前对Nrf2抗氧化的分子调控机制有了一定的了解,并且这方面的研究在不断深入。本文当中阐述的Nrf2抗氧化相关的调控因子既包含对Nrf2激活起作用的调节因子,又包含Nrf2被激活后诱导调控的下游多种抗氧化因子,涉及到的相关因子种类较多,尤其是后者,但其抗氧化贡献相对更为直接,这些抗氧化因子在被诱导激活后能够调节维持机体内氧化还原平衡。但由于涉及因子多样性及各因子间可能存在的错综复杂的关系,目前的了解还非常有限。未来对Nrf2抗氧化的分子调控机制的研究,应着重于对Nrf2激活及其调控的抗氧化靶基因表达机制的全面透彻的研究,以期为抗氧化治疗提供新思路,为防治多种疾病提供重要的参考。
| [1] |
蔡继翔, 刘烨, 梁明才, 等. 单细胞凝胶电泳应用研究进展[J]. 生物信息学, 2016, 14(2): 95-99. CAI Jixiang, LIU Ye, LIANG Mingcai, et al. The research progress about the application of single cell gel electrophoresis[J]. China Journal of Bioinformatics, 2016, 14(2): 95-99. DOI:10.3969/j.issn.1672-5565.2016.02.05 (  0) 0) |
| [2] |
邵翅, 杨林. 调控胆固醇吸收的分子通路[J]. 生物信息学, 2015, 13(4): 239-243. SHAO Chi, YANG Lin. The molecular pathways of cholesterol absorption regulation[J]. China Journal of Bioinformatics, 2015, 13(4): 239-243. DOI:10.3969/j.issn.1672-5565.2015.04.06 (  0) 0) |
| [3] |
彭雪, 杨林, 刘巧红, 等. 大米蛋白调控成熟期大鼠LDLR基因及蛋白表达[J]. 生物信息学, 2013, 11(2): 120-123. PENG Xue, YANG Lin, LIU Qiaohong, et al. Rice protein affects gene and protein expressions of LDLR in adult rats[J]. China Journal of Bioinformatics, 2013, 11(2): 120-123. DOI:10.3969/j.issn.1672-5565.2013.02.08 (  0) 0) |
| [4] |
王朝阳, 荆黎. 核转录因子E2相关因子2和Keap1的分子结构和功能及其信号通路调控分子机制研究进展[J]. 中国药理学与毒理学杂志, 2016, 30(5): 598-604. WANG Zhaoyang, JING Li. Research progress in molecular structure and function of nuclear factor erythroid 2 related factor 2 and Keap1 and regulation mechanism of signal pathways[J]. Chinese Journal of Pharmacology and Toxicology, 2016, 30(5): 598-604. DOI:10.3867/j.issn.1000-3002.2016.05.018 (  0) 0) |
| [5] |
HO C Y, CHENG Y T, CHAU C F, et al. Effect of diallyl sulfide on in vitro and in vivo Nrf2-mediated pulmonic antioxidant enzyme expression via activation ERK/p38 signaling pathway[J]. Journal of Agricultural & Food Chemistry, 2012, 60(1): 100-107. DOI:10.1021/jf203800d (  0) 0) |
| [6] |
HEISS E H, DANIEL S, KRISTIN Z, et al. Glucose availability is a decisive factor for Nrf2-mediated gene expression[J]. Redox Biology, 2013, 1(1): 359-365. DOI:10.1016/j.redox.2013.06.001 (  0) 0) |
| [7] |
CALKINS M J, JAKEL R J, JOHNSON D A, et al. Protection from mitochondrial complex Ⅱ inhibition in vitro and in vivo by Nrf2-mediated transcription[J]. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(1): 244-249. DOI:10.1073/pnas.0408487101 (  0) 0) |
| [8] |
KOBAYASHI M, YAMAMOTO M. Nrf2-Keap1 regulation of cellular defense mechanisms against electrophiles and reactive oxygen species[J]. Advances in Enzyme Regulation, 2006, 46(1): 113-140. DOI:10.1016/j.advenzreg.2006.01.007 (  0) 0) |
| [9] |
WAKABAYASHI N, ITOH K, WAKABAYASHI J, et al. Keap1-null mutation leads to postnatal lethality due to constitutive Nrf2 activation[J]. Nature Genetics, 2003, 35(3): 238-245. DOI:10.1038/ng1248 (  0) 0) |
| [10] |
DEVLING T W P, LINDSAY C D, MCLELLAN L I, et al. Utility of siRNA against Keap1 as a strategy to stimulate a cancer chemopreventive phenotype[J]. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(20): 7280-7285. DOI:10.1073/pnas.0501475102 (  0) 0) |
| [11] |
JUNG K A, KWAK M K. The Nrf2 system as a potential target for the development of indirect antioxidants[J]. Molecules, 2010, 15(10): 7266-7291. DOI:10.3390/molecules15107266 (  0) 0) |
| [12] |
NIOI P, HAYES J D. Contribution of NAD(P)H:quinone oxidoreductase 1 to protection against carcinogenesis, and regulation of its gene by the Nrf2 basic-region leucine zipper and the arylhydrocarbon receptor basic helix-loop-helix transcription factors[J]. Mutation Research, 2004, 555(1-2): 149-171. DOI:10.1016/j.mrfmmm.2004.05.023 (  0) 0) |
| [13] |
GONZALEZBURGOS E, CARRETERO M E, GOMEZSERRANILLOS M P. Diterpenoids Isolated from Sideritis species protect astrocytes against oxidative stress via Nrf2[J]. Journal of Natural Products, 2012, 75(10): 1750-1758. DOI:10.1021/np300418m (  0) 0) |
| [14] |
KLAASSEN C D, REISMAN S A. Nrf2 the rescue: Effects of the antioxidative/ electrophilic response on the liver[J]. Toxicology & Applied Pharmacology, 2010, 244(1): 57-65. DOI:10.1016/j.taap.2010.01.013 (  0) 0) |
| [15] |
ZHU H, JIA Z, MISRA B R, et al. Nuclear factor E2-related factor 2-dependent myocardiac cytoprotection against oxidative and electrophilic stress[J]. Cardiovascular Toxicology, 2008, 8(2): 71-85. DOI:10.1007/s12012-008-9016-0 (  0) 0) |
| [16] |
杨力明, 杨谦, 刘丕钢, 等. 哈茨木霉超氧化物歧化酶基因克隆与特性分析[J]. 生物信息学, 2007, 5(4): 148-150. YANG Liming, YANG Qian, LIU Pigang, et al. Cloning and characterization analysis of superoxide dismutase gene from Trichoderma harzianum[J]. Chinese Journal of Bioinformatics, 2007, 5(4): 148-150. DOI:10.3969/j.issn.1672-5565.2007.04.002 (  0) 0) |
| [17] |
ZHU H, ITOH K, YAMAMOTO M, et al. Role of Nrf2 signaling in regulation of antioxidants and phase 2 enzymes in cardiac fibroblasts: Protection against reactive oxygen and nitrogen species-induced cell injury[J]. Febs Letters, 2005, 579(14): 3029-3036. DOI:10.1016/j.febslet.2005.04.058 (  0) 0) |
| [18] |
陈姗姗, 郭晋隆, 李国印, 等. 甘蔗过氧化氢酶基因的电子克隆及生物信息学分析[J]. 生物信息学, 2012, 10(1): 65-70. CHEN Shanshan, GUO Jilong, LI Guoyin, et al. Electronic cloning and characterization of CAT gene from Saccharum officinarum using bioinformatics tools[J]. Chinese Journal of Bioinformatics, 2012, 10(1): 65-70. DOI:10.3969/j.issn.1672-5565.2012.01.16 (  0) 0) |
| [19] |
NAIDU S D, KOSTOV R V, DINKOVA-KOSTOVA A T. Transcription factors Hsf1 and Nrf2 engage in crosstalk for cytoprotection[J]. Trends in Pharmacological Sciences, 2014, 36(1): 6-14. DOI:10.1016/j.tips.2014.10.011 (  0) 0) |
 2018, Vol. 16
2018, Vol. 16


