衰老是生物体维持分子、细胞或个体水平生理完整性能力的逐步丧失,表现为细胞或生物体对各种压力和疾病的抗性逐步下降的生物学过程[1]。衰老几乎发生于每个物种中,人类也不例外。近年研究显示,衰老本身是导致衰老相关疾病(包括心血管疾病、Ⅱ型糖尿病、神经退行性疾病及癌症等)最主要的风险因子[2],因此,通过延缓衰老本身来预防和治疗衰老相关疾病正成为业内共识,而寻找抗衰老活性分子和策略正成为衰老研究领域的重点和热点。
天然产物多球壳菌素(Myriocin, 分子式C12H39NO6,分子量401.5,一种神经鞘脂合成特异性抑制剂)是前期发现的一种新的抗衰老活性分子[3],雷帕霉素(Rapamycin, 分子式C51H79NO13,分子量914.0,一种TORC1激酶特异抑制剂)是一种广谱的抗衰老活性分子。前期研究表明,多球壳菌素和雷帕霉素可通过分子间协同效应延缓芽殖酵母细胞衰老并延长细胞寿命[4]。为进一步阐明此协同效应的作用机制,本文考察了该协同效应对细胞转录组的影响,进而从生信角度分析了该协同效应调控的细胞过程和信号通路,为阐明该协同效应的作用机制提供依据和思路。
1 材料与方法 1.1 实验材料与原始数据实验菌种、培养基及处理均同文献[4]。菌种为野生型芽殖酵母(Saccharomyces cerevisiae)DBY746;培养基为SDC(Synthetic Dextrose Complete);实验处理为:无药物处理组(ND, 样本编号DS-1~5)、45 ng/ml Myr处理组(Myr, 样本编号DS-6~10)、450 pg/ml Rap处理组(Rap,样本编号DS-11~15)、45 ng/ml Myr及450 pg/ml Rap组合处理组(Syn, 样本编号DS-16~20)。随后利用RNeasy试剂盒(Qiagen, Cat#74104)提取总RNA,在各组中筛选出组内RNA质量浓度相近且质量好的3个样本,进行基因芯片检测,得到微阵列MAS5信号值作为原始数据[5-8]。
1.2 生物信息学分析 1.2.1 主成分分析主成分分析(principal component analysis, PCA)使用R软件(版本3.3)及R Studio(版本1.0.136),通过扩展包“psych”,对每个样本的5 900个探针信号值数据做降维处理,提取3个主成分;通过扩展包“rgl”,将3个主成分的因子载荷(loadings)作为三维坐标,进行可视化。
1.2.2 差异表达基因通过使用R语言平台(版本3.3,https://www.r-project.org/下载)、“Bioconductor”扩展包分析基因芯片数据,得到差异表达基因(differentially expressed genes, DEGs)列表(DEGs list)。采用在线程序DAVID (database for annotation, visualization and integrated discovery, 版本6.8, https://david-d.nciFoldChangerf.gov/)补充探针注释[9],YEASTRACT(yeast search for transcriptional regulators and consensus tracking, http://www.yeastract.com/)补充ORF/Gene Symbol。同时通过扩展包“Vennerable”绘建韦恩图(Venn diagrams),对差异表达基因进行可视化[10]。
1.2.3 基因本体聚类(GO terms clustering)采用在线程序DAVID (database for annotation, visualization and integrated discovery, https://david-d.nciFoldChangerf.gov/) Functional Annotation Clustering工具[9],对DEGs list (FDR<0.05 & Fold Change>10%)进行基因本体聚类[11],选择Benjamin=0.05为阈值筛选clusters,选择Benjamin<0.05得到Go Terms。
1.2.4 信号通路分析(pathways analysis)采用在线程序DAVID (database for annotation, visualization and integrated discovery, https://david-d.nciFoldChangerf.gov/) Functional Annotation Clustering工具[9],对DEGs list (FDR<0.05 & Fold Change>10%)进行信号通路[12]聚类,选择Benjamin=0.05为阈值筛选聚类簇,选择Benjamin<0.05的信号通路。
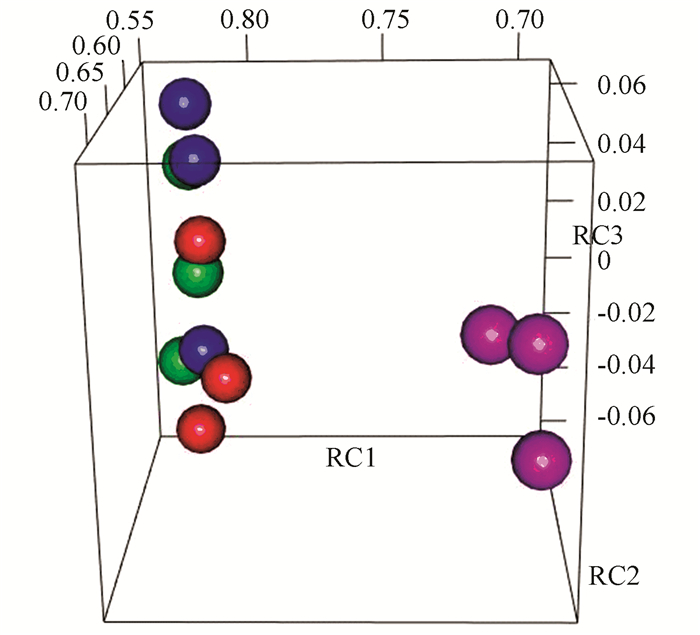
2 结果分析 2.1 主成分分析主成分分析结果见表 1。在提取的3个主成分中,协同效应组(Syn)的主成分1因子载荷与其他3组体现出明显的差异。对表 1中数据进行可视化如图 1所示, 结果显示,Syn与单种药物处理组(Myr, Rap)及单一药物处理组(Myr, Rap)或无药物处理组(ND)呈显著差异,同时,Myr、Rap及ND等3组在主成分上有明显重叠,这表明低剂量药物处理芽殖酵母时,与对照组无显著差异,而两种药物组合使用时,产生了显著差异。
|
图 1 主成分分析 Figure 1 Principle component analysis 注:红色、蓝色、绿色和粉色分别为无药物处理组、Rap处理组、Myr处理组和协同效应组; RC1、RC2、RC3分别为某样本的主成分1、2、3的因子载荷。 |
| 表 1 主成分分析数据 Table 1 PCA data |
分析差异表达基因数目可知,相比于无药物处理组,协同效应用药导致2 546个基因的表达水平发生显著变化,而其中超过89%的差异表达基因在Myr组、Rap组未出现。Myr组、Rap组及Syn组处理导致的差异表达基因列表见表 2.
| 表 2 差异表达基因数目 Table 2 The number of differentially expressed genes (DEGs) |
通过绘制韦恩图(如图 2所示)可直观看出,在该筛选条件下,绝大多数差异表达基因只存在于协同效应组中,协同用药与单一药物处理有显著差异。

|
图 2 差异表达基因韦恩图 Figure 2 Venn diagram of DEGs 注:筛选条件为FDR值<0.05且Fold change>10%,圆形区域表示在上述筛选条件下差异表达的基因数量,颜色代表不同的实验处理组:绿色为Syn组;蓝色为Myr组;红色为Rap组。 |
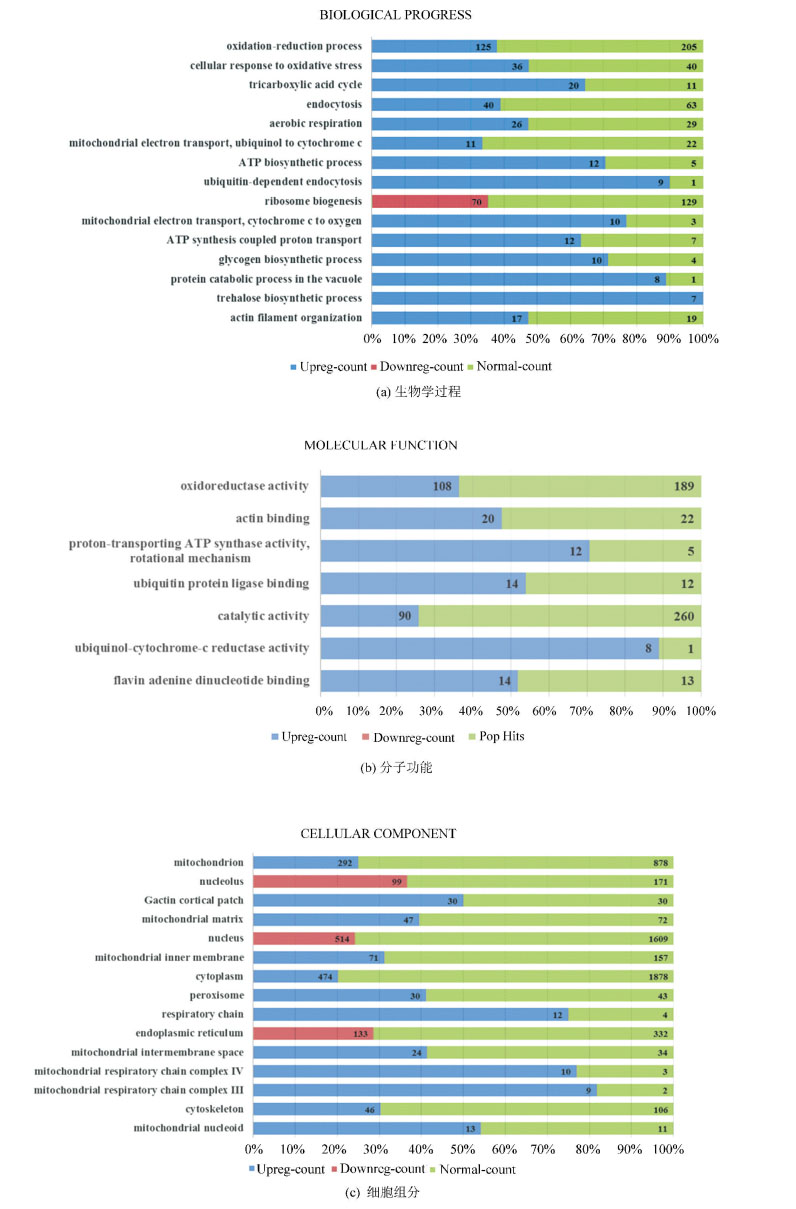
生物学过程的聚类结果(如图 3所示)显示,差异表达的基因主要与氧化还原过程(GO:0055114 oxidation-reduction process)、细胞的氧化应激反应(GO:0034599 cellular response to oxidative stress)、三羧酸循环(GO:0006099 tricarboxylic acid cycle)、需氧呼吸(GO:0009060 aerobic respiration)、线粒体电子传递(泛醌至细胞色素c)(GO:0006122 mitochondrial electron transport, ubiquinol to cytochrome c)、ATP生物合成途径(GO:0006754 ATP biosynthetic process)、线粒体电子传递(细胞色素c至氧)(GO:0006123 mitochondrial electron transport, cytochrome c to oxygen)、ATP合成偶联质子转运(GO:0015986 ATP synthesis coupled proton transport)等过程密切相关。这些生物学过程几乎均发生在线粒体区域中,推测线粒体相关生物学过程是协同效应的一个重要靶点。
|
图 3 GO聚类分析 Figure 3 GO terms clustering analysis 注:图 3(a)中左侧为不同的基因本体项目(GO terms),右侧为某项目中基因表达水平(蓝色表示上调、红色表示下调、绿色表示正常)的计数,图 3(b)、(c)类同。在满足筛选条件的项目中,对p取负常用对数值,按大小排序,图 3(a)生物学过程取值最大的15个项目,图 3(b)分子功能取全部8项,图 3(c)细胞组分取值最大的15个项目。 |
细胞组分的聚类分析结果(如图 3所示)显示,差异表达的基因主要与线粒体(GO:0005739 mitochondrion)、线粒体基质(GO:0005759 mitochondrial matrix)、线粒体内膜(GO:0005743 mitochondrial inner membrane)、呼吸链(GO:0070469 respiratory chain)、线粒体膜间隙(GO:0005758 mitochondrial intermembrane space)、线粒体呼吸链复合物Ⅳ(GO:0005751 mitochondrial respiratory chain complex Ⅳ)、线粒体呼吸链复合物Ⅲ(GO:0005750 mitochondrial respiratory chain complex Ⅲ)、线粒体拟核(GO:0042645 mitochondrial nucleoid)等密切相关。这一结果也显示,线粒体相关细胞组分是协同效应的重要靶点。
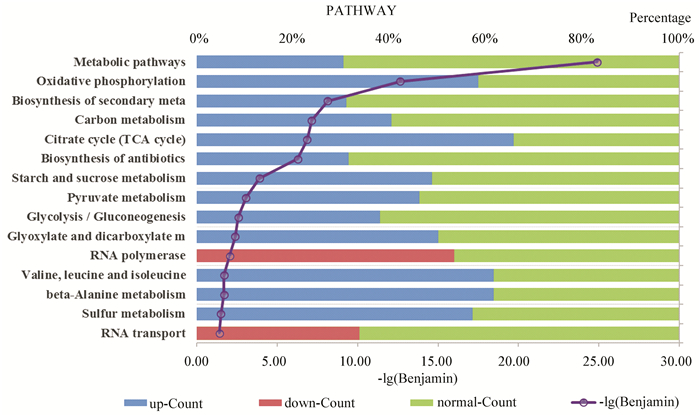
2.4 通路分析通路分析结果(如图 4所示)显示,相比于无药物处理组,协同效应用药组内147条通路发生改变,其中超过60%的通路在Myr组、Rap组没有显著变化。按照Benjamin由小至大排列,在前15条通路中,超过1/3的通路(包括氧化磷酸化(sce00190:Oxidative phosphorylation)、碳代谢(sce01200:Carbon metabolism)、三羧酸循环(sce00020:Citrate cycle)、丙酮酸代谢(sce00620:Pyruvate metabolism)、糖酵解(sce00010:Glycolysis / Gluconeogenesis)等)直接与线粒体功能相关,具体可见附加文件GO term & Pathways.xlsx。
|
图 4 通路分析 Figure 4 Pathway analysis 注:图中左侧为不同的通路,右侧为不同表达水平(蓝色表示上调、红色表示下调、绿色表示正常)的差异表达基因在某通路中所占比例。对p取负常用对数值,按大小排序并取值最大的15条通路绘制图 4。 |
主成分分析结果显示单一药物处理组(包括Myr, Rap)与无药物处理组在转录组水平无显著差异,说明此低剂量药物对转录组产生极小影响,与实验中发现的低剂量药物对细胞寿命影响极小的结论相吻合。
3.2 差异表达基因数量分析对差异表达基因列表分析显示,协同效应组表达水平发生显著变化的2 546个基因中,有超过89%的差异表达基因在Myr组、Rap组未出现。仅在协同药物处理时表达水平发生显著变化的基因,简称为Unique to Syn。本文认为,导致该情况发生的原因为:1)Unique to Syn的表达受到单一药物雷帕霉素或多球壳菌素的调控,但由于实验中选用的药物浓度极低(45 ng/ml Myr、450 pg/ml Rap),未能使该类基因的表达水平达到本文选取的统计学筛选阈值,即未能使其显著性差异表达;2)Unique to Syn的表达不受单一药物雷帕霉素或多球壳菌素的调控,仅仅在两种小分子同时处理时才会对Unique to Syn起到调控。这两种猜想还需进一步通过实验加以判断。
3.3 差异表达基因聚类分析差异基因本体聚类及通路分析结果均显示,线粒体功能,包括线粒体相关的组分(如线粒体内膜、外膜)和生化过程(如氧化磷酸化、三羧酸循环),可能是多球壳菌素和雷帕霉素协同效应调控的重要靶点,后续将从实验角度加以重点研究。线粒体的氧化反应可能参与衰老和长寿的过程。线粒体是细胞内活性氧的主要来源,线粒体或其DNA受到氧化损伤可能缩短寿命[13]。因此,推测线粒体相关的分子功能、细胞组分、生物学过程和信号通路是此协同效应的一个主要靶点,其与衰老具有密不可分的关系。
4 结论1) 研究表明,线粒体内蛋白及核酸等氧化损伤是机体衰老的重要原因。Kovalenko等[14]提出线粒体DNA突变在组织细胞衰老过程中起着重要作用,发现线粒体DNA突变引起细胞凋亡才是导致衰老的根本因素,而并非由自由基增多引起的细胞损伤所导致的。
2) 近年研究发现,线粒体DNA的突变可以引起某种通路中的信号级联放大,最终导致细胞程序性死亡[13, 15]。这一研究结果为本文中所考察的协同效应实验现象的生物学解释提供了思路,即雷帕霉素和多球壳菌素的组合调控了某种级联放大通路,导致细胞寿命的显著延长。
| [1] |
LOPEZ-OTIN C, BLASCO M A, PARTRIDGE L, et al. The hallmarks of aging[J]. Cell, 2013, 153(6): 1194-1217. DOI:10.1016/j.cell.2013.05.039 (  0) 0) |
| [2] |
KENNEDY B K, BERGER S L, BRUNET A, et al. Geroscience: linking aging to chronic disease[J]. Cell, 2014, 159(4): 709-713. DOI:10.1016/j.cell.2014.10.039 (  0) 0) |
| [3] |
HUANG Xinhe, LIU Jun, DICKSON R C. Down-regulating sphingolipid synthesis increases yeast lifespan[J]. PLoS Genet, 2012, 8(2): e1002493. DOI:10.1371/journal.pgen.1002493 (  0) 0) |
| [4] |
HUANG Xinhe, LIU Jun, WITHERS B R, et al. Reducing signs of aging and increasing lifespan by drug synergy[J]. Aging Cell, 2013, 12(4): 652-660. DOI:10.1111/acel.12090 (  0) 0) |
| [5] |
IRIZARRY R A, BOLSTAD B M, COLLIN F, et al. Summaries of Affymetrix GeneChip probe level data[J]. Nucleic Acids Res, 2003, 31(4): e15. DOI:10.1093/nar/gng015 (  0) 0) |
| [6] |
PEPPER S D, SAUNDERS E K, EDWARDS L E, et al. The utility of MAS5 expression summary and detection call algorithms[J]. BMC Bioinformatics, 2007, 8(273). DOI:10.1186/1471-2105-8-273 (  0) 0) |
| [7] |
刘建胜, 张善镇, 姚志洪, 等. 不同表达谱芯片分析方法在药效机制研究中的应用[J]. 计算机应用与软件, 2015, 32(6): 57-61, 108. LIU Jiansheng, ZHANG Shanzhen, YAO Zhihong, et al. Application of different microarray analysis methods in pharmacological mechanism research[J]. Computer Applications and Software, 2015, 32(6): 57-61, 108. DOI:10.3969/j.issn.1000-386x.2015.06.014 (  0) 0) |
| [8] |
贾晓东, 陈秀杰, 吴欣, 等. 基于基因表达变异性的通路富集方法研究[J]. 生物化学与生物物理进展, 2013(12): 1256-1264. JIA Xiaodong, CHEN Xiujie, WU Xin, et al. A method of pathway enrichment analysis based gene expression variability[J]. Progress in Biochemistry and Biophysics, 2013(12): 1256-1264. DOI:10.3724/SP.J.1206.2012.00410 (  0) 0) |
| [9] |
HUANG D W, SHERMAN B T, LEMPICKI R A. Systematic and integrative analysis of large gene lists using DAVID bioinformatics resources[J]. Nat Protoc, 2009, 4(1): 44-57. DOI:10.1038/nprot.2008.211 (  0) 0) |
| [10] |
纪相禹. 基于R语言的差异表达基因检测研究[D]. 长春: 吉林大学, 2011. JI Xiangyu. The study of differentially expressed gene detection based on r language[D]. Changchun: Jilin University, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10183-1011101995.htm (  0) 0) |
| [11] |
ASHBURNER M, BALL C A, BLAKE J A, et al. Gene ontology: tool for the unification of biology. The gene ontology consortium[J]. Nat Genet, 2000, 1(25): 29. DOI:10.1016/j.jcz.2007.05.001 (  0) 0) |
| [12] |
KANEHISA M, GOTO S. KEGG: kyoto encyclopedia of genes and genomes[J]. Nucleic Acids Research, 2000, 28(1): 27-30. DOI:10.1093/nar/28.1.27 (  0) 0) |
| [13] |
莫菲, 管德龙, 韩燕, 等. 线粒体DNA及相关基因与衰老的关系[J]. 中国老年学杂志, 2016, 36(11): 2796-2799. DOI:10.3969/j.issn.1005-9202.2016.11.109 (  0) 0) |
| [14] |
龙建纲. 衰老及相关疾病中线粒体损伤与保护机制研究[D]. 上海: 第二军医大学, 2006. DOI: 10.7666/d.y897183. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y897183
(  0) 0) |
| [15] |
RAIMUNDO N, SONG Lei, SHUTT T E, et al. Mitochondrial stress engages E2F1 apoptotic signaling to cause deafness[J]. Cell, 2012, 148(4): 716-726. DOI:10.1016/j.cell.2011.12.027 (  0) 0) |
 2017, Vol. 15
2017, Vol. 15


