2. 国家人口和计划生育委员会计划生育药具重点实验室(上海市计划生育科学研究所),上海 200032
2. National Population and Family Planning Key Laboratory of Contraceptive Drugs & Devices(Shanghai Institute of Planned Parenthood Research), Shanghai 200032, China
各类蛋白参与构成真核生物细胞结构,其产生与降解都受到精确调控。在多种蛋白质降解途径中,泛素-蛋白酶体系统(ubiquitin proteasome system, UPS)可降解真核细胞内变异、错误折叠以及异常聚集的蛋白,该系统介导的蛋白降解是一种动态可逆的蛋白翻译后调控过程,此过程由多种泛素化酶以及去泛素化酶进行精细调控。各种泛素化酶催化泛素分子与靶蛋白结合,使靶蛋白被蛋白酶体识别而降解;而去泛素化酶正好相反,它们使泛素分子与靶蛋白解离,阻止蛋白被降解。在去泛素化酶家族中有一类重要的水解酶家族——泛素羧基末端水解酶家族(ubiquitin C-terminal hydrolases, UCH),它们主要是将泛素羧基末端连接的分子水解下来。目前研究较多的是泛素羧基末端水解酶1(UCHL1)。
研究发现UCHL1蛋白特异性高表达于脑[1]与生殖细胞[2],与神经退行性疾病[3]和生殖细胞的发育有关。泛素化蛋白的积聚是一系列神经退行性疾病的普遍标志,在阿尔茨海默病患者中淀粉样蛋白-β(amyloid-beta, Aβ)蛋白积聚促进靶蛋白氧化,研究发现UCHL1蛋白也是氧化应激反应的一个底物,UCHL1蛋白被氧化后失去功能,导致UPS过程中的靶蛋白不能与泛素分子分离,进而导致神经元泛素化/去泛素化机制失调,Aβ等蛋白积累,最终引起神经元退化[4]。此外,UCHL1也参与精子发生[5]、卵母细胞的成熟[6-9]以及受精[10-12]等过程。研究发现25周雄性UCHL1基因缺陷型gad(-/-)小鼠生精小管萎缩,生精干细胞增殖减少[13];雌性gad(-/-)小鼠具有多精入卵的现象[11-12],本文也发现UCHL1敲除的小鼠成熟卵母细胞数相对野生型降低,且排卵障碍。另外,UCHL1在卵母细胞减数分裂过程中发挥一定作用:抑制UCHL1表达后,猪卵母细胞停滞在第1次减数分裂中后期过渡点,进而影响卵母细胞的正常形成[14]。这一系列现象都说明UCHL1缺失影响生殖细胞的正常发育。另外,UCHL1的表达与肿瘤的发生也具有一定的联系,UCHL1蛋白在脑[15]、肺[16]、肾[17]、结肠[18]、膀胱[19]、前列腺[20]等肿瘤组织中过表达,在卵巢癌中表达量减少[21]。
迄今为止UCHL1在神经与肿瘤方面的研究比较多,在生殖领域文献较少,且研究对象主要集中在人、小鼠、大鼠,而对其他物种的研究较少。本文采用生物信息学手段,通过分析脊椎动物中各物种的UCHL1基因与蛋白序列,了解UCHL1基因的进化特点,预测UCHL1蛋白去泛素化功能在脊椎动物中是否普遍存在,以及其是否还具有其他功能,最终也为研究该基因参与生殖细胞发生的作用机理提供资料与新的思路。
1 数据的获取在NCBI的GENE库中输入“UCHL1”搜索得到304种生物的基因序列,点击进入人的UCHL1基因相关信息,在“General gene information”部分可看到共有206种生物与人UCHL1基因直系同源,这些物种全部属于脊椎动物(见表 1)。挑选分别代表哺乳类、鸟类、鱼类、爬行类、两栖类这5类生物中的人(homo sapiens)、小鼠(mus musculus)、大鼠(rattus norvegicus)、马(equus caballus)、猕猴(macaca mulatta)、鸡(gallus gallus)、斑胸草雀(taeniopygia guttata)、斑马鱼(danio rerio)、绿海龟(chelonia mydas)、安乐蜥(anolis carolinensis)、非洲爪蟾(xenopus tropicalis)11个物种进行UCHL1基因分析。
| 表 1 脊椎动物中与人UCHL1直系同源的物种数 Table 1 The number of orthologous species of human UCHL1 in vertebrates |
核酸序列分析表明UCHL1基因序列长度变化(见表 2),除斑马鱼、鸡、斑胸草雀外,其他物种的基因长度大约都在11 000 bp左右,外显子个数基本集中在9个左右,mRNA长度基本集中在1 100 bp左右,UCHL1蛋白序列的平均长度为223 aa。这说明UCHL1在漫长的进化过程中,虽然不同生物所处的环境不同,但编码序列比较保守,从鱼类到哺乳类的变化都较小,这种进化的保守性说明这些编码基因对于蛋白自身功能是非常重要的,无论外界环境如何变化或受到何种刺激,它们在生物进化的过程中不会轻易改变。相对于外显子,大部分内含子不含有功能原件,所承受的选择压力相对较小,其变异要远多于外显子。分析显示,鸡、斑胸草雀、斑马鱼的基因序列长度要远小于其他8种生物,所以又查询了鸟类与鱼类中的几种生物,如:鹌鹑(coturnix japonica)的UCHL1基因序列长度为4 373 bp,大山雀(parus major)为5 063 bp,家鸽(columba livia)为4 546 bp,白尾鹲(phaethon lepturus)为4 509 bp,斑鼠鸟(speckled mousebird)为4 396 bp, 这些生物的基因长度大约在4 000~5 000 bp;斑点叉尾鮰(ictalurus punctatus)的UCHL1基因序列长度为4 054 bp,羊头鱼(sheepshead minnow)为4 751 bp,珍珠玛丽鱼(sailfin molly)为4 274 bp,半滑舌鳎(cynoglossus semilaevis)为3 884 bp,红鳍东方鲀(takifugu rubripes)为3 223 bp,这些生物的基因长度约在3 000~5 000 bp,也就是大部分鱼类和鸟类的UCHL1基因序列长度要比人等其他生物的短。进一步将鸡、斑胸草雀、斑马鱼这3种生物的外显子和内含子与人类进行对比发现,除斑胸草雀外显子长度变化较大外,其他3种生物外显子长度变化非常小,而4种生物的内含子长度变化非常大如图 1所示。这提示对内含子进行研究可能有助于了解UCHL1对环境的适应变化。
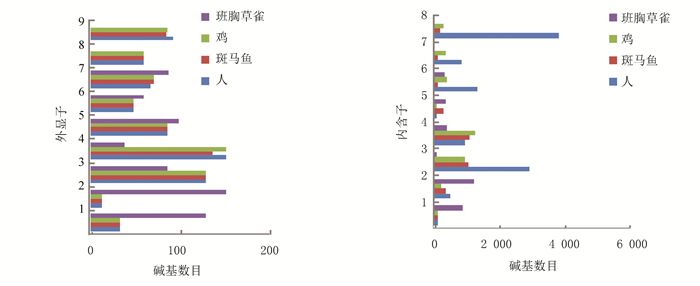
|
图 1 人、斑马鱼、鸡、斑胸草雀的外显子、内含子长度对比 Figure 1 Comparison of exons and introns length in Homo sapiens, Danio rerio, Gallus gallus and Taeniopygia guttata |
| 表 2 UCHL1基因特点分析 Table 2 Gene characteristic analysis of UCHL1 |
用EMBL-EBI中的Clustal Omega程序对11种生物UCHL1基因编码的氨基酸序列进行保守性分析如图 2所示,另外再用NCBI中的Blast程序对每两个物种的氨基酸序列进行同源性对比,发现11个物种之间的同源性都在60%以上(未展示数据), 说明UCHL1氨基酸序列在进化上也是高度保守的。本文以人的UCHL1氨基酸序列为基础,通过UniProt数据库中的子数据库UniProtKB查询UCHL1蛋白的相关信息,人的UCHL1蛋白由223个氨基酸分子构成,据文献报道[22]第5~10个氨基酸区域——PMEINP(脯氨酸、甲硫氨酸、谷氨酸、异亮氨酸、天冬氨酸、脯氨酸)以及第211~216个氨基酸区域——EVRFSA(谷氨酸、缬氨酸、精氨酸、苯丙氨酸、丝氨酸、丙氨酸)是与泛素分子相互作用的部位;第90个氨基酸C(半胱氨酸)是该蛋白的亲核位点;第161个氨基酸H(组氨酸)是该蛋白的质子供体;第176位氨基酸D(天冬氨酸)对酶活性具有重要作用[23]。根据序列同源性对比,本文发现除了非洲爪蟾、绿海龟之外,其余9种生物都具有PMEINP区域,另外这11种生物都具有EVRFSA区域,说明这两个区域的序列在进化上高度保守,是与泛素分子相互作用所必需的。C90、H161、D176这3个氨基酸在11种生物中也都高度保守。

|
图 2 UCHL1氨基酸序列保守区域分析 Figure 2 Conservative region analysis of amino acid sequences 注:下划线部分表示UCHL1发挥作用所需要的活性位点和区域;星号表示同源性较高的氨基酸。 |
除此之外,UCHL1蛋白C末端的第220位氨基酸被认为是UCHL1向膜定位的一个关键氨基酸。据文献报道[24]UCHL1在神经元中分为两种形式:可溶性细胞质蛋白和膜关联蛋白,C末端发生法尼基化促进UCHL1向膜定位,使膜关联蛋白比例增多,进而导致α-突触核蛋白积聚,产生细胞毒性。但另外也有文献[25]反对该观点,认为C末端的法尼基化与UCHL1的膜定位无关,该文献发现用法尼基化抑制剂或是使C220残基突变都没有降低膜关联UCHL1蛋白的含量,反而是C末端220-223位氨基酸(CKAA)缺失导致蛋白可溶性丧失,也使UCHL1丧失与底物结合的能力,增加了神经元细胞的死亡。尽管这两个实验结果仍值得进一步的重复与探讨,但它们都表明C末端的氨基酸在神经元细胞正常生存过程中发挥着重要作用。通过序列同源对比分析,除了安乐蜥与非洲爪蟾外,UCHL1蛋白序列第220位氨基酸都是半胱氨酸,这提示本文该位点在进化过程中具有高度保守性,其相关功能值得进一步分析。另外安乐蜥与非洲爪蟾第220位氨基酸是丝氨酸,该位点的突变是否会造成神经元细胞损伤也需要进一步的研究。
4 UCHL1基因的分子进化树通过氨基酸序列同源性对比获得这11种生物的分子进化树如图 3所示。进化树可分为5组:第1组包括斑马鱼(danio rerio)和非洲爪蟾(xenopus tropicalis);第2组包括绿海龟(chelonia mydas)和安乐蜥(anolis carolinensis);第3组包括鸡(gallus gallus)和斑胸草雀(taeniopygia guttata);第4组包括小鼠(mus musculus)、大鼠(rattus norvegicus)和马(equus caballus);第5组包括人(homo sapiens)、猕猴(macaca mulatta)。该分子进化趋势与物种进化趋势一致。
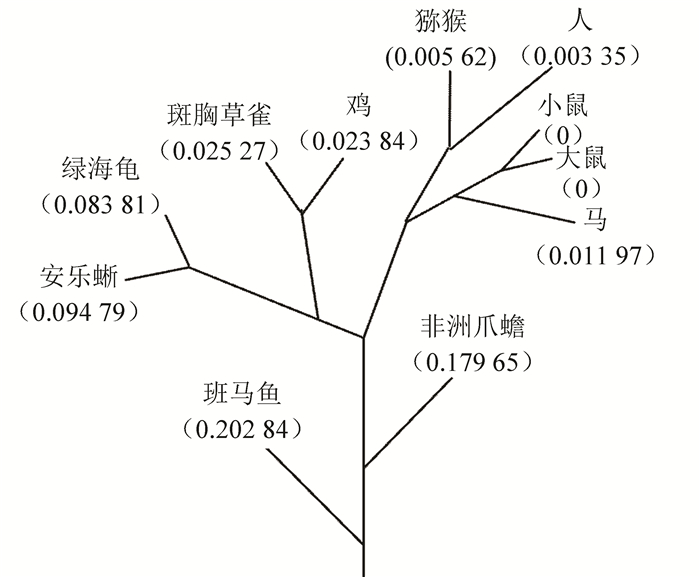
|
图 3 UCHL1基因系统进化树 Figure 3 Phylogenetic tree of UCHL1 |
在UniProt数据库的子数据库UniProtKB中查询UCHL1(Homo Sapiens)蛋白的结构信息,在“3D structure databases”部分得到该蛋白在PDBe数据库中的编号2ETL。UCHL1蛋白由223个氨基酸分子组成,其二级结构包括7个α-螺旋,6个β-折叠,22个β-转角,3个γ-转角。其中C90位于第3个α-螺旋,H161位于第3个β-折叠,D176位于第18个β-转角(如图 4、5所示),这3个元素形成一个三角形的排列,并产生疏水性接触。UCHL1蛋白与底物结合时,其空间构象发生改变,氢键断裂使活性位点暴露而产生水解酶活性,底物被释放时又恢复无活性的状态[26],据文献报道[26]UCHL1蛋白中I93M突变可能是造成帕金森综合征的原因之一,该位点位于第3个α-螺旋的位置,也是C90所在的位置,I93M突变可能会导致C90、H161、D176三角构型改变,进而改变活性中心结构而影响UCHL1的功能。另外有研究推测S18Y多态性变异可抑制帕金森综合征,这种变异提高了神经细胞抗氧化能力,保护其免受氧化伤害[27]。S18位于第1个α-螺旋,由于位于该位置的氨基酸类型在物种中比较多变,从结构角度无法判断S18Y多态性变异如何降低帕金森综合征的易感性[26]。
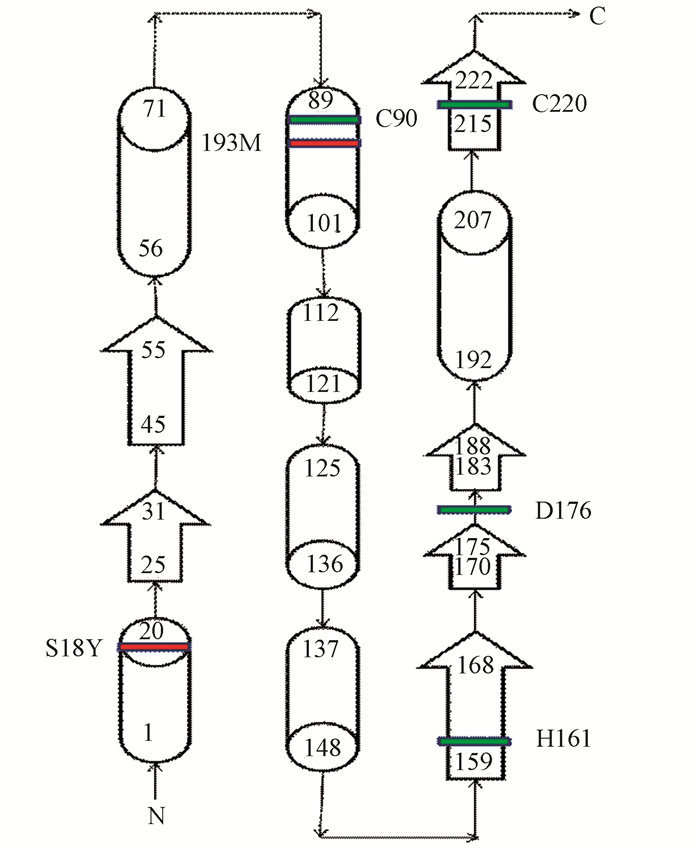
|
图 4 人类UCHL1二级结构平面图 Figure 4 Secondary structure ichnography of human UCHL1 注:图中红色条带表示已知的突变,绿色条带表示UCHL1活性位点。 |
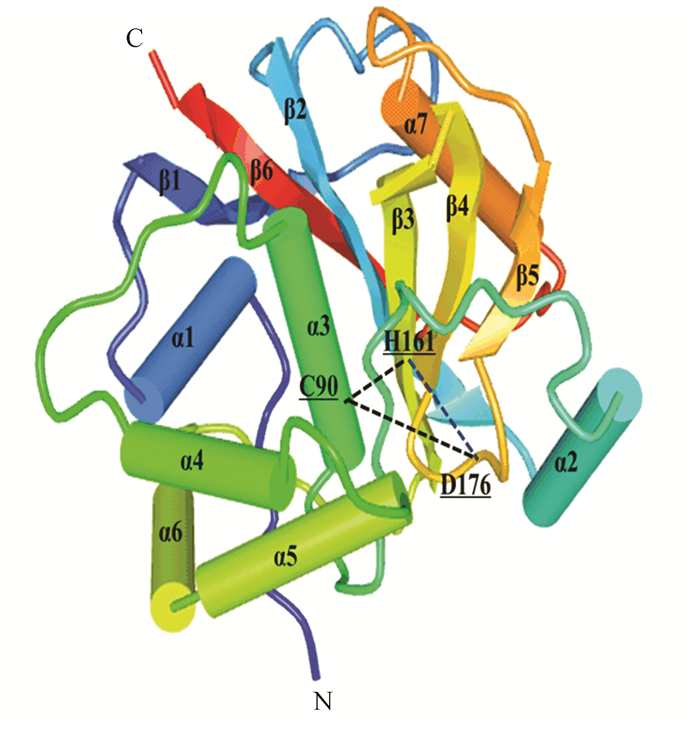
|
图 5 人类UCHL1二级结构立体图 Figure 5 Secondary structure graphic model of human UCHL1 注:由黑色虚线构成的三角形为UCHL1活性区域。 |
1) 通过NCBI数据库中Gene、Protein等子数据库分析UCHL1在不同生物中的基因与蛋白特征,发现UCHL1在进化中具有高度保守性,其细微差异体现的分子进化趋势与物种进化趋势完全一致。首先UCHL1基因组长度在进化过程中变化较大,外显子个数变化较小,内含子方面变异较大,氨基酸的个数基本维持在223个左右,这说明该蛋白具有的功能对生物自身的生存是非常重要的,即UCHL1通过其水解作用自靶蛋白解离泛素分子以维持蛋白降解平衡。其次,不同生物的UCHL1蛋白序列同源性也很高,一般在60%以上,与UCHL1功能相关的序列区域和位点在不同生物中也都高度保守。若这些位点或区域氨基酸发生突变,蛋白功能受损,将会影响生物体机能的正常运行。目前为止只有人类的UCHL1二级结构得到了精确分析,通过上述同源性比较,预测其中的某些结构区域在不同生物中也可能是高度保守的,比如C90、H161、D176所形成的三角疏水区域等。
2) 通过上述进化分析,本文预测UCHL1的去泛素化功能在脊椎动物中是普遍存在的,可以根据UCHL1在人体中的组织特异性分布去推测其在其他生物体内的分布,使用身体构造更加简单的模式动物,通过各种基因编辑方法研究该基因在某些组织中是否发挥相应的功能。例如:UCHL1发挥水解作用的位点在物种进化中存在高度保守性,可尝试对这些位点进行点突变,或敲除相应的基因序列使其无法编码功能氨基酸位点,或者表达一种配体蛋白与UCHL1蛋白结合使其构象改变而不能发挥水解作用等。
3) UCHL1除了去泛素化酶作用,以二聚体形式存在时会发挥泛素连接酶的作用,但关于该作用的研究相对较少,有文献曾经报道[28]UCHL1以二聚体形式存在时会导致聚泛素化的α-突触核蛋白(α-synuclein)的积聚,进而导致神经元受损。根据以上进化信息,该连接酶作用可能在各种生物中普遍存在,值得进一步研究。
4) 综上所述,进化上的高度保守性表明,UCHL1虽然仅仅在大脑和生殖腺特异性高表达,但它是一种生物体发挥正常机能所必需的基因。不论是神经疾病还是生殖疾病方面,该基因的功能得到肯定,而在作用机制研究方面却停滞不前。另外,无论是其去泛素化酶作用还是泛素连接酶作用,还需要研究者们通过更多的实验来探索与证实。随着基因工程技术的突破性进展,预期对UCHL1基因的研究会有质的突破。
| [1] |
WILKINSON K D, LEE K M, DESHPANDE S, et al. The neuron-specific protein PGP 9.5 is a ubiquitin carboxyl-terminal hydrolase[J]. Science, 1989, 246(4930): 670-673. DOI:10.1126/science.2530630 (  0) 0) |
| [2] |
SAIGOH K, WANG Y L, SUH J G, et al. Intragenic deletion in the gene encoding ubiquitin carboxy-terminal hydrolase in gad mice[J]. Nature Genetics, 1999, 23(1): 47-51. DOI:10.1088/0305-4470/28/13/005 (  0) 0) |
| [3] |
CHOI J, LEVEY A I, WEINTRAUB S T, et al. Oxidative modifications and down-regulation of ubiquitin carboxyl-terminal hydrolase L1 associated with idiopathic Parkinson's and Alzheimer's diseases[J]. The Journal of Biological Chemistry, 2004, 279(13): 13256-13264. DOI:10.1074/jbc.M314124200 (  0) 0) |
| [4] |
TRAMUTOLA A, Di DOMENICO F, BARONE E, et al. It is all about (U)biquitin: role of altered ubiquitin-proteasome system and UCHL1 in alzheimer disease[J]. Oxidative Medicine and Cellular Longevity, 2016, 2016: 2756068. DOI:10.1155/2016/2756068 (  0) 0) |
| [5] |
KWON J, MOCHIDA K, WANG Y L, et al. Ubiquitin C-terminal hydrolase L-1 is essential for the early apoptotic wave of germinal cells and for sperm quality control during spermatogenesis[J]. Biology of Reproduction, 2005, 73(1): 29-35. DOI:10.1095/biolreprod.104.037077 (  0) 0) |
| [6] |
GU Yanqiong, CHEN Qiuju, GU Zheng, et al. Ubiquitin carboxyl-terminal hydrolase L1 contributes to the oocyte selective elimination in prepubertal mouse ovaries[J]. Acta Physiologica Sinica, 2009, 61(2): 175-184. (  0) 0) |
| [7] |
MTANGO N R, SUTOVSKY M, VANDEVOORT C A, et al. Essential role of ubiquitin C-terminal hydrolases UCHL1 and UCHL3 in mammalian oocyte maturation[J]. Journal of Cellular Physiology, 2012, 227(5): 2022-2029. DOI:10.1002/jcp.22931 (  0) 0) |
| [8] |
KUANG Zhichao, YAO Yuwei, SHI Yan, et al. Winter hibernation and UCHL1-p34cdc2 association in toad oocyte maturation competence[J]. PloS One, 2013, 8(10): e78785. DOI:10.1371/journal.pone.0078785 (  0) 0) |
| [9] |
YAO Yuwei, SHI Yan, JIA Zahong, et al. PTOV1 is associated with UCH-L1 and in response to estrogen stimuli during the mouse oocyte development[J]. Histochemistry and Cell Biology, 2011, 136(2): 205-215. DOI:10.1007/s00418-011-0825-z (  0) 0) |
| [10] |
KOYANAGI S, HAMASAKI H, SEKIGUCHI S, et al. Effects of ubiquitin C-terminal hydrolase L1 deficiency on mouse ova[J]. Reproduction, 2012, 143(3): 271-279. DOI:10.1530/REP-11-0128 (  0) 0) |
| [11] |
SUSOR A, LISKOVA L, TORALOVA T, et al. Role of ubiquitin C-terminal hydrolase-L1 in antipolyspermy defense of mammalian oocytes[J]. Biology of Reproduction, 2010, 82(6): 1151-1161. DOI:10.1095/biolreprod.109.081547 (  0) 0) |
| [12] |
SEKIGUCHI S, KWON J, YOSHIDA E, et al. Localization of ubiquitin C-terminal hydrolase L1 in mouse ova and its function in the plasma membrane to block polyspermy[J]. The American Journal of Pathology, 2006, 169(5): 1722-1729. DOI:10.2353/ajpath.2006.060301 (  0) 0) |
| [13] |
KWON J, KIKUCHI T, SETSUIE R, et al. Characterization of the testis in congenitally ubiquitin carboxy-terminal hydrolase-1 (Uch-L1) defective (gad) mice[J]. Experimental animals / Japanese Association for Laboratory Animal Science, 2003, 52(1): 1-9. DOI:10.1538/expanim.52.1 (  0) 0) |
| [14] |
SUSOR A, ELLEDEROVA Z, JELINKOVA L, et al. Proteomic analysis of porcine oocytes during in vitro maturation reveals essential role for the ubiquitin C-terminal hydrolase-L1[J]. Reproduction, 2007, 134(4): 559-568. DOI:10.1530/REP-07-0079 (  0) 0) |
| [15] |
ERMISCH B, SCHWECHHEIMER K. Protein gene product (PGP) 9.5 in diagnostic (neuro-) oncology. An immunomorphological study[J]. Clinical Neuropathology, 1995, 14(3): 130-136. (  0) 0) |
| [16] |
HIBI K, WESTRA W H, BORGES M, et al. PGP9.5 as a candidate tumor marker for non-small-cell lung cancer[J]. The American Journal of Pathology, 1999, 155(3): 711-715. DOI:10.1016/S0002-9440(10)65169-3 (  0) 0) |
| [17] |
VUJANIC G M, KELSEY A, PERLMAN E J, et al. Anaplastic sarcoma of the kidney: a clinicopathologic study of 20 cases of a new entity with polyphenotypic features[J]. The American Journal of Surgical Pathology, 2007, 31(10): 1459-1468. DOI:10.1097/PAS.0b013e31804d43a4 (  0) 0) |
| [18] |
LOEFFLER-RAGG J, SKVORTSOV S, SARG B, et al. Gefitinib-responsive EGFR-positive colorectal cancers have different proteome profiles from non-responsive cell lines[J]. European Journal of Cancer, 2005, 41(15): 2338-2346. DOI:10.1016/j.ejca.2005.06.014 (  0) 0) |
| [19] |
YANG Yucong, LI Xu, CHEN Wei. Characterization of genes associated with different phenotypes of human bladder cancer cells[J]. Acta Biochimica et Biophysica Sinica, 2006, 38(9): 602-610. DOI:10.1111/j.1745-7270.2006.00205x (  0) 0) |
| [20] |
CHEN Qian, WATSON J T, MARENGO S R, et al. Gene expression in the LNCaP human prostate cancer progression model: progression associated expression in vitro corresponds to expression changes associated with prostate cancer progression in vivo[J]. Cancer Letters, 2006, 244(2): 274-288. DOI:10.1016/j.canlet.2005.12.027 (  0) 0) |
| [21] |
JIN Chengmeng, YU Wei, LOU Xiaoyan, et al. UCHL1 is a putative tumor suppressor in ovarian cancer cells and contributes to cisplatin resistance[J]. Journal of Cancer, 2013, 4(8): 662-670. DOI:10.7150/jca.6641 (  0) 0) |
| [22] |
BOUDREAUX D A, MAITI T K, DAVIES C W, et al. Ubiquitin vinyl methyl ester binding orients the misaligned active site of the ubiquitin hydrolase UCHL1 into productive conformation[J]. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(20): 9117-9122. DOI:10.1073/pnas.0910870107 (  0) 0) |
| [23] |
LARSEN C N, PRICE J S, WILKINSON K D. Substrate binding and catalysis by ubiquitin C-terminal hydrolases: identification of two active site residues[J]. Biochemistry, 1996, 35(21): 6735-6744. DOI:10.1021/bi960099f (  0) 0) |
| [24] |
LIU Zhihua, MERAY R K, GRAMMATOPOULOS T N, et al. Membrane-associated farnesylated UCH-L1 promotes alpha-synuclein neurotoxicity and is a therapeutic target for Parkinson's disease[J]. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(12): 4635-4640. DOI:10.1073/pnas.0806474106 (  0) 0) |
| [25] |
BISHOP P, RUBIN P, THOMSON A R, et al. The ubiquitin C-terminal hydrolase L1 (UCH-L1) C terminus plays a key role in protein stability, but its farnesylation is not required for membrane association in primary neurons[J]. The Journal of Biological Chemistry, 2014, 289(52): 36140-36149. DOI:10.1074/jbc.M114.557124 (  0) 0) |
| [26] |
DAS C, HOANG Q Q, KREINBRING C A, et al. Structural basis for conformational plasticity of the Parkinson's disease-associated ubiquitin hydrolase UCH-L1[J]. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(12): 4675-4680. DOI:10.1073/pnas.0510403103 (  0) 0) |
| [27] |
KYRATZI E, PAVLAKI M, STEFANIS L. The S18Y polymorphic variant of UCH-L1 confers an antioxidant function to neuronal cells[J]. Human Molecular Genetics, 2008, 17(14): 2160-2171. DOI:10.1093/hmg/ddn115 (  0) 0) |
| [28] |
LIU Y, FALLON L, LASHUEL H A, et al. The UCH-L1 gene encodes two opposing enzymatic activities that affect alpha-synuclein degradation and Parkinson's disease susceptibility[J]. Cell, 2002, 111(2): 209-218. DOI:10.1016/S0092-8674(02)01012-7 (  0) 0) |
 2017, Vol. 15
2017, Vol. 15


