高度进化的脊椎动物具有一种保护性机制,也就是生命信息安全控制机制。这种机制能感受觉察到由于感染、损伤以及细胞应激改变诱导后生成的决定基。本文不妨把这决定基定义为危险因子(因素)内化于生命机体后产生的物质信息。宋德平等[1]曾将该机制归纳形成了一个生命信息安全控制原理图。在该原理图中,起始点是危险因素(因子)。危险因子(因素)不仅成为整个机制的起始,而且归结于整个机制的终点,因此危险因子(因素)处在整个机制权重的地位,整个机制的运行围绕对危险因子(因素),从感知到识别,从识别到调控,特别是基于危险因子(因素)的复杂性与多样性、多层次性与多局面性,甚至于是全方位性,故旨在为着对其有一个较为系统而清晰的理解,很有必要进一步就此命题进行更为深入全面的梳理、解读与分析。
1 生命信息中危险因子(因素)的属性与分类 1.1 生命信息中危险因子(因素)的属性所谓危险因子(因素)属性,一定是与生命相关联的物质,它具有生命信息属性和生命安全属性这样两个属性。所谓生命信息属性,具体而言,它可能是遗传信息物质本身,如DNA、RNA;或者是遗传信息指导下表达的产物,如蛋白质、肽;或者是遗传信息表达产物指导下合成的产物或修饰物,如细菌的肽聚糖、脂多糖、脂蛋白以及糖蛋白等;或者是代谢通路途径环节关键性生物信息分子,如叶酸代谢产物6-甲酰蝶呤(6-formyl pterin,6-FP)、细菌信号分子环二鸟苷酸(c-di-GMP)[2]。所谓生命安全属性,是指具备激发机体生命信息安全控制系统应答的功能。一个物质之所以能激发生命机体信息安全控制系统,使之发生应答,这个物质必定需要具有上述两个属性,而且缺一不可。例如半抗原物质之所以不能唤起机体生命信息安全控制系统的应答,是因为半抗原物质或者缺乏生命信息属性、或者缺乏生命安全属性,即对机体不构成危险。又如通常机体的正常菌群,那一定具有生命信息属性,但通常情况下对宿主不具有危险性(安全属性),所以机体通常对其采取包容(tolerant)的机制。
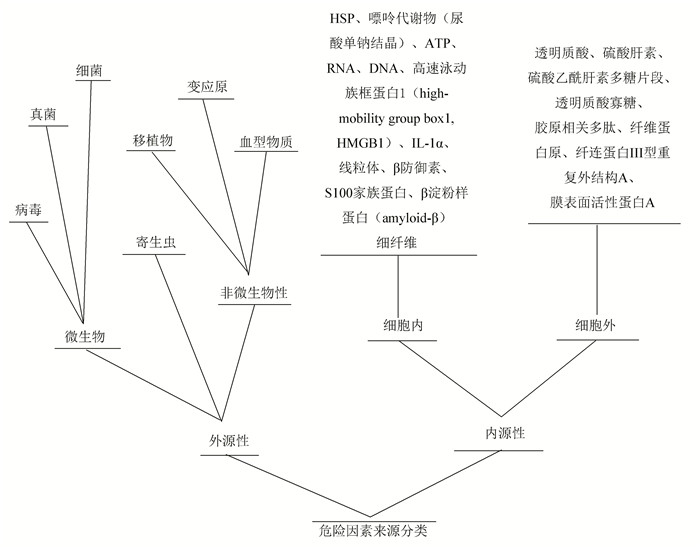
1.2 生命信息中危险因子(因素)的分类危险因子(因素)根据物质来源的不同,分外源性和内源性两种情况。
所谓外源性,是相对机体本身而言的。刚出生的动物机体是无菌状态的,所以以机体刚出生为起点,在这个意义上说,微生物或寄生虫对机体来说一定属于外源性的。然而作为通常的机体存在正常微生物群落,在常规情况下,作为生物因子的性质存在于机体中,当在特定条件下,可能由原来生物因子的身份转化为病原因子,其时就成为危险因子(因素)[3]。在这个特定意义上说,外源性的既有来自机体外部的,也有来自机体内部的。具体而言,外源性的是指病毒、细菌、真菌和寄生虫等。移植物、血型物质以及变应原等也属于外源性的。
内源性的则完全来自机体内部本身组织结构,其中包括HSPs、线粒体、透明质酸寡糖、硫酸乙酰肝素多糖片段、纤维蛋白原、纤连蛋白Ⅲ型重复外结构A、膜表面活性蛋白A、β防御素、高速泳动族框蛋白1/高迁移率蛋白组1(high-mobility group box 1,HMGB1)、S100家族蛋白、肝癌源性生长因子(HDGF)、尿酸(UA)/尿酸结晶、β淀粉样蛋白(amyloid-β)细纤维、ATP、RNA、DNA、IL-1α、IL-33及胶原相关多肽等。
危险信息因素(因子)来源分类汇总如图 1所示。
|
图 1 危险因子(因素)来源分类汇总 Figure 1 The origin summary of risk elements (factors) |
作为危险因子(因素),从机体方面对其识别方式不同存在以下2种情况。
1) 模式识别受体(pattern recognition receptor, PRR)进行识别的情况,所识别的对象有两大类,即病原体相关分子模式(pathogen associated molecule patterns,PAMPs)和损伤相关分子模式(damage associated molecule patterns,DAMPs)。在此将PAMPs和DAMPs统称为危险相关分子模式(danger associated molecular patterns,Danger AMPs)。
PAMPs包括有细菌产物,如LPS、肽聚糖、CpG DNA、含有羧基的甘露糖、脂磷壁酸(LTA)及鞭毛素(flagellin)等;病毒产物,如双链RNA、单链RNA等;真菌产物,如酵母多糖、酵母聚糖等;寄生虫产物,如疟原虫色素、穿孔素样分子等[4]。
DAMPs存在两类情况,或来自细胞结构内部,或来自细胞外部结构。来自细胞结构内部的,可能由坏死细胞或应激细胞所释放,例如一种无前导序列分泌蛋白(leaderless secretory protein,LSP)的形式。其中有:HSP、嘌呤代谢物(尿酸单钠结晶)、HMGB1、S100蛋白等。而来自细胞外部结构的,可能是坏死细胞释放的蛋白酶和水解酶作用下诱导产生的物质。其中包括有胞外基质的解离片段和受损的基质成分,如透明质酸、硫酸肝素等。
2) 由T细胞(包括αβT细胞、γδT细胞)与B细胞(包括B1细胞和B2细胞),还有如NKT细胞识别的,这些被称之为抗原性的物质。抗原的概念来源于[5]:抗原一词最初指能够诱导B细胞产生特异性抗体的分子,抗原一词即来自抗体产生(antibodygenerator)。现在应用范围扩大了,泛指可以被机体防御系统适应性元件(adaptive element),即B细胞和T细胞所特异性识别的任何分子。基于抗原一词最初的意义,在此将需要信息承载分子(如MHC、CD1及MR1等)递呈的抗原物质冠之为抗原样(antigen-like),以示明确与抗原一词最初的意义有所区别。αβT细胞的识别方式需要通过蛋白酶体分析方式或溶酶体分析方式,即由pMHC递呈,以αβT细胞的TCR方式进行识别。B2细胞的识别是由B2细胞的BCR/Ig识别抗原表位(antigenic epitope),又称抗原决定簇(antigenic determinant)的方式。B1细胞则属于具有有限受体组成变化的淋巴细胞亚型。NKT细胞识别的抗原为CD1限制性的。γδT细胞识别的抗原有多种情况[4],比如:① 脂类(磷脂及硫脂类)分子,需要CD1d分子作为递呈分子与之形成复合物;② 不需要递呈分子,直接识别以T22为代表的MHC类蛋白分子;③ 磷酸化非肽类小分子,由嗜乳脂蛋白(BTN3A1) 作为抗原递呈分子与之形成复合物为条件;④ 需要协同刺激信号,以血管内皮细胞蛋白C受体(endothelial cell protein C receptor,EPCR)为代表的应激分子,可能作为脂类抗原的递呈分子。
另外,存在于肠固有层,称之为黏膜相关恒定T细胞(mucosal-associated invariant Tcell,MAIT),为B细胞表达的MR1(MHC-related protein l)限制性,即由MR1为递呈分子,识别的是内源和或外源亲水分子,比如叶酸代谢产物6-甲酰蝶呤(6-formyl pterin,6-FP),而生成6-FP的代谢信号通路似乎只存在于激活MAIT细胞的微生物中[2]。
危险信息因子(因素)识别方式分类汇总如图 2所示。

|
图 2 危险因子(因素)识别方式分类汇总 Figure 2 The classification of recognition mechanism of risk elements (factors) |
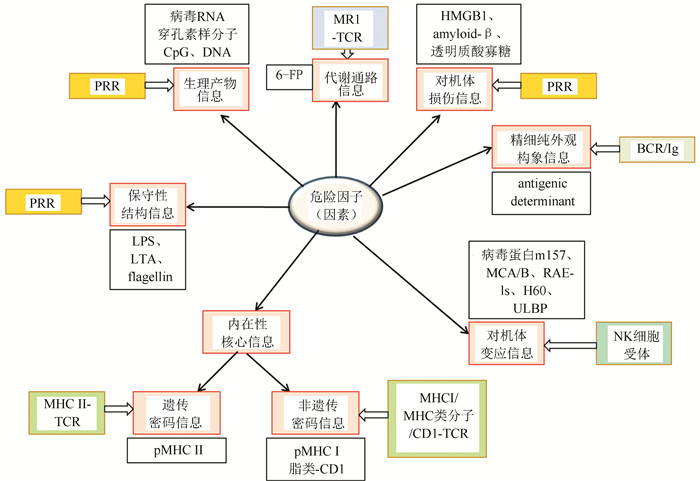
基于上述对危险因子(因素)属性及分类,以及机体对应于危险因子(因素)的识别方式的分析,以此归纳两者生命信息的互动关系,编织形成危险因子(因素)与生命机体机制信息相关互动图(图 3)。这种生命群体的互动效应是生物群体于历史的进程中共进化的结果,在不同的层面与生命机制过程中对弈,形成极其丰富多彩的生命博弈形式,这些形式充斥在生命彼此的全过程之中,所成因的表现印证了自然生成逻辑的理论是无比正确的。机体为了自身的生命安全,几乎全能地从危险因子(因素)所提供的,所能提供的各种层面传递出来的信息,以与之匹配的感受方式察觉来者的蛛丝马迹。
|
图 3 危险因子(因素)与生命机体机制信息相关互动 Figure 3 The interaction chart of risk elements (factors) and mechanism of living organism |
由图 3可见,危险因子(因素)内化于机体,在机体内显示的信息形式以及机体相匹配的对应识别机制归纳分述如下。
2.1 保守性结构信息很多微生物共有的一种分子模式,在进化中趋于保守,形式多样并广泛存在于病原体细胞表面。这种分子模式具有许多不同的、可识别的生物化学特征(如完整的分子、分子的一部分或分子聚合物),比如细菌甘露糖、脂多糖、肽聚糖、脂磷壁酸(LTA)、鞭毛蛋白(flagellin)、胞壁酸等各种细菌的细胞壁成分等[4]。
机体的众多细胞表达有各种相对应的PRR,其中有巨噬细胞、树突状细胞、中性粒细胞、上皮细胞、单核细胞、浆细胞样树突状细胞(pDC)、NK细胞、B细胞及内皮细胞等。这些细胞代表了主流的淋巴细胞。而PRR中识别保守性结构的有代表性的是TLR4识别细菌的脂多糖、RSV的融合蛋白、MMTV的衣壳蛋白;TLR5识别鞭毛蛋白;TLR2及TLR6识别LTA[4]。
2.2 生理产物信息在TLR中TLR3存在于溶酶体内体中能识别病毒dsRNA,TLR7和TLR8在溶酶体内体中能识别病毒ssRNA,而TLR9能识别病毒和细菌的非甲基化CpG DNA。另外,定位于细胞膜的TLR11能识别弓形虫的穿孔素样分子[4]。
TLR3是识别病毒dsRNA的细胞内内体感受器。TLR3不但能识别双链RNA病毒(dsRNA)基因组的RNA,如呼肠弧病毒(reovirus),也可识别单链RNA病毒(ssRNA)或DNA病毒的复制或转录的中间产物dsRNA,如西尼罗河病毒(WNV)、呼吸合胞体病毒(RSV)、脑心肌炎病毒(EMCV)、Semlikis森林病毒(Semliki forest virus)和甲型流感病毒(AIV)[6-9]。
CpG-DNA是以未甲基化的CpG基序为核心的DNA序列,它存在于自然界中细菌、病毒、无脊椎动物等低等生物的基因组DNA中。CpG基序(CpG motifs)是非甲基化的胞嘧啶和鸟嘌呤核苷酸为核心的寡聚脱氧核糖核苷酸,其碱基排列大多遵循以下规律:5’端为2个嘌呤,3’端为2个嘧啶。原核生物细菌DNA含有高频率的CpG双核苷,约为1/16。高等脊椎动物出现CpG双核苷频率为1/50,且多为甲基化。CpG结构与细菌DNA同源性要高于脊椎动物细胞。基于上述原因,非甲基化CpG DNA作为信息分子为高度进化的脊椎动物提供可能是细菌或病毒感染的危险信号,并为TLR9所识别[2]。
RIG-Ⅰ(retinoic acid-inducible gene Ⅰ)是维甲酸诱导基因Ⅰ样受体(RIG-Ⅰ like receptors,RLRs)家族成员。病毒感染时,RIG-Ⅰ能够识别5’端三磷酸化(5’ppp),并且带有双链结构或多聚核苷酸序列一定序列长度的RNA PAMP[10]。5’端带有三磷酸基团的病毒单链RNA(5’ppp base-paired RNA)也能激活RIG-Ⅰ信号通路[11]。dsRNA刺激RIG-Ⅰ活化的关键决定因素是dsRNA的两条链或一条链的5’-端存在游离的三磷酸基团[2]。如上所述,RIG-Ⅰ主要识别5’端带有三磷酸基团的RNA(包括单链和双链RNA)和短的双链RNA,含有5’端三磷酸(5’ppp)尾巴的RNA是被RIG-Ⅰ识别的必须条件[12-13],而宿主细胞RNA的5’端有帽子结构,tRNA和rRNA缺少5’ppp结构[14],由此RIG-Ⅰ能鉴别宿主细胞RNA和外来病毒RNA。
能识别病毒DNA的模式识别受体家族有3类,即DNA依赖的干扰素调节因子活物(DNA depend-ent activator of IFN-regulatory factors,DAI),黑色素瘤缺失因子2(Absent in melanoma 2,Aim2),DNA依赖性RNA聚合酶Ⅲ(DNA-dependent RNA polymer-ase Ⅲ,Pol Ⅲ)。DAI分子能够作为胞浆内的DNA感应器识别外源性的dsDNA,诱导固有免疫反应,在脾脏和淋巴结细胞内优势表达[4]。
2.3 对机体损伤信息机体对于危险因子(因素)造成的损伤,需要一套完整的系统来监测、控制和修复受损的细胞,该系统由危险信号、危险信息感应器和信号通路介导的细胞效应和机体的反应等多个环节构成。机体面临各种因素(如感染或创伤等)导致组织细胞损伤,启动这个过程的危险信号,称为损伤相关分子模式(DAMPs)。
胞外HMGB1是辨认组织损伤的“坏死标记”和初始“组织修复标记”[15]。胞外HMGB1有两个来源,即通过坏死细胞被动释放,或者由受炎症信号(PAMP)刺激的细胞主动分泌,细胞外HMGBl的两种来源恰好提示了感染和创伤诱导炎症反应的共同分子机制[16]。LPS是刺激巨噬细胞主动分泌HMGB1的重要物质,多种前炎症因子如TNFα、IL-1等也可诱导巨噬/单核细胞主动分泌[17]。HMGB1分子缺乏引导肽,是通过分泌性溶酶体分泌,含有HMGB1的分泌性溶酶体与细胞膜融合,当细胞被细胞外三磷酸腺昔和溶血磷脂胆碱活化后,HMGB1即被分泌。HMGB1也能在凋亡后坏死时释放。
胞外HMGB1主要通过两类受体,即晚期糖基化终末产物受体(receptor for advanced glycation end products, RAGE)和TLR2/4/9及其信号通路发挥生物学效应。这样RAGE也被认为是一种PRR[18]。在炎症发生部位炎性细胞和上皮细胞RAGE表达迅速增加。细胞表面RAGE与HMGB1相互作用后,使胞内氧化应激、活性氧簇(ROS)产生增加,继而触发胞内信号级联反应,使丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)等活化,最终导致核转录因子如NF-κB等的活化,调节细胞的基因表达,产生各种生物学效应[19-21]。
2.4 代谢通路信息黏膜相关恒定T细胞是人类固有T细胞(Innate-like T cell)中最丰富的群体,可被结合在MR1(MHC-Ⅰ-like)分子上的抗原激活。MR1所限制的抗原存在于多种细菌和酵母菌中。MR1抗原结合槽的结构与MHC及CD1家族不同,MR1与起源于维生素B代谢物的结合非常配套。在MR1复合物结构中,含有叶酸的代谢物—6-甲酰蝶呤,有蝶呤环隐藏在MR1之中。MR1限制的维生素代谢物6-FP来自细菌生物合成的核黄素(维生素B2),它具有特异的潜在激活MAIT细胞的特性。这样维生素B的代谢物6-FP成为危险因子信息物质,被MR1递呈给MAIT细胞,执行免疫监视功能。许多种维生素只有某些细菌和酵母菌株才能生物合成,MAIT细胞则利用这些代谢物,能够监测微生物可能的侵袭感染[22]。
静息状态下,跨膜蛋白干扰素基因刺激因子(Stimulator of interferon genes,STING)定位在内质网上,且在内质网与线粒体相邻的区域(mitochondria-associated membranes,MAMs)上也有分布。STING能够直接感应环二核苷酸信号分子。这种分子是细菌中一种保守的信号分子,广泛存在于细菌中,是调控细菌浮游状态与定植状态之间转变的第2信使分子。这种信号系统是细菌所特有的,在高等真核生物中却没有被发现。STING起到PRRs作用,通过其CTD结合c-di-GMP,并且是两分子STING结合一分子c-di-GMP。c-di-GMP诱导STING依赖性的Ⅰ型干扰素的表达[23-24]。
2.5 对机体变应信息NK细胞的NKG2D配体具有与MHC Ⅰ分子类似的结构域,与之不同的是不需要β2m,不与多肽结合。其表达被严密控制,通常情况下沉默(silent)不表达,当病毒感染的应激、肿瘤细胞及抗自身疾病等情况下表达。由TLR信号、TNF-α及IFN-α/β也能诱导表达。MIC为热休克蛋白诱导表达。NKG2D配体被认为是“应激诱导性分子”[25]。
人类NKG2D的配体为MIC-A、MIC-B、RL-4和人巨细胞病毒UL16蛋白的结合蛋白(ULBP 1、2、3、4)。MICA和MICB基因与HLA区相连,限制性表达于上皮细胞和血管内皮细胞,ULBP分子表达于较广泛的组织中。小鼠NKG2D的配体为RAE-1(retinoic acid early inducible-1) 家族(α、β、γ、δ、ε5种)、次要MHC分子H60和MU L T-1(murine ULBP-like transcript-1) 分子[25]。
NKG2D的配体在胞内菌或病毒感染的细胞、恶变初期肿瘤细胞中表达上调,成为激活NKG2D识别的危险信号[4]。NKG2D的配体在感染细胞或者遗传毒性的压力下诱导表达,可能与细胞的恶性转化有关,NKG2D作为一种感染细胞的探测器介导清除功能。NKG2D的配体由MIC和ULBP基因编码,这种MHC Ⅰ类相关的压力诱导型的配体一旦与NKG2D结合便激活NK细胞的细胞毒反应和细胞因子分泌。
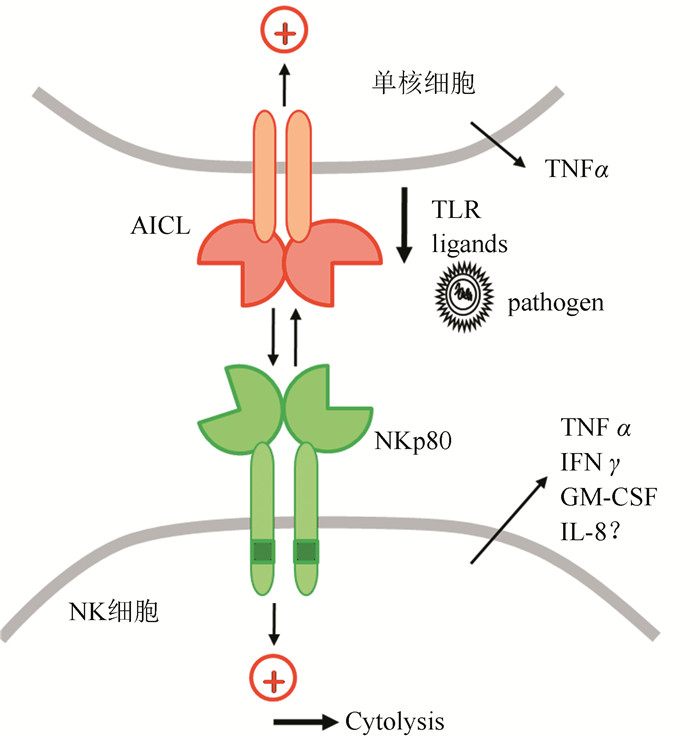
NKp80,也称为杀伤细胞凝集素样受体亚家族F成员1,同NKG2D一样是由NKC所编码的Ⅱ型膜受体。NKp80表达于人的NK细胞以及一部分的CD56+CD3+的细胞亚群。NKp80是目前唯一已知的NKC编码的专一性表达于人NK细胞上的活化性受体,并且,同样为NKC编码的“孤儿”受体,即活化诱导的C型凝集(activation-induced C-type lectin,AICL)被证实为NKp80的配体。AICL作为一种新的骨髓特异性的受体表达于单核细胞,巨噬细胞和粒细胞上。NKp80和AICL同属于Ⅱ型的跨膜糖蛋白和同源二聚体形式的凝集素样受体(CTLD),而编码它们的基因,KLRF1和CLEC2B,则分别为尾对尾形式位于临近CD69基因NKC基因复合物的调聚亚区中的7 kb部分。NKp80表达于几乎所有人NK细胞,而AICL则选择性表达于骨髓来源细胞,如单核细胞和巨噬细胞以及某些非造血来源细胞。在促炎性细胞因子的作用下,NKp80和AICL的结合能够同时促进自体NK细胞和单核细胞的细胞因子的释放。
NKp80和AICL的相互作用可能促使炎症部位的NK细胞以及骨髓细胞的相互活化。NK-p80与AICL的相互作用不仅能够促进NK细胞对骨髓细胞的杀伤作用,而且还对NK细胞和单核细胞的共同活化有着重要的调节作用(图 4)[26]。外来病原体通过TLR诱导AICL的显著上调,上调的AICL配体能与NK细胞上的NKp80受体相互作用,一方面促进NK细胞对感染的单核/巨隨细胞的细胞毒性作用,另一方面又能刺激NK细胞和单核细胞促炎性细胞因子的分泌。
|
图 4 NK细胞和单核细胞间的信息交互作用(Cross-talk)部分依赖于NKp8-AICL的相互作用[26] Figure 4 The cross-talk between NK cell and monocytes partly depends on the interaction of NKp80-AICL |
由图 3可见,精细纯外观构象信息就是指抗原决定簇(antigenic determinant)。B细胞首先是依靠建立受体库(repertoire)的机制解决受体多样性对抗原决定簇多样性适应性识别的困境。在此把它比喻为机体识别保守性结构信息的超级“升级版”。
B细胞多样性受体库(repertoire)形成机制有代表性的以软骨鱼为较早期的阶段表现[5],如鲨鱼免疫球蛋白重链(μ)和轻链(κ、λ样)由许多分散的基因簇(盒)编码,其中有V、D、J、C基因。每一个基因簇(盒)的DNA序列不同,其序列位于胚系基因结构中。其多样性是由胚系基因编码,所以缺乏个体间的免疫球蛋白变异。
到鸡、兔、牛、猪、羊和马发展到一个较高级的阶段,其V、D和J基因片段中很少甚至没有胚系多样性,这些基因片段重排形成最初的B细胞受体基因,重排的V区序列是相似或完全相同的。其多样性是通过基因转换(gene conversion)等方式发生的,即在基因转换中上游的V假基因片段的短序列与表达的重排V区基因进行交换[5]。
到人类,B细胞在骨髓内分化各阶段,表现为免疫球蛋白基因的重排(rearrangement),即重链基因座的VDJ基因片段组合重排以及轻链基因座的VJ基因片段组合重排。重链和轻链基因座有序重排以产生成熟B细胞库(repertoire),该库展现的多样性抗体识别多达5×1013数量级的不同抗原(表位/抗原决定簇)[27]。多样性的增加还要通过体细胞高频突变(somatic hypermutation),并进一步通过抗原受体编辑(receptor editing)和受体修正(receptor revision)来调整与抗原决定簇的亲和性[28]。由于上述机制,BCR/Ig的多样性对于抗原决定簇多样性识别达到无所不能的巅峰,也许这就是生命群体共进化的必然结果。
2.7 内在性核心信息“内在性核心信息”的提法是相对于纯外观构象信息而言的,因为在信息感受之前,还需要经过“信息加工”的程序,而加工的结果是将危险因子的内在性核心信息提供给细胞的感受器加以识别。内在性核心信息又分为遗传密码信息和非遗传密码信息2种情况。因此对信息的识别就对应存在遗传信息密码识别(记忆属性)和非遗传信息密码识别(非记忆属性)。遗传信息密码识别(记忆属性)即为MHC Ⅱ-TCR的溶酶体酶分析方式,非遗传信息密码识别(非记忆属性)即为MHC Ⅰ-TCR的蛋白酶体分析方式[1]。
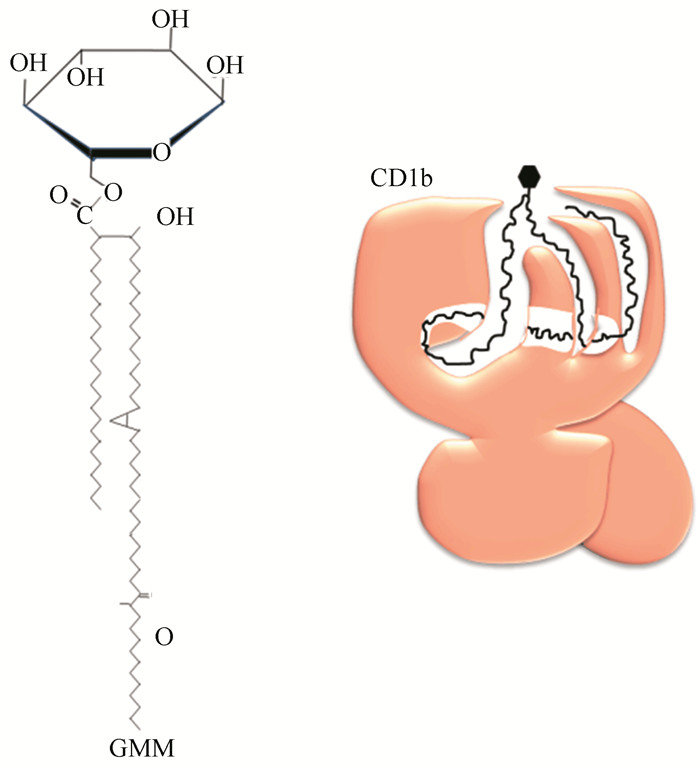
CD1限制性的脂类及肽类等识别,即CD1限制性T细胞识别。CD1呈的脂质抗原(脂肪酸、糖脂、脂肽等),以碳链为主要的疏水部分的大半结构被包埋在CD1的内部,相对亲水性的结构部分,比如糖脂的烃链则显露于外如图 5所示[25]。由此推测,该亲水性部分可能是与TCR相互作用,形成为抗原样表位的主要部分。
CD1分子对脂质抗原递呈程序和方式有其与MHC Ⅱ类分子独特不同的种种表现,MHC Ⅱ类分子递呈的抗原是多肽性质,与CD1分子递呈的脂质抗原比较,虽然显示出多样性,但相对来说较为单纯,而CD1分子递呈的脂质抗原表现出更为多样性,特别是在分子结构方面表现出极其复杂性,因此在递呈方式和具体程序方面与之相适应,显示出多样性和复杂性[25]。
脂类抗原/CD1分子复合物和抗原肽/CD1分子复合物均能递呈给CD1限制性T细胞,其中有CD4-CD8-、CD4+CD8+的TCRαβT细胞和TCRγδT细胞以及NKT细胞。在人和小鼠中,CD1d分子能递呈非常局限的神经酰胺抗原给NKT细胞及其他T细胞亚类[25]。
3 讨论生命的过程充斥活性物质间的信息对话,在免疫学学术认定的抗原,与其认定为抗原,不如以物质化的信息,或信息化的物质的思维进行理解和推论,由此能够不俗为抗原抗体的老式思维模式。从抗原抗体的模式出发,几乎将一切感受器识别的物质都如同抗体识别抗原的模式作类比理解,直到确立病原体相关分子模式(PAMP)和损伤相关分子模式(DAMP)以及模式识别受体(PRR)的概念,才在一定程度上摒弃了单一抗原抗体的思维模式,并与那样的模式认知进行切割。由于使用上的习惯,本文至今还不能从这种概念完全走出来,在表述过程中往往是离不开,而处于概念延展的困境。
本文力图建立一个生命物质信息对话的平台,对过往已有的概念进行审视,可能会更改一些不为“与时俱进”的概念,由此建立合乎自然生成逻辑的科学概念,而摒弃一些主观是非逻辑所推导建立起来的概念,还原生命物质和生命过程的本来生物学位置及性质,有助于合乎客观事理的认知。
在抗原抗体的情况之外,从抗原抗体的模式走出来,在物质信息的层面上理解,建立物质承载信息,信息通过物质的形式传递的思维模式。正因为基于这种思维模式,才能在一个平面上描画出危险因子(因素)与生命机体机制信息相关互动图。有了这个互动图,本文几乎可以一目了然地更为清晰而整体性理解生命信息安全控制机制的核心部分,即教科书上描绘的免疫学机制原理。而在教科书上,那些生命过程是极其分散地分别章节讲述,几乎处于一种概念彼此割裂的状态,而缺乏一元化的思考,以至于几乎只能令人获得一些“碎片性”“零碎”的认知。本文互动图所囊括的7个方面,揭示了危险因子(因素)所展现的主要表现形式,并交待了其中的本质内容和互动关系的性质。特别是物质性的信息,或信息性的物质成为本文认知的强有力抓手,可以令人透视其中的原委和特征。这点也许能在教学过程中化难为易、化繁为简、化碎(散)为整。
| [1] |
宋德平, 谌南辉. 生命信息安全控制原理的再探讨[J]. 生物信息学, 2016, 14(1): 49–55.
SONG Deping, CHEN Nanhui. Re-discussion on the life information security control theory[J]. Chinese Journal of Bioinformatics, 2016, 14(1): 49–55. DOI:10.3969/j.issn.1672-5565.2016.01.09(  0) 0)
|
| [2] |
陶志云, 施祖灏, 朱春红, 等. 病原体相关分子模式与免疫识别受体研究进展[J]. 中国免疫学杂志, 2014, 30(5): 694–699.
TAO Zhiyun, SHI Zuhao, ZHU Chunhong, et al. Research progress on pathogen-associated molecular patterns and pattern-recognition receptors[J]. Chinese Immunology Journal, 2014, 30(5): 694–699. DOI:10.3969/j.issn.1000-484X.2014.05.029(  0) 0)
|
| [3] |
谌南辉. 病原学机制原理初析[J]. 江西农业大学学报, 2015, 37(6): 1052–1056.
CHEN Nanhui. A study on etiology mechanism principle[J]. Acta Agriculturae Universitatis Jiangxiensis, 2015, 37(6): 1052–1056. DOI:10.13836/j.jjau.2015160(  0) 0)
|
| [4] |
曹雪涛. 免疫学前沿进展[M]. 第3版. 北京: 人民卫生出版社, 2014.
CAO Xuetao. Advances in immunology[M]. 3rd ed. Beijing: People's Health Publishing House, 2014. (  0) 0)
|
| [5] |
ROITT I, BROSTOFF J, MALE D. 免疫学[M]. 第6版. 周光炎, 译. 北京: 人民卫生出版社, 2002.
ROITT I, BROSTOFF J, MALE D. IMMUNOLOGY[M].6th ed.ZHOU Guangyan.Beijing: People's Publishing House, 2002.
( 0) 0)
|
| [6] |
ALEXOPOULOU L, HOLT A C, MEDZHITOV R, et al. Recognition of double-stranded RNA and activation of NF-kappa B by Toll-like receptor 3[J]. Nature, 2001, 413(6857): 732–738.
DOI:10.1038/35099560( 0) 0)
|
| [7] |
RUDD B D, SMIT J J, FLAVELL R A, et al. Deletion of TLR3 alters the pulmonary immune environment and mucus production during respiratory syncytial virus infection[J]. Journal of Immunology, 2006, 176(3): 1937–1942.
DOI:10.4049/jimmunol.176.3.1937( 0) 0)
|
| [8] |
WANG T, TOWN T, ALEXOPOULOU L, et al. Toll-like receptor 3 mediates West Nile virus entry into the brain causing lethal encephalitis[J]. Nature Medicine, 2004, 10(12): 1366–1373.
DOI:10.1038/nm1140( 0) 0)
|
| [9] |
Le GOFFIC R, BALLOY V, LAGRANDERIE M, et al. Detrimental contribution of the Toll-like receptor(TLR)3 to influenza A virus-induced acute pneumonia[J]. PLoS Pathog, 2006, 2(6): e53.
DOI:10.1371/journal.ppat.0020053( 0) 0)
|
| [10] |
RAMANATHAN A, JIANG Fuguo, MILLER M T, et al. Structural basis of RNA recognition and activation by innate immune receptor RIG-Ⅰ[J]. Biophysical Journal, 2012, 102(3): 601a.
DOI:10.1016/j.bpj.2011.11.3273( 0) 0)
|
| [11] |
HORNUNG V, ELLEGAST J, KIM S, et al. 5'-Triphosphate RNA is the ligand for RIG-Ⅰ[J]. Science, 2006, 314(5801): 994–997.
DOI:10.1126/science.1132505( 0) 0)
|
| [12] |
BAEK Y M, YOON S, HWANG Y E, et al. Dependence of RIG-Ⅰ nucleic acid-binding and ATP hydrolysis on activation of type Ⅰ interferon response[J]. Immuene Network, 2016, 16(4): 249–255.
DOI:10.4110/in.2016.16.4.249( 0) 0)
|
| [13] |
PICHLMAIR A, SCHULZ O, TAN C P, et al. RIG-Ⅰ-mediatedantiviral responses to single-stranded RNA bearing 5'-phosphates[J]. Science, 2006, 314(5801): 997–1001.
DOI:10.1126/science.1132998( 0) 0)
|
| [14] |
丁云磊, 孙英杰, 王晓旭, 等. RIG-Ⅰ样受体信号通路及其调控研究进展[J]. 中国动物传染病学报, 2014, 22(5): 72–79.
DING Yunlei, SUN Yingjie, WANG Xiaoxu, et al. Advances in signaling pathways and regulation of RIG-Ⅰ-like receptor[J]. Chinese Journal of Animal Infectious Diseases, 2014, 22(5): 72–79. DOI:10.3969/j.issn.1674-6422.2014.05.012(  0) 0)
|
| [15] |
虞莹. 高迁移率族蛋白1在炎症和心血管疾病中的作用[J]. 中国分子心脏病学杂志, 2010, 10(4): 245–248.
YU Ying. The role of high mobility group box 1 protein in inflammation and cardiovascular disease[J]. Molecular Cardiology of China, 2010, 10(4): 245–248. (  0) 0)
|
| [16] |
栾正刚. 损伤相关分子模式与炎症反应[J]. 中国危重病急救医学, 2009, 21(9): 566–569.
LUAN Zhenggang. Lession-associated molecular patterns and inflammatory reaction[J]. Chinese Critical Care Medicine, 2009, 21(9): 566–569. DOI:10.3760/cma.j.issn.1003-0603.2009.09.018(  0) 0)
|
| [17] |
赵中夫, 韩德五. 高迁移率族蛋白B-1及其在肝损伤合并内毒素血症中的作用[J]. 中华肝脏病杂志, 2006, 14(9): 718–720.
ZHAO Zhongfu, HAN Dewu. High mobility group box 1 protein and its effect on liver injury complicated with endotoxemia[J]. Chinese Journal of Hepatopathy, 2006, 14(9): 718–720. DOI:10.3760/j.issn:1007-3418.2006.09.029(  0) 0)
|
| [18] |
TANG Daolin, KANG Rui, ZEH H J Ⅲ, et al. High-mobility group box 1 and cancer[J]. Biochimica Biophysica Acta(BBA)-Gene Regulatory Mechanisms, 2010, 1799(1/2): 131–140.
DOI:10.1016/j.bbagrm.2009.11.014( 0) 0)
|
| [19] |
WAUTIER M P, CHAPPEY O, CORDA S, et al. Activation of NADPH oxidase by AGE links oxidant stress to altered gene expression via RAGE[J]. Am J Physiol Endocrinol Metab, 2001, 280(5): E685–E694.
DOI:10.1152/ajpendo.00566.2001( 0) 0)
|
| [20] |
TAGUCHI A, BLOOD D C, Del TORO G, et al. Blockade of RAGE-amphoterin signalling suppresses tumour growth and metastases[J]. Nature, 2000, 405(6784): 354–360.
DOI:10.1038/35012626( 0) 0)
|
| [21] |
BIERHAUS A, SCHIEKOFER S, SCHWANINGER M, et al. Diabetes-associated sustained activation of the transcription factor nuclear factor-kappa B[J]. Diabetes, 2001, 50(12): 2792–2808.
DOI:10.2337/diabetes.50.12.2792( 0) 0)
|
| [22] |
KJER-NIELSEN L, PATEL O, CORBETT A J, et al. MR1 presents microbial vitamin B metabolites to MAIT cells[J]. Nature, 2012, 491(7426): 717–723.
DOI:10.1038/nature11605( 0) 0)
|
| [23] |
SHANG Guijun, ZHU Deyu, LI Ning, et al. Crystal structures of STING protein reveal basis for recognition of cyclic di-GMP[J]. Nature Structural Molecular Biology, 2012, 19(7): 725–727.
DOI:10.1038/nsmb.2332( 0) 0)
|
| [24] |
郑洋, 邢雅玲, 陈晓娟, 等. STING在宿主天然免疫信号通路中的调节作用[J]. 生物化学与生物物理进展, 2013, 40(1): 5–14.
ZHENG Yang, XING Yaling, CHEN Xiaojuan, et al. Regulating of innate immunity signaling by STING, a stimulator of interferon genes[J]. Progess in Biochemistry and Biophysics, 2013, 40(1): 5–14. DOI:10.3724/SP.J.1206.2012.00099(  0) 0)
|
| [25] |
谷口維紹, 山本一彦. 免疫応答と免疫病態の統合的分子理解[M]. 東京: 南山堂, 2007.
TANIKUTI, YAMAMOTO. Immune response and immune pathological comprehensive molecular understanding[M]. Tokyoto: Minamiyamato, 2007. (  0) 0)
|
| [26] |
邓刚. NK细胞活化性受体NKp80的融合表达和功能研究[D]. 合肥: 中国科学技术大学, 2015.
DENG Gang. Fusion expression and functional investigation of NK cell activating receptor NKp80[D]. Hefei: University of Science and Technology of China, 2015.
( 0) 0)
|
| [27] |
塔克·马克, 玛丽·桑德斯. 免疫应答导论[M]. 吴玉章, 译. 北京: 科学出版社, 2012.
MAK T W, SAUNDES M E. Primer to the immune response (Chinese edition)[M]. Wu Yuzhang.Beijing: Science Press, 2012.
( 0) 0)
|
| [28] |
曹雪涛. 免疫学前沿进展[M]. 第2版. 北京: 人民卫生出版社, 2011.
CAO Xuetao. Advances in immunology[M]. 2nd ed. Beijing: People's Health Publishing House, 2011. (  0) 0)
|
 2017, Vol. 15
2017, Vol. 15