胰腺癌是常见的恶性肿瘤之一,它的发生占所有癌症发生率的2.2%[1],在癌症所引发的死亡中位居第四。因为早期临床表现的缺乏、肿瘤的侵袭性增长以及肿瘤早期扩散等原因,大多数患者在被诊断出胰腺癌时已经处于晚期阶段,所以无法进行手术根治。此外,该肿瘤对放疗和化疗药物也存在较大的抵抗力,在众多实质性恶性肿瘤中5年生存率也较低。
目前胰腺癌的诊断主要依靠一些非特异性肿瘤标志物。但是由于它们的非特异性导致患者不能够被及时早期的诊断而使疾病进展到了晚期,大大降低了患者的生存率。因此发现一种新的胰腺癌肿瘤标志物至关重要。近几年,随着分子生物学的迅猛发展,众多研究表明microRNA与肿瘤的发生、发展及预后密切相关[2]。
MicroRNA (miRNA)是一类长度约为22个核苷酸的非编码小单链RNA分子,通过与靶mRNA的3’非翻译区结合调节转录后基因的表达水平,降解或抑制mRNA的表达[3]。很多microRNA都有重要意义, 已有研究证明miR-21在血液系统和实质器官恶性肿瘤的发生、发展中起着至关重要的作用。
许多研究发现与胰腺癌预后有关的一个重要因素为miR-21的高表达,但研究结果存在显著差异[4-9]。这些研究结果的差异主要在于miR-21究竟对胰腺癌预后是有益还是有害,我们此次研究的目的就是通过全面检索已公开发表的miR-21与胰腺癌相关性的所有文献,进行筛查,采用meta分析的方法对符合此次研究目的的文献进行全面综合分析,最终得出miR-21的高表达与胰腺癌预后间的相关性。
1 材料与方法 1.1 研究材料查找公开发表的文献,同时还要查找咨询已获取可靠研究数据的但尚未发表的论文。
1.2 文献入选标准拟纳入本研究的文章主题是关于miR-21与胰腺癌预后关系的分析研究,并且给出了确定的研究结果,同时从该文章中可以获取准确的效应量。
1.3 文献剔除标准拟纳入研究必须以论著的形式发表,不能包括综述或其它研究形式;若从该研究中无法获得本研究进行meta分析所需要的效应量则都要被排除;若同一研究重复发表,则只纳入近期发表的和结果最完整的研究。
1.4 检索文献方法公开检索国内外所有数据库里的关于miR-21与胰腺癌相关性的所有文章。检索工作由两名研究者独立完成,采用中文和英文两种语种检索胰腺癌(Pancreatic cancer)、miR-21(miR-21)、预后(Prognosis)这三个关键词,并辅以参考文献回溯、手工检索等方法进行,任何分歧最终都要达成一致。
1.5 系统评价系统质量评价主要包括以下几个方面:确定研究主题,制定纳入和排除标准,提取研究资料,对已纳入研究进行质量评价,对效应量进行数据合并,下结论以及对此次meta分析反复性检查和改进。评价者会根据QQAQ量表对系统评价的真实性进行分析,最终评价结果为1~7分的评分。
1.6 数据提取方法根据事先选好的主题,通过已定立的纳入和排除文献的标准初步筛选出的有关miR-21与胰腺癌间关系的所有文章,再通过阅读文章的摘要和全文进一步筛选出有关miR-21与胰腺癌预后关系的文章,接下来便探究能否从该文章中获得我们进行预后分析所需要的效应量。若所选文章符合以上全部内容,则需从该文章中提取以下信息见表 1。
| 表 1 符合本研究纳入标准的文献信息 Table 1 The basic information of includedresearches |
使用meta分析的方法定量汇总各个独立研究的数据结果并绘制漏斗图(发表偏倚)和森林图(异质性)。miR-21的高表达与胰腺癌预后的相关性使用HR及95%CI两个指标来评价。各研究间的异质性用Q检验和I2检验来探究(I2=0%时表明各个研究是同质的;I2>50%表明各研究间存在异质性,采用随机效应模型进行数据合并;I2 < 30%表明可认为各个研究是同质的)。
2 结果 2.1 文献检索结果通过上文所述的检索文献的方法,初步得到了符合研究标准的文献共205篇。接下来通过阅读标题和摘要,并且要符合质量评价的原则及文献选择的特点,排除了100篇研究内容不相关文献;通过全文阅读的方法筛查余下的105篇文献进一步排除56篇,剩余的文献由于无法获得统计量而排除45篇,最后,纳入4篇文献(共300个病例)。具体筛选流程见图 1。
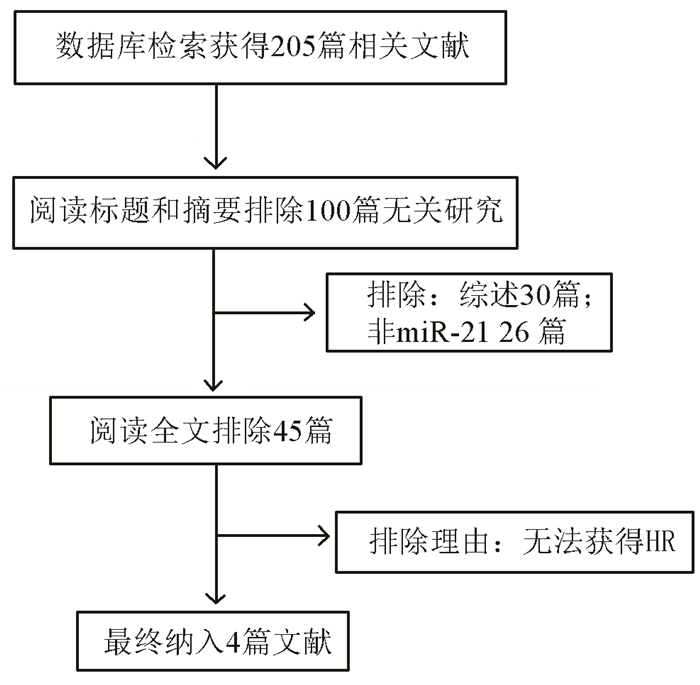
|
图 1 文献检索过程的流程图 Figure 1 The flow chart of the process of literature retrieval |
对纳入的研究进行Meta分析应使用STATA V12.0统计软件,据上文所介绍的异质性检验结果分析,不难从图 2中得到I2=81.9,表明各文献之间存在异质性,应选用随机效应模型进行各个数据的合并得出HR=1.26。统计学中规定风险比HR如果大于1则说明暴露使疾病的危险性增加,即本次研究结果HR=1.26表明miR-21使患胰腺癌的危险性增加。漏斗图(见图 3)可以反应纳入文献的发表偏倚。由于纳入文献数量较少和研究对象具有不同的种族背景使该漏斗图呈现出不完全对称性,即纳入研究之间存在发表偏倚。

|
图 2 miR-21的高表达与胰腺癌预后关系的meta分析(森林图) Figure 2 miR-21 high expression of meta analysis of the realationship with the prognosis of pancreatic cancer (forest) |
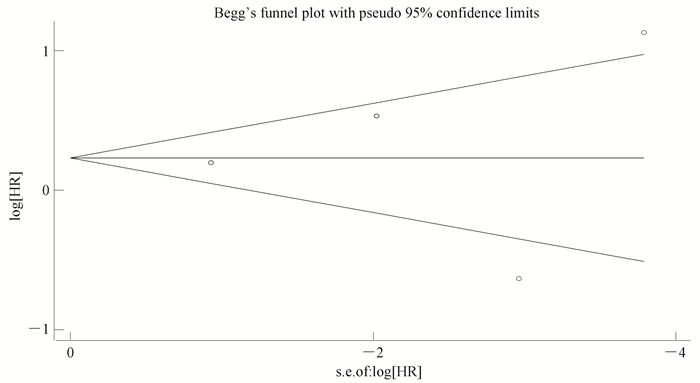
|
图 3 miR-21的高表达与胰腺癌预后关系的meta分析(漏斗图) Figure 3 miR-21 high expression of meta analysis of the relationship with the prognosis of pancreatic cancer (funnel) |
临床上诊断胰腺癌的方法有很多,包括血清学肿瘤标志物检查,放射性检查,和病理学检查等。这些检查方法对胰腺癌的诊断和肿块定位有很大帮助。尽管如此,但不难看出这些检查方法本身都有一定的缺陷,例如特异性差、灵敏度低、损伤性强等。但以上这些都不是最大的缺陷,最大的缺陷是在于这些检查方法的及时性差,它们都不能在疾病发生的早期做出及时诊断,导致了患者一旦被确诊就处于疾病的晚期阶段,此时就算用放化疗的方法或是对肿瘤进行切除都无法挽救患者的生命,而且对于患者的预后也无法进行及时有效的评价。因此,寻找出一种能够在早期便对肿瘤的发生做出诊断,术后及时监测患者的预后以及复发情况的便于操作的,创伤性小的检测方法至关重要。
miR-21的检测是一种新型的生物学标志物[11]检测方法,它可以对胰腺癌进行早期诊断,指导治疗及预后检测本研究经过一系列研究工作获得符合研究要求的文献共4篇(300个病例),对该4篇文献进行预后分析,最终得出结论miR-21的高表达是胰腺癌预后的一个危险因素。
| [1] |
SUN T, KONG X Y, DU Y Q, et al. Aberrant microRNAs in pancreatic cancer researches and clinical implications[J]. Gastroenterol Research Practice, 2014(14): 1–7.
DOI:10.1155/2014/386561 ( 0) 0)
|
| [2] |
YADAV D, LOWENFELS A B. The epidemiology of pancreatitis and pancreati cancer[J]. Gastroenterology, 2013(144): 1252–1261.
DOI:10.1053/j.gastro.2013.01.068 ( 0) 0)
|
| [3] |
WU Y, FU X, ZHU X, et al. Prognostic role of systemic inflammatory response in renal cell carcinoma: a systematic review and meta-analysis[J]. Journal of Cancer Research and Clinical Oncology, 2011(137): 887–896.
DOI:10.1007/s00432-010-0951-3 ( 0) 0)
|
| [4] |
WANG J, PARIS P L, CHEN J, et al. Next generation sequencing of pancreatic cyst fluid microRNAs from low grade-benign and high grade-invasive lesions[J]. Cancer Letters, 2015, 356(2): 404–409.
DOI:10.1016/j.canlet.2014.09.029 ( 0) 0)
|
| [5] |
Clark C E, Taylor R S, Shore AC, et al. Association of a difference in systolic blood pressure between arms with vascular disease and mortality: a systematic review and meta-analysis[J]. Lancet, 2012(379): 905–914.
DOI:10.1016/s0140-6736(11)61710-8 ( 0) 0)
|
| [6] |
ELISA G, NICCOLA F, GODEFRIDUS J P, et al. MicroRNA-21 in pancreatic cancer: correlation with clinical outcome and pharmacologic aspects underlying its role in the modulation of gemcitabine activity[J]. Cancer Research, 2010, 70(11): 4528–4538.
DOI:10.1158/0008-5472.CAN-09-4467 ( 0) 0)
|
| [7] |
XUE Y, ABOU A N, ABO K M, et al. MicroRNAs as diagnostic markersfor pancreatic ductal adenocarcinoma and its precursor, pancreatic intraepithelialneoplasm[J]. Cancer Genetics, 2013, 206(6): 217–221.
DOI:10.1016/j.cancergen.2013.05.020 ( 0) 0)
|
| [8] |
MARIN-MULLER C, LI D, BHARADWAJ U, et al. A tumorigenic factor interactome connected through tumor suppressor microRNA-198 in human pancreatic cancer[J]. Clinical Cancer Research, 2013, 19(21): 5901–5913.
DOI:10.1158/1078-0432.CCR-12-3776 ( 0) 0)
|
| [9] |
MARY D, JAMES L, WENDY F, et al. MicroRNA-21 is overexpressed in pancreatic cancer and a potential predictor of survival[J]. Journal of Gastrointestinal Surgery, 2008(12): 2171–2176.
DOI:10.1007/s11605-008-0584-x ( 0) 0)
|
| [10] |
PETRA V-F, LGOR K, SONA K, et al. miR-21, miR-34a, mi-R198 and miR-217 as diagnostic and prognostic biomarkers for chronic pancreatitis and pancreatic ductal adenocarcinoma[J]. Diagnostic Pathology, 2015, 10(1): 1–5.
DOI:10.1186/s13000-015-0272-6 ( 0) 0)
|
| [11] |
WANG Peng, ZHUANG Liping, ZHANG Juan, et al. The serum miR-21 level serves as a predictor for the chemosensitivity of advanced pancreatic cancer, and miR-21 expression confers chemoresistance by targeting FasL[J]. Molecular Oncology, 2012, 7(3): 334–335.
DOI:10.1016/j.molonc.2012.10.011 ( 0) 0)
|
| [12] |
BLOOMSTON M, FRANKEL W L, PETROCCA F, et al. MicroRNA expression patterns to differentiate pancreatic adenocarcinoma from normal pancreas and chronic pancreatitis[J]. JAMA The Journal of the American Medical Association, 2007, 297(17): 1901–1908.
DOI:10.1001/jama.297.17.1901 ( 0) 0)
|
 2016, Vol. 14
2016, Vol. 14


