高等植物中类胡萝卜素的合成途径理论已经成熟,牻牛儿基牻牛儿基焦磷酸(GGPP)是类胡萝卜素最直接的前体物质[1]。GGPS催化3,3-二甲烯丙基焦磷酸(DMAPP)与异戊烯基焦磷酸(IPP)合成GGPP,两个GGPP分子通过八氢番茄红素合成酶缩合形成八氢番茄红素。GGPS基因最早从辣椒[2]中分离得出,之后又在番茄[3]、丹参[4]、烟草[5]、银杏[6]等植物中分离得到。
近年来,GGPS基因在功能研究上取得了一些进展。在一些植物中发现GGPS对类胡萝卜素的合成积累具有极为重要的作用[3, 7]。但在啤酒酵母中GGPS基因过表达,会导致β-胡萝卜素含量显著增加[8]。在法夫酵母和卷枝毛霉中,GGPS过表达也能显著提高类胡萝卜素产量[9-10]。在cDNA文库中,通过使用该酶抗体完成筛选,从而得到GGPScDNA[11]。另外研究还发现,GGPS对于调节碳流还有着重要的作用[12]。在植物体中,GGPS经常是多基因家族化合物。其表达的蛋白质存在于不同的亚细胞结构中[13]。本课题共选择了以下9种不同科且已知GGPS基因序列的物种:银杏(银杏科)、烟草(茄科)、长春花(夹竹桃科)、丹参(唇形科)、蔷薇(蔷薇科)、万寿菊(菊科)、甘薯(薯蓣科)、茉莉(木犀科)、加拿大红豆杉(红豆杉科)。对GGPS的理化性质、核酸序列、蛋白质结构功能等进行详细的分析,研究其进化关系,进而更深层次的了解GGPS的性质,为该基因对植物的生长调控所产生的影响提供更可靠的理论依据。
1 材料与方法 1.1 实验材料本实验数据来源于NCBI核酸和蛋白质数据库中已经注册的GGPS核酸及相应的氨基酸序列,包括银杏(Ginkgobiloba ,AAQ72786.1)、万寿菊(Tageteserecta,AAG10424.1)、甘薯(Ipomoea batatas,ACF37217.1)、茉莉(Jasminum sambac,AIY24421.1)、加拿大红豆杉(Taxus canadensis,AAD16018.1)、烟草(Nicotiana tabacum,ADD49734.1)、长春花(Catharanthus roseus,AGL91648.1)、丹参(Salvia miltiorrhiza,ACR19637.1)、蔷薇(Cistus creticus,AAM21639.1)、甜菊(Stevia rebaudiana,ABD92926.2)、蓖麻(Ricinus communis,XP_002531191.1)、麻疯树(Jatropha curcas,ADD82422.1)、橡胶树(Hevea brasiliensis,BAF98302.1)。
1.2 方法GGPS氨基酸序列的理化性质的分析使用Expasy软件中的ProtParam在线工具;ORF的预测分析使用NCBI数据库中ORF查询工具;使用SignalP 4.1在线工具分析GGPS是否含有信号肽;通过NetPhos 2.0 和NetNGlyc 1.0在线工具分析糖基化和磷酸化位点;通过NCBI数据库中的CDD工具对GGPS的保守结构域进行预测分析;通过SOPMA软件可以预测GGPS二级结构,通过SWISS-MODEL在线分析其三级结构;通过Clustal X采用渐进比较算法进行多序列比对[14];通过MEGA建树工具构建进化树。
2 结果和分析 2.1 GGPS氨基酸序列理化性质分析使用在线分析软件ProtParam分析9种植物GGPS氨基酸序列的理化性质(见表 1)。
| 表 1 GGPS的氨基酸组成及理化性质分析 Table 1 Physical and chemical characteristics of GGPS amino acid in different plants |
由表可知,所选植物GGPS序列在氨基酸数目、预测分子量、Ip都表现出一致性,他们的基因序列全长在1 000 bp到2 000 bp之间;氨基酸数目除银杏和加拿大红豆杉在390左右外,其余的在365左右;Ip值除甘薯6.84以外,其余均小于6,不稳定指数40左右,脂肪指数在94左右;Ala、Leu、Glu、Lys、Gly是所选植物GGPS序列中含量最为丰富的氨基酸,而Pyl和Sec为所选植物中都不存在的氨基酸。
2.2 GGPS核酸序列ORF分析通过ORF Finder在线软件分析9种植物GGPS核酸序列的开放阅读框(见表 2)。
| 表 2 不同植物GGPS核酸序列ORF分析 Table 2 Nucleic acid sequence analysis of GGPS ORF in different plants |
在线分析软件ORF Finder提供了六组参考数据,包含了不同阅读顺序可能出现的情况。由于GGPS氨基酸序列长度已经知道,所以每一个ORF基本都对应着相应编码蛋白质的大小,结果显示除了丹参以外其余植物GGPS的开放阅读框大小均在1 100 bp左右,而丹参可能由于蛋白编辑剪切不同,所以稍有差异。从这些也可以看出,GGPS序列存在一定的保守性。
2.3 蛋白质信号肽的预测分析使用SignalP 4.1 Server在线工具以银杏为研究对象对所选GGPS未知氨基酸序列中包含的信号肽进行分析(见图 1)。
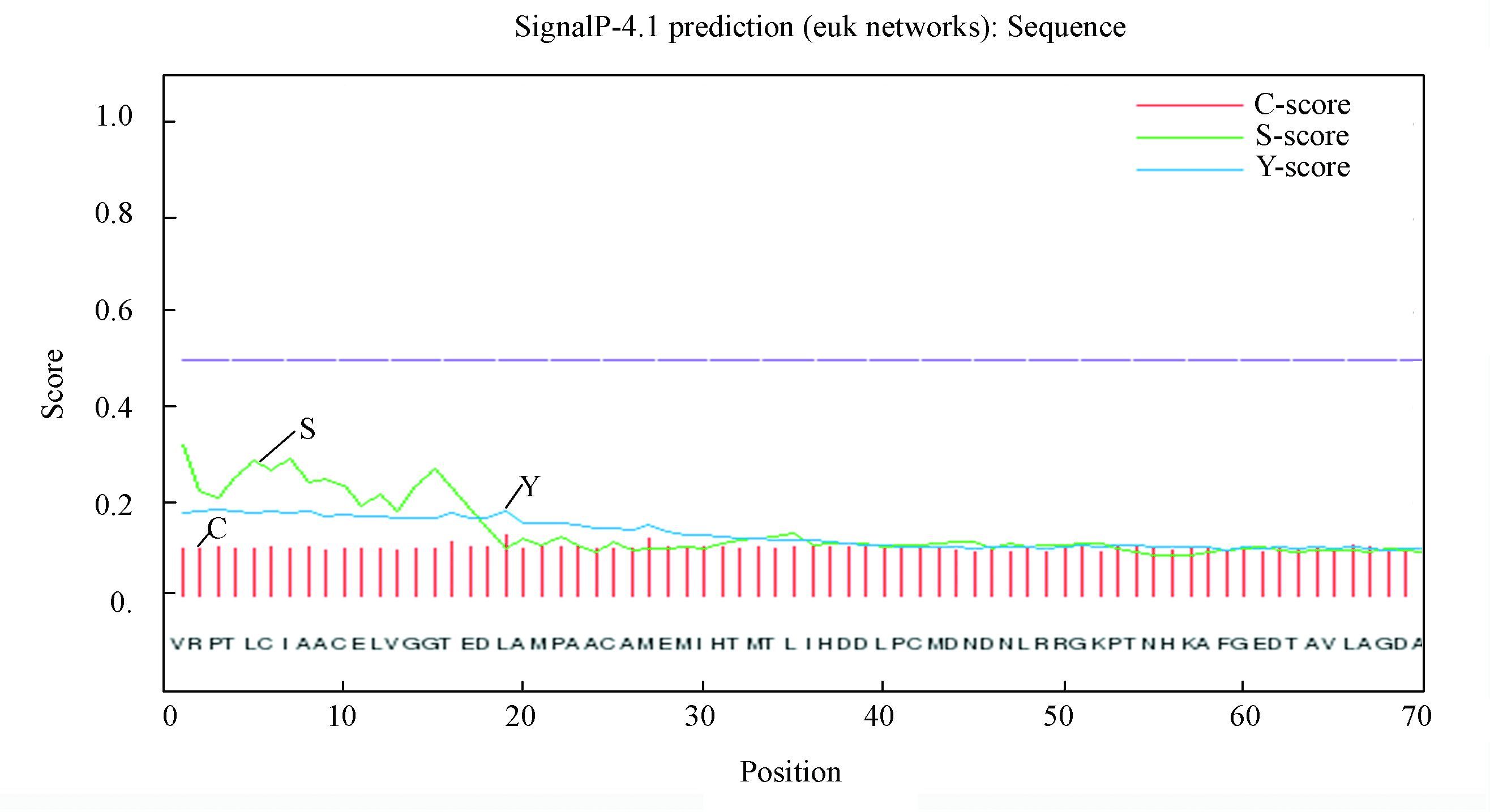
|
图 1 银杏GGPS的信号肽分析结果 Figure 1 Signal peptide analysis result of Ginkgo GGPS |
结果表明,银杏的GGPS蛋白序列都不存在信号肽。且由图可以看出,S值和Y值均比较低,因此可以推测以上植物的GGPS蛋白通过核糖体合成之后,生成的蛋白质属于非分泌蛋白。通过对另外8种植物分析可得到相近的结果。
2.4 糖基化和磷酸化位点分析使用NetNGlyc 1.0以万寿菊为例对所选GGPS序列的糖基化位点进行分析(见图 2)。
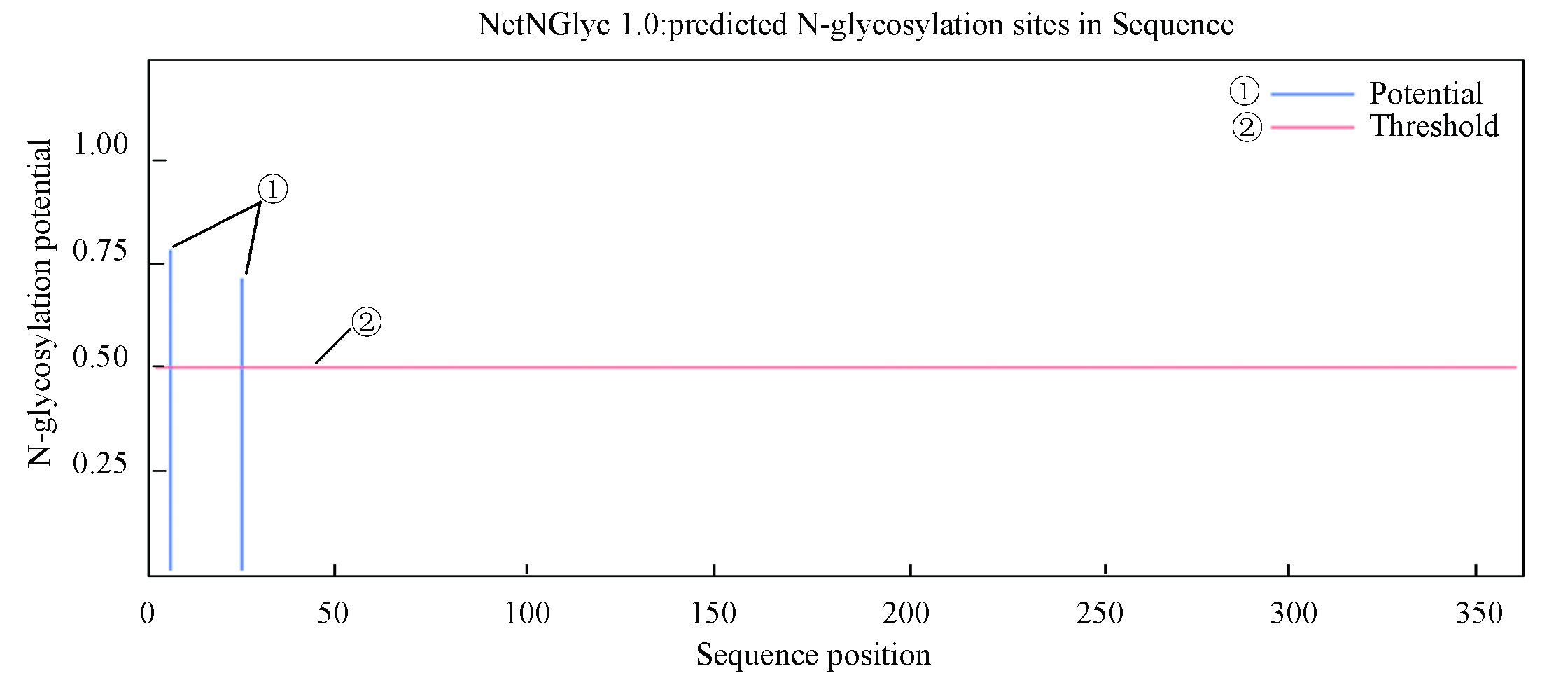
|
图 2 万寿菊GGPS氨基酸序列的糖基化分析 Figure 2 Glycosylation prediction of ginkgo GGPS amino acid sequence |
如图所示,红色横线(Threshold)表示阈值,阈值设定为0.5,大于阈值的蓝色竖线(Potential)表示此点有被糖基化的可能。万寿菊GGPS氨基酸序列糖基化分析结果显示,在5和24位点的天冬酰胺处存在蓝色竖线,值分别为0.782 8和0.715 6,因此这两处可能被糖基化。对其他植物GGPS氨基酸序列的糖基化预测分析得出,除银杏、茉莉和红豆杉没有糖基化位点外,其余植物GGPS蛋白均存在不同程度的糖基化。
使用NetPhos 2.0在线工具以银杏为研究对象分别预测了丝氨酸、苏氨酸、酪氨酸3种不同的磷酸化位点(见图 3)。
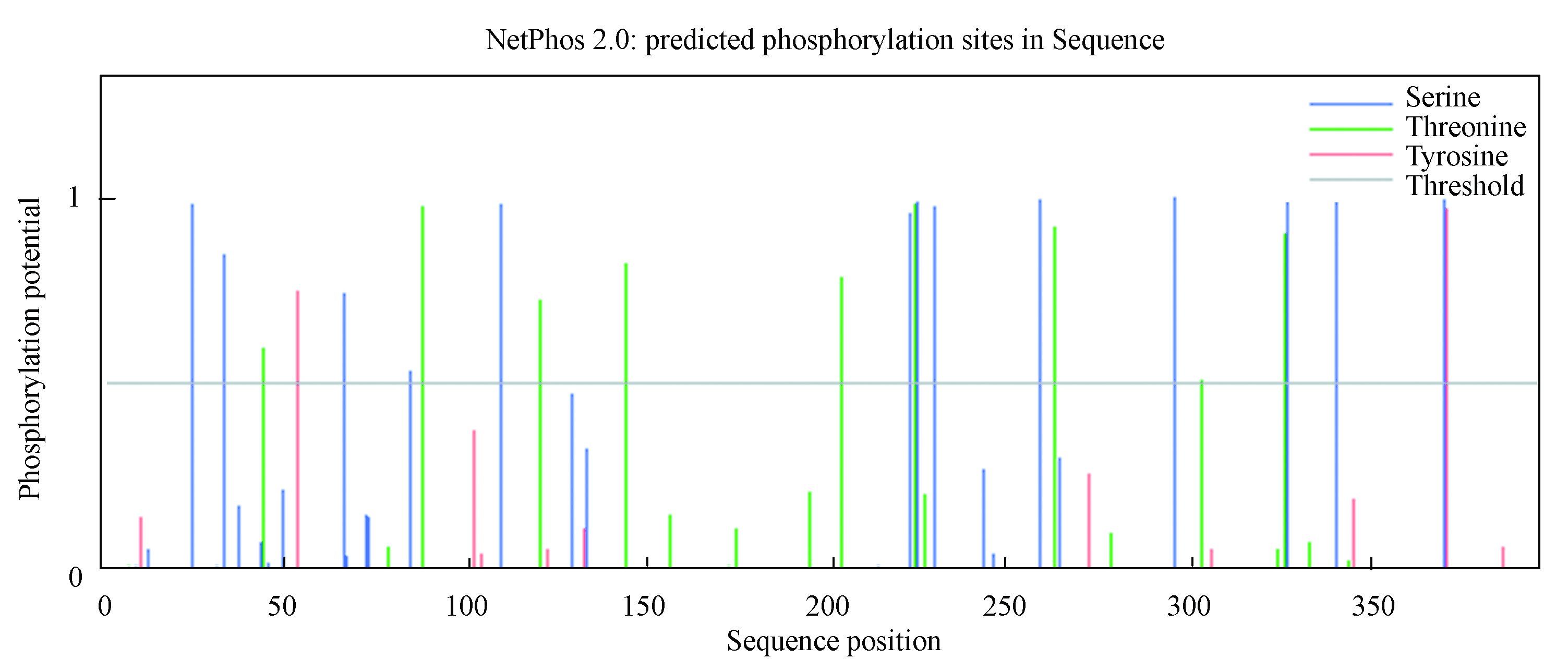
|
图 3 银杏GGPS氨基酸序列的磷酸化位点预测* Figure 3 Phosphorylation site prediction of ginkgo GGPS amino acid sequence 注:*彩图见电子版(http://swxxx.alljournals.cn/ch/index.aspx)(2016年第3期doi:10.3969/j.issn.1672-5565.2016.03.01)。 |
结果表明,总共有24个位点被磷酸化,其中有13个丝氨酸磷酸化位点(分别是第24、33、66、84、109、222、224、229、258、295、326、339和369位)、9个苏氨酸磷酸化位点(分别是第44、88、120、144、203、223、262、302和325位)以及2个酪氨酸磷酸化位点(分别是第53和370位),在以上24个磷酸化位点中S369、S258、S295预测分值最高,均在0.990以上。通过对另外8种植物GGPS氨基酸序列的分析,可以得到同样的结果。
2.5 蛋白质二级结构预测分析以银杏为研究对象,使用SOPMA在线工具分析GGPS氨基酸序列的二级结构(见图 4)。
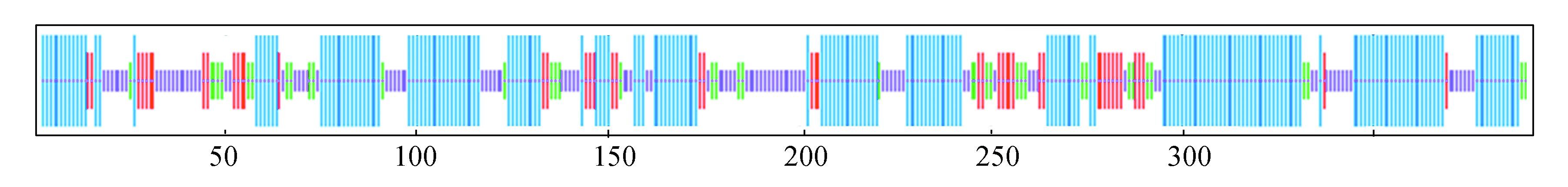
|
图 4 银杏GGPS氨基酸序列的二级结构预测* Figure 4 Secondary structure prediction of ginkgo GGPS amino acid sequence 注:*彩图见电子版(http://swxxx.alljournals.cn/ch/index.aspx)(2016年第3期doi:10.3969/j.issn.1672-5565.2016.03.01)。 |
由图可知,在银杏多肽链中二级结构中α-螺旋(蓝色线*)在链中出现的概率是51.92%、无规卷曲(紫色线*)在链中出现的概率是26.09%、延伸链(红色线*)在链中出现的概率是12.02%、β-转角(绿色线*)在链中出现的概率是9.97%,可以看出银杏GGPS二级结构中没有β-折叠结构。可见α-螺旋是GGPS多肽链中大量存在的结构元件而散布于整个肽链中。另外8种植物的GGPS二级结构中也有类似的情况。
2.6 保守结构域的预测和分析使用NCBI中的CDD工具以银杏为例进行蛋白质结构域的预测分析(见图 5)。

|
图 5 银杏GGPS保守结构域分析 Figure 5 conserved domains analysis of Ginkgo GGPS |
由NCBI中CDD工具中的详细解释可以得出,银杏GGPS氨基酸序列有一个异戊二烯合酶C1超家族,总共有六个不同的保守结构域,分别是底物结合保守结构域,结合Mg2+的结构域,活性位点残基结合结构域,决定链长度的保守结构域,催化残基的保守结构域和富含天冬氨酸的保守结构域。
2.7 蛋白质三级结构预测分析使用Swiss-Model对九个科植物GGPS氨基酸序列的三级结构进行预测分析(见图 6)。
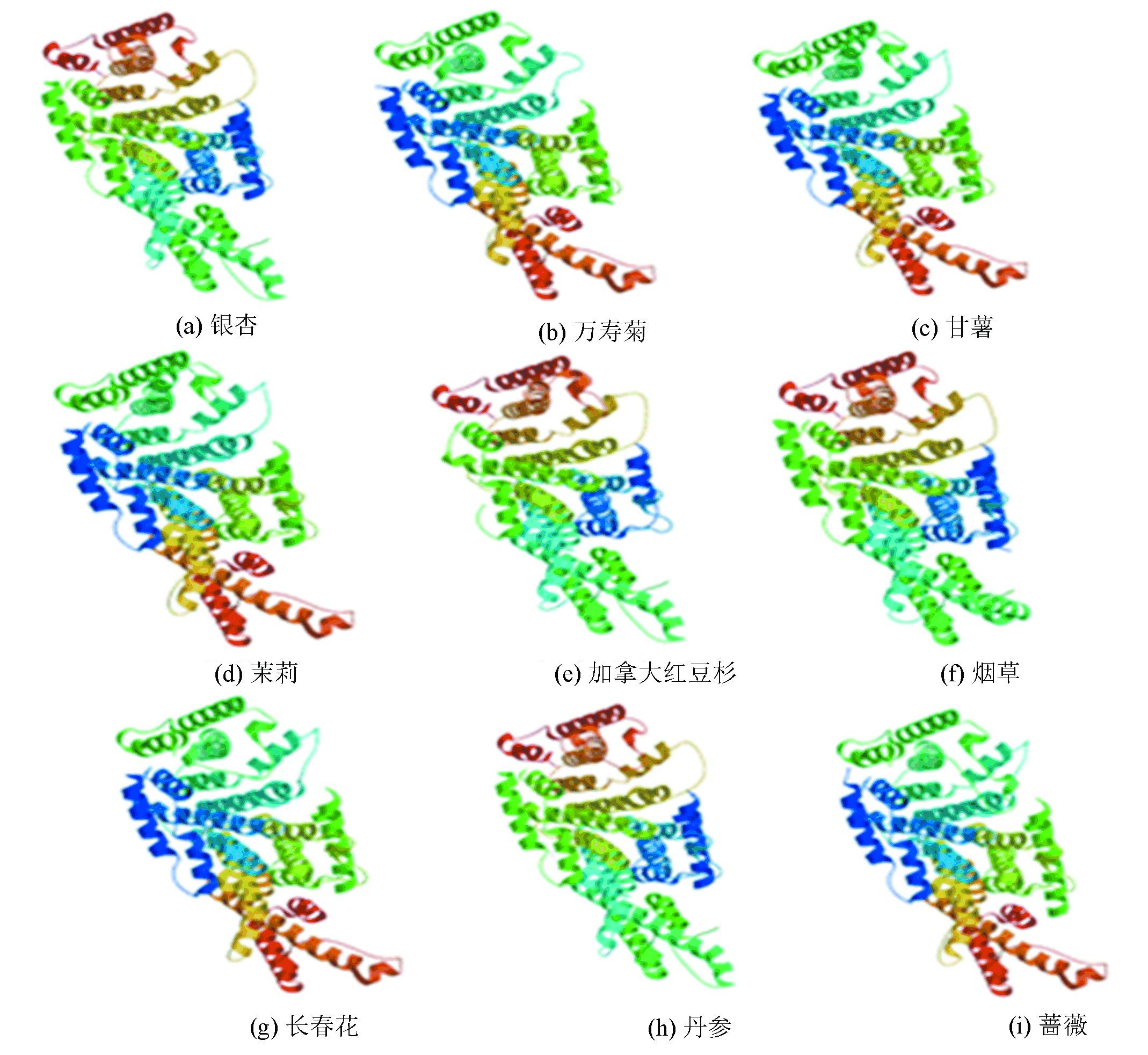
|
图 6 不同植物GGPS氨基酸序列的三级结构预测 Figure 6 Tertiary structure prediction of GGPS in different plants |
通过上面九个三级结构图可以看出,这些植物GGPS蛋白的三级结构极为相似,这同它们核苷酸序列与氨基酸序列的相似性有很大关系,相似的空间结构往往具有相似的功能,同时也可以看出GGPS在进化过程中是相对保守的。
2.8 核苷酸多序列比对从前面对九个不同科植物GGPS序列的分析可以看出,它们的序列相似性相对较高,理化性质差异也不是很大,因此将进一步从序列上分析它们的同源性,为这些植物构建进化树,从而较直观的反映出它们之间的亲缘关系。使用Clustal X软件对九个不同科植物进行多序列比对(见图 7)。

|
图 7 不同植物GGPS的氨基酸多序列对比分析* Figure 7 Multiple sequence alignment of GGPS in different plants 注:*彩图见电子版(http://swxxx.alljournals.cn/ch/index.aspx)(2016年第3期doi:10.3969/j.issn.1672-5565.2016.03.01 )。 |
通过Clustal软件对九个科植物GGPS氨基酸序列进行比对的结果,可以明显的看到这些序列在很大程度上都是相似的,只有少部分存在差异,因此可以得知GGPS在进化过程中是相对保守的。
2.9 GGPS进化树的构建对九种植物的GGPS氨基酸序列和一些相同科的植物如甜菊、蓖麻、麻疯树、橡胶树使用MEGA4.0软件进行分子系统演化分析,获得GGPS核苷酸序列的分子进化树,更进一步地分析它们的亲缘进化关系(见图 8)。从图中可看出13种植物GGPS氨基酸序列明显被分为三大类,万寿菊和甜菊同属于菊科因此亲缘关系最近,蓖麻和麻疯树同是大戟科,亲缘关系也很近,由于有九个不同的科所以进化树的小分支较多,而氨基酸序列和基因序列进化树在大体结构上是相似的,但其分类也有稍微差异,可能是由于在进化过程中某些核苷酸的变异导致其氨基酸发生变化,但结合其序列比对结果发现,总体上GGPS序列还是较为保守的。因此GPSS是牻牛儿基牻牛儿基焦磷酸生物合成途径中一个相对保守的基因,可作为生物遗传分化和分子进化研究中的重要依据。

|
图 8 不同植物GGPS的氨基酸序列分子进化分析 Figure 8 Phylogenetic tree analysis of GGPS in different plants |
本研究使用生物信息学的方法对来源不同植物GGPS的氨基酸序列进行了系统分析。试验结果表明,植物GPSS属于大分子蛋白;氨基酸序列理化性质分析显示植物GGPS 富含Ala和Leu;通过植物GGPS氨基酸序列进行比对的得知GGPS在进化过程中是相对保守的;将13种植物的GGPS进行分子进化分析,结果表明万寿菊和甜菊同属于菊科因此亲缘关系最近,蓖麻和麻疯树同是大戟科,亲缘关系也很近,由于有九个不同的科所以进化树的小分支较多,而氨基酸序列和基因序列进化树在大体结构上是相似的,但其分类也有稍微差异,可能是由于在进化过程中某些核苷酸的变异导致其氨基酸发生变化,但结合其序列比对结果发现,总体上GGPS序列还是较为保守的,因此可作为生物遗传分化和分子进化研究中的重要依据;二级结构分析推测 α-螺旋是多肽链中的主要结构元件。该研究结果可为深入开展 GGPS 酶学特性的分子机理研究提供重要理论依据。
| [1] |
CAZZONELLI C I, POGSON B J. Source to sink: regulation of carotenoid biosynthesis in plants[J]. Trends Plant Science, 2010, 15(5): 266–274.
DOI:10.1016/j.tplants.2010.02.003 ( 0) 0)
|
| [2] |
KUNTZ M, ROMER S, SUIRE C. Identification of a cDNA for the plastid-located geranylgeranyl pyrophosphate synthase from Capsicum annuum: correlative increase in enzyme activity and transcript level during fruit ripening[J]. The Plant Journal, 1992, 2(1): 25–34.
( 0) 0)
|
| [3] |
钟秋月, 国艳梅, 梁燕, 等. 两个不同来源的番茄GGPS基因克隆和序列分析[J]. 华北农学报, 2009, 24(3): 15–22.
ZHONG Qiuyue, GUO Yanmei, LIANG Yan, et al. Cloning and sequence analysis of GGPS gene in two sources of tomato[J]. Acta Agriculturae Boreali-Sinica, 2009, 24(3): 15–22.
( 0) 0)
|
| [4] |
张蕾, 戴住波, 崔光红, 等. 丹参牻牛儿基牻牛儿基焦磷酸合酶基因的克隆与分析[J]. 中国中药杂志, 2009, 34(21): 2704–2708.
ZHANG Lei, DAI Zhubo, CUI Guanghong, et al. Cloning and characterization of geranylgeranyl diphosphate synthase gene of Salvia miltiorrrhia[J]. China Journal of Chinese Materia Medica, 2009, 34(21): 2704–2708.
( 0) 0)
|
| [5] |
李锋, 李明, 金立锋, 等. 烟草牻牛儿基牻牛儿基焦磷酸合成酶基因的克隆及分析[J]. 烟草科技, 2012(5): 60–64.
LI Feng, LI Ming, JIN Lifeng, et al. Cloning and characterization of a new gene encoding geranylgeranyl pyrophosphate synthase from Nicotiana tabacum[J]. Tobacoo Agronomy, 2012(5): 60–64.
( 0) 0)
|
| [6] |
张洪娟, 谭碧月, 曹福亮. 银杏GbGGPS基因的克隆及序列分析[J]. 南京林业大学学报:自然科学版, 2013, 37(4): 9–12.
ZHANG Hongjuan, TAN Biyue, CAO Fuliang. Cloning and characterization of the geranylgeranyl pyrophosphate synthase gene from Ginkgo biloba Linn[J]. Journal of Nanjing Forestry University :Natural Sciences Edition, 2013, 37(4): 9–12.
( 0) 0)
|
| [7] |
ZHAO W E, LV P, GU H H. Studies on carotenoids in watermelon flesh[J]. Agricultural Science, 2013, 4(7A): 13–20.
( 0) 0)
|
| [8] |
UKIBE K, HASHIDA K, YOSHIDA N, et al. Metabolic engineering of Saccharomyces cerevisiae for astaxanthin production and oxidative stress tolerance[J]. Applied Environmental Microbiology, 2009, 75(22): 7205–7211.
DOI:10.1128/AEM.01249-09 ( 0) 0)
|
| [9] |
BREITENBACH J, VISSER H, VERDOES J C, et al. Engineering of geranylgeranyl pyrophosphate synthase levels and physiological conditions for enhanced carotenoid and astaxanthin synthesis in Xanthophyllomyces dendrorhous[J]. Biotechnology Letters, 2011, 33(4): 755–761.
DOI:10.1007/s10529-010-0495-2 ( 0) 0)
|
| [10] |
CSERNETICS A, NAGY G, ITURRIAGA E A, et al. Expression of three isoprenoid biosynthesis genes and their effects on the carotenoid production of the zygomycete Mucor circinelloides[J]. Fungal Genetics and Biology, 2011, 48(7): 696–703.
DOI:10.1016/j.fgb.2011.03.006 ( 0) 0)
|
| [11] |
KUNTZ M, ROMER S, SUIRE C, et al. Identification of a cDNA for the plastidlocated geranylgeranyl pyrophosphate synthase from Cap sicumannum: Correlative increase in enzyme activity and trGGPScript level during fruit ripening[J]. The Plant Journal, 2002, 2(1): 25–34.
( 0) 0)
|
| [12] |
LASKARIS G, BOUNKHAY M, THEODORIDIS G, et al. Induction of ger Anylgeranyl diphosphate synthase activity and taxane accumulation inTaxus baccatacell cultures afterelicitation bymethyl jasmonate[J]. Plant Science, 1999, 147(1): 1–8.
DOI:10.1016/S0168-9452(99)00078-3 ( 0) 0)
|
| [13] |
LUCKER J, BOUWMEESTER H J, SCHWAB W, et al. Expression of Clarkia S-linalool synthase in trGGPSgenic petunia plants results in the accumulation of Dglucopyranoside[J]. The Plant Journal, 2001, 27(4): 315–324.
DOI:10.1046/j.1365-313x.2001.01097.x ( 0) 0)
|
| [14] |
CHIZZOLA R. Regular monoterpenes and sesquiterpenes (Essential oils)[J]. In Natural Products, 2013: 2973–3008.
DOI:10.1007/978-3-642-22144-6_130 ( 0) 0)
|
 2016, Vol. 14
2016, Vol. 14


