2. 河南信阳师范学院生命科学学院, 河南 信阳 464000;
3. 云南农业大学招生就业处, 昆明 650201
2. College of Life Science, HeNan Xinyang Normal University, Xinyang Henan 464000, China;
3. Admission and Employment Office, Yunnan Agricultural University, Kunming 650201, China
硒是人和动物生命必需的微量元素,参与谷胱甘肽(GSHPx)的合成,具有抗氧化损伤的作用。硒的生物学功能是通过硒蛋白来实现的。硒蛋白是硒的转运和贮存形式,硒蛋白中硒以硒半胱氨酸(Sec)和硒蛋氨酸(Se-Met)的形式存在,前者的结合具有特异性,后者为非特异性结合。到目前为止发现硒蛋白家族达25种,其中硒蛋白P(Sepp1)是机体血浆中最主要的硒存在方式[1]。
Sepp1是一种细胞外糖蛋白[1],由硒元素和蛋白以硒半胱氨酸(Sec)的方式结合而成,每个肽链含有10-12个Sec残基[2]。Sepp1主要由肝细胞合成,此外脑星形胶质细胞、小脑颗粒细胞、横纹肌细胞也可以产生,然后分泌到外周血中,将硒运输到其他组织供其利用,合成其他种类的硒蛋白[3-6]。Sepp1最早在大鼠血浆中被发现,后经大量实验研究发现,Sepp1在人和动物的多个组织中均有表达,例如:肝、心、肠、肾等[7-9]。由于近些年对鸡Sepp1的功能及实际应用尚未见到深入系统的报道,所以本文利用生物信息学的方法对鸡Sepp1基因及其蛋白质的理化性质和分子结构进行分析,为鸡Sepp1蛋白的功能研究奠定理论基础,为开发富集Se的鸡蛋和肉类等动物功能性特色产品提供理论指导。
1 材料与方法 1.1 不同物种Sepp1的编码序列和氨基酸的获取利用NCBI(http://www.ncbi.nlm.nih.gov/)获得鸡、猪、人、鼠、羊和狗的Sepp1编码和氨基酸登录号(见表 1)。
| 表 1 6个物种的Sepp1编码和氨基酸登录号 Table 1 Coding accession number and amino acid accession number of Sepp1 of six species |
利用Ensembl( http://www.ensembl.org/index.html)数据库选取12种物种相应的同源基因,利用BioEdit软件对上述不同动物基因氨基酸序列进行比对分析,构建物种之间的系统进化树。12个物种蛋白编码登录号(见表 2)。
| 表 2 12个物种蛋白编码登录号 Table 2 Protein coding accession number of twelve species |
利用在线分析软件ExPaSy(http://www.expasy.ch/tools/)中的ProtParam和Computer pl/MW以及ProScale软件对该编码蛋白质进行基本性质分析,并与猪、人、鼠、羊、狗的Sepp1蛋白进行比较。
1.4 鸡Sepp1信号肽的预测利用在线分析软件SignalP 4.0(http://www.cbs.dtu.dk/services/SignalP/)[10]对鸡Sepp1的信号肽区域进行了分析。
1.5 鸡Sepp1磷酸化位点的预测利用在线预测软件NetPhos(http://www.cbs.dtu.dk/services/NetPhos/)[11]进行磷酸化位点预测,利用Scansite(http://scansite.mit.edu/)[12]分析鸡Sepp1基因编码蛋白中易于被特定蛋白酶磷酸化的位点。
1.6 鸡Sepp1糖基化位点的预测利用在线预测软件NetNGlyc(http://www.cbs.dtu.dk/services/NetNGlyc/),对鸡的Sepp1进行糖基化位点的预测。
1.7 鸡Sepp1跨膜分析利用TMHMM2.0(http://www.cbs.dtu.dk/services/TMHMM/)[13]跨膜结构分析软件,分析Sepp1蛋白跨膜区,并与猪、人、鼠、羊、狗的进行比较分析。
1.8 鸡Sepp1蛋白质卷曲螺旋预测利用COILS(http://www.ch.embnet.org/software/COILS_form.html)[14]工具分析卷曲螺旋,并与猪、人、鼠、羊、狗的Sepp1蛋白进行比较。
2 结果与分析 2.1 Sepp1基因比较及其系统进化树建立 2.1.1 不同物种Sepp1编码区序列同源比对不同物种间Sepp1的CDS序列在DNAMAN软件分析中,发现鸡与猪Sepp1编码区序列的同源性较高(见表 3),达到52.7%,与羊的同源性最低,为48.3%,鼠、人和狗居中,分别为50.5%、51.2%和52.4%。可以看出,鸡Sepp1与其他物种的同源性不高,而其他物种之间同源性都相对较高,在65.3%~80.3%。
| 表 3 鸡与其他物种编码区(CDS)序列比例 Table 3 Chicken with other species coding area sequence (CDS) ratio |
选取12个物种构建系统蛋白进化树,结果显示鸡与鸭和狗的亲缘关系较近,与羊的亲缘关系最远(见图 1)。鸡和鸭的关系最近,表明Sepp1在禽类中遗传和表达差异较小。

|
图 1 不同物种Sepp1蛋白进化树 Figure 1 Evolutionary tree of Sepp1 protein in different species |
利用ExPaSy软件包中的ProtParam、Computer pl/MW工具,对鸡Sepp1基因编码蛋白质进行氨基酸组成、分子质量、等电点等基本性质的分析。鸡Sepp1基因CDS序列长位1 149 bp,编码的蛋白质由384个氨基酸组成,分子量大44 661.8 Da,理论等电点为6.24。在统计鸡Sepp1分子氨基酸组成发现,亮氨酸(Leu)含量最高,甲硫氨酸(Met)的含量最低。将不同物种Sepp1氨基酸组成比较发现,它们的氨基酸组成中都含有20种常见的氨基酸,除苯丙氨酸(Phe)和谷氨酰胺(Gln)的比例差别不大,其他氨基酸组成成分均有较大差异(见图 2)。
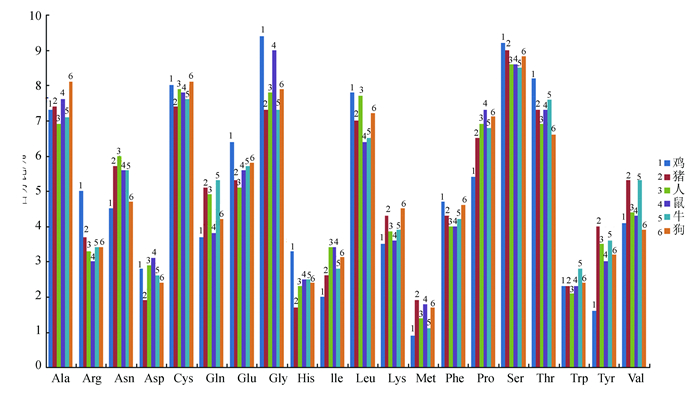
|
图 2 不同物种Sepp1氨基酸含量比较 Figure 2 Comparison of the amino acid content of Sepp1 in different species |
不同种属硒代半胱氨酸(Sec)含量和比例存在差异(见图 3)。鸡Sepp1含有13个Sec,含量为3.3%;狗Sepp1含有15个Sec,含量为3.8%;羊Sepp1含有0个Sec,含量为0%;猪Sepp1含有14个,含量为3.6%;鼠和人Sepp1含有10个Sec,在机体中含量分别为2.6%和2.4%。
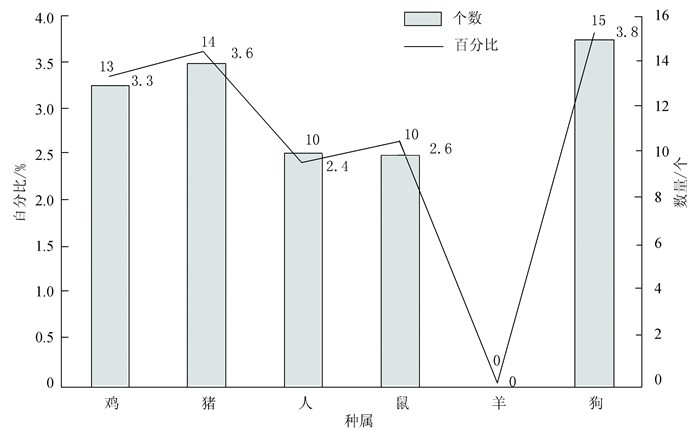
|
图 3 不同物种Sec含量和比例差异 Figure 3 differences of Sec content and proportion in different species |
运用ProScale软件对鸡、狗、牛、人、鼠和猪的Sepp1蛋白进行亲水/疏水性分析,绘制疏水性曲线(见图 4)。正值疏水,负值亲水,介于+0.5到-0.5之间的为两性氨基酸。对所有物种Sepp1蛋白质亲疏水性比较,总体来看,Sepp1是亲水性蛋白。同时发现所有氨基酸序列在1-20位之间都是极具疏水性的,而200-250位都是极具亲水性的。200-250区域靠近N端的末尾,对这51个氨基酸组成进行分析,发现鸡的亲水性氨基酸有31个、猪23个、人有24个、鼠有26个、羊有23个、狗有20个;疏水氨基酸分别为鸡10个、猪19个、人18个、鼠15个、羊20个、狗17个。从统计数据来看,鸡在这一区域的亲水性要比其他物种强。

|
图 4 不同物种Sepp1亲水/疏水曲线 Figure 4 Curve of Hydrophilic/ hydrophobicity of Sepp1 in different species |
利用SignalP 4.0分析发现鸡Sepp1的氨基酸序列在第21-22位存在裂解位点,说明鸡Sepp1具有信号肽结构(见图 5)。
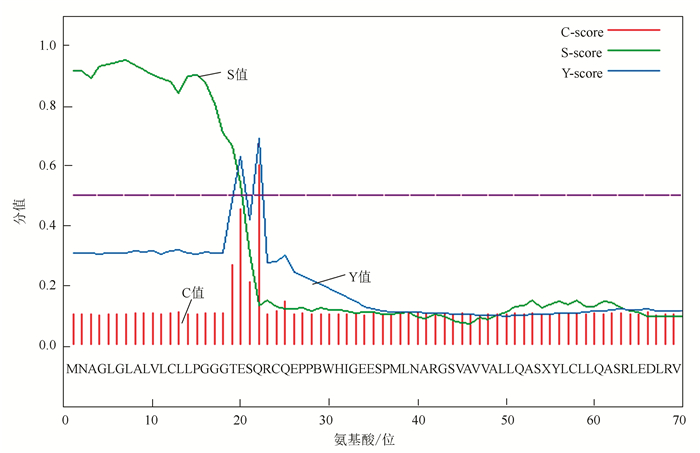
|
图 5 鸡Sepp1信号肽分析 Figure 5 Signal peptide analysis of chicken sepp1 |
利用NetPhot分析发现,鸡Sepp1编码蛋白有12个Ser、1个Thr和3个Tyr可能是磷酸化位点(见图 6),真正的磷酸化位点还需要进一步通过实验来确认。
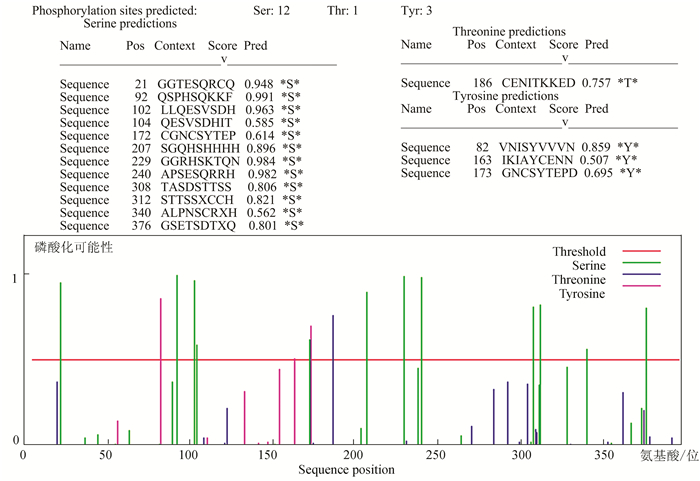
|
图 6 鸡Sepp1序列中磷酸化位点* Figure 6 Phosphorylation sites of chicken sepp1 sequence *彩图见电子版(http://swxxx.alljournals.cn/ch/login.aspx)(2016年第2期doi:10.3969/j.issn.1672-5565.2016.02.04)。 |
同时,利用Scansite分析的motif,发现蛋白质序列中易于被特定蛋白酶磷酸化的位点,结果显示:该蛋白含有1种Src同源群2(SH2)、1种嗜碱性丝氨酸-苏氨酸激酶群(Baso-ST-kin)、有1种激酶结合位点群(Kin-bind)、还有1种DNA损伤激酶组(DNA-dam-kin)(见图 7)。

|
图 7 鸡Sepp1序列中易于被特定蛋白酶磷酸化位点* Figure 7 pecific protease readily phosphorylation sites of chicken sepp1 sequences *彩图见电子版(http://swxxx.alljournals.cn/ch/login.aspx)(2016年第2期doi:10.3969/j.issn.1672-5565.2016.02.04)。 |
分析结果发现鸡Sepp1有3个典型的N糖基化位点,分别位于第79、170、184位(见图 8)。
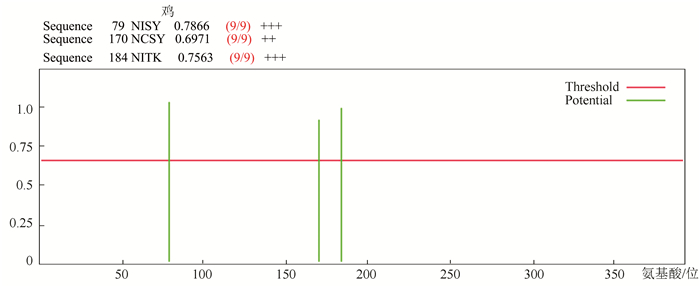
|
图 8 鸡Sepp1序列中糖基化位点i* Figure 8 Glycosylation sites of chicken sepp1 sequence *彩图见电子版(http://swxxx.alljournals.cn/ch/login.aspx)(2016年第2期doi:10.3969/j.issn.1672-5565.2016.02.04)。 |
利用TMHMM2.0分析,发现鸡、猪、人、鼠、羊和狗的Sepp1基因编码残基的所有氨基酸都位于细胞膜的表面(见图 9),与蛋白的疏水性区域结果分析基本一致,表明该蛋白没有跨膜结构。

|
图 9 不同物种Sepp1跨膜区预测结果* Figure 9 Predicted transmembrane region of Sepp1 in different species *彩图见电子版(http://swxxx.alljournals.cn/ch/login.aspx)(2016年第2期doi:10.3969/j.issn.1672-5565.2016.02.04)。 |
利用在线工具COILS预测Sepp1蛋白卷曲螺旋结构(见图 10),比较可以看出不同物种的卷曲螺旋数量存在差异,在50-150位氨基酸序列,都存在一个较大的卷曲螺旋结构,相区别的是鸡Sepp1在靠近第200位残基的位置还存在一个卷曲螺旋结构。
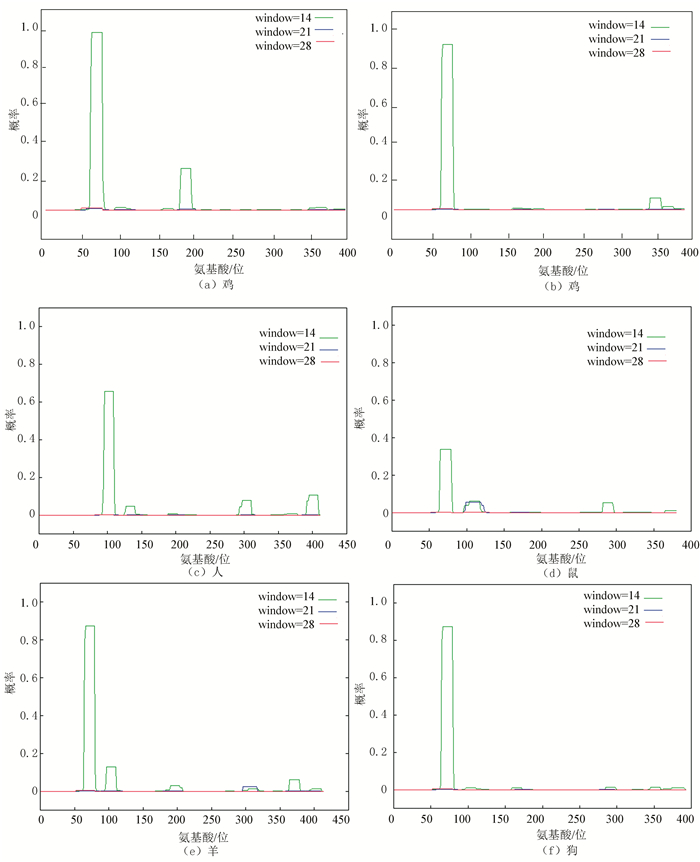
|
图 10 不同物种Sepp1卷曲螺旋分析* Figure 10 Coiled-coil Aanlysis of Sepp1 in different species *彩图见电子版(http://swxxx.alljournals.cn/ch/login.aspx)(2016年第2期doi:10.3969/j.issn.1672-5565.2016.02.04)。 |
在人体和动物体内硒以活性硒蛋白形式发挥生理功能。Sepp1所含Se大约占血浆中全部Se浓度的50%以上,是机体血浆中最主要的硒存在方式。据报道[15],不同哺乳动物种属中Sepp1蛋白氨基酸序列有62%~87%的同源性。本研究结果表明,鸡Sepp1的cDNA全长1 149bp,编码384个氨基酸。鸡Sepp1的CDS序列与其他物种(羊、鼠、狗、人和猪)的同源性为48.3%~52.7%,而其他哺乳动物之间同源性相对较高为65.3%~80.3%。Sepp1蛋白系统进化树的研究结果总体与CDS序列分析结果相似,唯一区别的是狗和猪跟鸡的距离关系略有差异,这可能跟在Ensembl数据库中找到的物种间氨基酸序列和在NCBI上找到编码区氨基酸序列的长度以及氨基酸数量不尽相同有关。同时蛋白系统进化树结果表明,鸡与鸭和狗的亲缘关系较近,与羊的亲缘关系最远。鸡和鸭的关系最近,表明Sepp1在禽类中遗传和表达差异较小。总之,Sepp1的CDS序列和蛋白质在禽类动物和哺乳类动物之间有一定的差别。
硒蛋白中的硒以硒代半胱氨酸的形式出现,一般的硒蛋白只含有一个硒代半胱氨酸,而Sepp1至少含有10个硒半胱氨酸[16]。哺乳动物硒蛋白mRNA在3’非翻译区(3’UTR)都有一个SeCys掺入多肽链中所必需的稳定的茎环结构称为SECIS[17]。编码鸡Sepp1蛋白含有13个Sec,含量为3.3%;狗Sepp1含有15个Sec,含量为3.8%;羊Sepp1含有0个Sec,含量为0%;猪Sepp1含有14个,含量为3.6%;鼠和人Sepp1含有10个Sec,在机体中含量分别为2.6%和2.4%。氨基酸中硒代半胱氨酸所占比例的多少,会影响到微量元素硒在机体内吸收、转运、贮存和利用。有研究报道[16],不同种属的Sepp1可含有10~17个Sec,人、小鼠、大鼠Sepp1含有10个Sec,牛含有12个Sec,石斑鱼含有17个Sec。而本研究表明,鸡Sepp1含有13个Sec,含量为3.3%;狗Sepp1含有15个Sec,含量为3.8%;羊Sepp1含有0个Sec,含量为0%;猪Sepp1含有14个,含量为3.6%;鼠和人Sepp1含有10个Sec,在机体中含量分别为2.6%和2.4%。不同种属中Sec位置高度保守,第一个Sec位于N端。因此,可以推测,鸡Sepp1的功能特性与硒代半胱氨酸的数目和含量密切有关。
信号肽是蛋白质的一个序列片段,信号肽的功能是引导核糖体定位于内质网上的一个通道上,使核糖体附着在内质网上,并将不断伸长的蛋白质链穿透通过通道,随后信号肽被切割下来,合成完成的蛋白质被释放进内质网腔,蛋白最后被转运到胞外[18]。编码信号肽序列只有疏水性强一些,才能够将蛋白质顺利的引入到内质网上。本研究利用生物信息学软件对各物种的Sepp1的信号肽序列分析发现,Sepp1在N端前有一段序列为编码信号肽序列(Sig-Peptide)。同时对所有物种Sepp1亲疏水性比较显示,Sepp1是亲水性蛋白,但在1~20位氨基酸极具疏水性的。这表明Sepp1的前端序列属于信号肽,具有疏水性。在Sepp1 200-250区域靠近N端的末尾,对这51个氨基酸组成进行分析,发现鸡的亲水性氨基酸有31个高于其他物种;疏水氨基酸鸡为10个低于其他物种。该结果表明,鸡Sepp1在这一区域的亲水性要比其他物种强。
蛋白质的磷酸化是通过酶促反应把磷酸基团从一个化合物转移到另一个化合物上的反应过程,是生物体内存在的一种普遍的酶活性调节方式,在细胞信号的传递过程中占据着极其重要的地位。SH2结构域能特异性是被磷酸化的酪氨酸和C端区的3-6个氨基酸残基[19],是酪氨酸激酶信号传导通路的重要组成结构之一[20]。DNA-PK的表达及其结合活性与肿瘤疾病有密切的关系,与肿瘤的恶性程度呈正相关性,DNA-PK可能成为肿瘤治疗新的靶点[21]。本研究的结果表明,鸡Sepp1蛋白含有1个特有Src同源群2(SH2),1个DNA损伤激酶组(DNA-dam-kin)。该结果还需要后续进行实验验证,但初步提示Sepp1蛋白的这些位点或许可作为调控其活性的靶点。
蛋白糖基化是指在蛋白质翻译后进行的修饰过程,在糖基转移酶的作用下把活化的单糖加到合成的蛋白质肽链上的过程。在连接反应的过程中,会出现三种糖基化形式:分别为N-糖苷(N-glycan)、O-糖苷(O-glycan)、糖基磷脂酰肌醇(glycosyl phosphatidylinositol, GPI)[22]。Sepp1是一种细胞外的糖蛋白,在人和大鼠Sepp1序列中分别有6个和5个潜在的糖基化位点,其中2个糖基化位点是保守的。本研究通过对比分析,发现各物种的Sepp1的N糖基化位点大部分都位于N端区。有研究发现[4],Sepp1的N端区具有酶活性,糖基化位点在这一区域集中出现,预示着糖基化修饰作用可能与蛋白的酶活性有关。
跨膜结构域是横跨膜内和膜外的一段蛋白质序列,是膜内在蛋白与膜脂相结合的主要部位,它固着于细胞膜上起锚定作用,一般由20个左右的疏水氨基酸组成。本研究的分析结果显示,不同物种Sepp1氨基酸序列均未发现跨膜结构域,推测可能是由于Sepp1蛋白含有较多的亲水氨基酸的缘故。
由Crick在1953年提出的卷曲螺旋(Coiled-Coil,CC)结构,主要存在于多种天然蛋白质中,是一类由两股或两股以上右手α螺旋相互缠绕而形成的平行或反平行左手超螺旋结构的总称[23]。Sepp1有转运硒的功能,对微量元素硒的运输发挥着至关重要的作用。因此,有必要对其卷曲螺旋结构进行信息学分析[24]。本研究比较不同物种Sepp1的卷曲螺旋数量表明,在50-150位氨基酸中,都存在一个较大的卷曲螺旋结构,相区别的是鸡Sepp1在靠近第200位残基的位置还存在一个卷曲螺旋结构。而且前在大致170-200位氨基酸之间,鸡Sepp1均存在磷酸化位点和糖基化位点,可以推论鸡的这个螺旋结构可以作为一些靶蛋白的作用区域。
4 结论利用多种生物信息学软件分析了鸡Sepp1基因同猪、人、鼠、羊、狗的CDS同源性比对,预测了编码蛋白质的氨基酸组成特点、理化性质和分子结构。研究结果发现:(1)Sepp1的CDS序列和编码的蛋白质在禽类动物和哺乳类动物之间有一定的差别。(2)Sepp1的功能特性与硒半胱氨酸含量有关,不同物种Sepp1中硒半胱氨酸含量存在着差异,因此,不同物种Sepp1的功能可能存在差异。(3)对鸡Sepp1蛋白的糖基化位点、磷酸化位点、疏水性以及卷曲螺旋结构的研究表明,在第170-200位氨基酸残基区域具有特定理化性质和分子结构,推测该序列可作为调控Sepp1功能的靶位点。该研究结果将为进一步研究Sepp1的功能及其与它的特殊功能性,以及与其他蛋白相互作用的机制提供了生物信息学参考,也为进一步探究硒Sepp1在家禽中所起到的作用提供帮助,为通过调控活性位点开发富集Se的动物功能性产品提供新的思路和途径。
| [1] |
ROSA M T, JOHN W H, MARLA J B. Selenoprotein P expression, purification, and immunochemical characterization[J]. The Journal of Biological Chemistry, 2000, 275(9): 6288–6294.
DOI:10.1074/jbc.275.9.6288 ( 0) 0)
|
| [2] |
MOTSENBOCKERM A, TAPPEL A L. A selenocyteine-containing seleniumtransport protein in rat plasma[J]. Biochimica Et Biophysica Acta, 1982, 719(1): 147–153.
DOI:10.1016/0304-4165(82)90318-X ( 0) 0)
|
| [3] |
张龙, 王晓春. 硒蛋白P基因多态性研究进展[J]. 生命科学研究, 2014, 18(5): 441–444.
ZHANG Long, WANG Xiaochun. Progresses on genetic polymorphisms of selenoprotein P[J]. Life Science Research, 2014, 18(5): 441–444.
( 0) 0)
|
| [4] |
SAITO Y, SATO N, HIRASHIMA M, et al. Domain structure of bi-functional selenoprotein P[J]. Biochemical Journal, 2004, 381.
( 0) 0)
|
| [5] |
HILL K E, ZHOU J, MCMAHAN W J, et al. Deletion of selenoprotein P alters distribution of selenium in the mouse[J]. The Journal of Biological Chemistry, 2003, 278(16): 13640–13646.
DOI:10.1074/jbc.M300755200 ( 0) 0)
|
| [6] |
ECKERS J C, KALEN A L, XIAO W, et al. Selenoprotein pinhibits radiation-induced late reactive oxygen species accumulation and normal cell injury[J]. International Journal of Radiation Oncology Biology Physics, 2013, 87(3): 619–625.
DOI:10.1016/j.ijrobp.2013.06.2063 ( 0) 0)
|
| [7] |
桑温昌, 李兆德, 房玉霞, 等. 硒蛋白-P在大肠癌组织中的表达及临床意义[J]. 中国现代普通外科进展, 2010, 13(11): 861–863.
SANG Wenchang, LI Zhaode, FANG Yuxia, et al. Expression and significance of selenoprotein-P in the tissues of colorectal cancer[J]. Chinese Journal of Current Advances in General Surgery, 2010, 13(11): 861–863.
( 0) 0)
|
| [8] |
鲁建国, 王青, 马庆久, 等. 硒蛋白P在结肠癌组织中的表达及其意义[J]. 第四军医大学学报, 2006, 27(14): 1328–1330.
LU Jianguo, WANG Qing, MA Qingjiu, et al. Expression and significance of selenoprotein P in colon carcinoma tissues[J]. Journal of the Fourth Military Medical University, 2006, 27(14): 1328–1330.
( 0) 0)
|
| [9] |
李菲, 安书成. 硒蛋白P与神经退行性变化[J]. 生命科学, 2013, 25(3): 311–314.
LI Fei, AN Shucheng. Selenoprotein P and neurodegeneration[J]. Chinese Bulletin of Life Science, 2013, 25(3): 311–314.
( 0) 0)
|
| [10] |
PETERSEN T N, BRUNAK S, HEIJNE V G, et al. SignalP 4.0:discriminating signal peptides from transmembrane regions[J]. Nature Methods, 2011, 8(10): 785–786.
DOI:10.1038/nmeth.1701 ( 0) 0)
|
| [11] |
BLOM N, GAMMELTOFT S, BRUNAK S. Sequence and structure-based prediction of eukaryotic protein phosphorylation sites[J]. Journal of Molecular Biology, 1999, 294(5): 1351–1362.
DOI:10.1006/jmbi.1999.3310 ( 0) 0)
|
| [12] |
OBENAUER J C, CANTLEY L C, YAFFE M B. Scansite 2.0: proteome-wide prediction of cell signaling interactions using shortsequence motifs[J]. Nucleic Acids Research, 2003, 31(13): 3635–3641.
DOI:10.1093/nar/gkg584 ( 0) 0)
|
| [13] |
MOLLER S, CROING MD, APWEILER R. Evaluation of methods for the prediction of membrane spanning regions[J]. Bioinformatics, 2001, 17(7): 646–653.
DOI:10.1093/bioinformatics/17.7.646 ( 0) 0)
|
| [14] |
LUPAS A, VAN DM, STOCK J. Predicting Coled Coils from Protein Sequences[J]. Science, 1991, 252(5009): 1162–1164.
DOI:10.1126/science.252.5009.1162 ( 0) 0)
|
| [15] |
黎文彬, 王康宁. 硒蛋白P(Selp)的研究进展(一)[J]. 新饲料, 2012, 11(186): 55–57.
LI Wenbin, WANG Kangning. Research progress of selenoprotein P(Ⅰ)[J]. New Feed, 2012, 11(186): 55–57.
( 0) 0)
|
| [16] |
房青, 人硒蛋白P基因片段的克隆、原核表达纯化、抗体的制备及活性的初步研究[D].北京:中国协和医科大学, 2002.
FANG Qin. Cloning, expression and purification of human selenoprotein P and study of its function[D].Beijing: Peking Union Medical College, 2002.
http://d.wanfangdata.com.cn/Thesis/Y521961 ( 0) 0)
|
| [17] |
ZOIA S, TUJEBAJEVA R M, HARNEY J W, et al. Efficient incorporation of multiple selenocysteines involves an inefficient decoding step serving as a potential translational checkpoint and ribosome bottleneck[J]. Molecular and Cellular Biology, 2007, 26(24): 9177–9184.
( 0) 0)
|
| [18] |
叶方寅. 信号肽假说的提出及证实-1999年诺贝尔生理学奖获得者Gunter Blobel简介[J]. 国外医学分子生物学分册, 1999, 21(6): 377–379.
YE Fangyin. Signal peptide hypothesis was put forward and proved-The Introduction of Nobel Prize in physiology prize winner Gunter Blobel in 1999[J]. Archies of Foreign Medical Molecular Biology, 1999, 21(6): 377–379.
( 0) 0)
|
| [19] |
高诗娟, 高友鹤. SH2结构域识别磷酸化酪氨酸的分子机制及生物学作用[J]. 医学分子生物学杂志, 2005, 2(6): 427–429.
GAO Shijuan, GAO Youhe. SH2 Domin, an Imporant Phosphotyrosine-Binding Domin[J]. Journal of Medical Molecular Biology, 2005, 2(6): 427–429.
( 0) 0)
|
| [20] |
AVIZIENYTR E, FINCHAM V J, BRUNTON V G, et al. Src SH3/2 domain-mediated peripheral accumulation of Src and phospho-myosin is linked to de regulation of E-cadherin and the epithelial-mesenchymal transition[J]. Moleclar Biology of the Cell, 2004, 15(6): 794–2803.
( 0) 0)
|
| [21] |
蔡蓉, 张丽珍. DNA依赖蛋白激酶的研究新进展[J]. 医学综述, 2013, 19(7): 1182–1184.
CAI Rong, ZHANG Lizhen. Progress in research on DNA-dependent protein kinase[J]. Medical Recapitulate, 2013, 19(7): 1182–1184.
( 0) 0)
|
| [22] |
严钦, 俞慧清, 成国强. 蛋白糖基化与免疫研究进展[J]. 现代免疫学, 2008, 28(2): 165–168.
YAN Qin, YU Huiqing, CHENG Guoqiang. Research progress of protein glycosylation and immune[J]. Current Immunology, 2008, 28(2): 165–168.
( 0) 0)
|
| [23] |
CRICK F H C. The packing of α-helices: simple coiled coils[J]. Acta Crystallographica, 1953, 6(8): 689–697.
DOI:10.1107/S0365110X53001964 ( 0) 0)
|
| [24] |
魏香, 曾宪纲, 周海梦. 蛋白质结构中卷曲螺旋的研究进展[J]. 中国生物化学和分子生物学报, 2004, 20(5): 565–571.
WEI Xiang, ZENG Xiangang, ZHOU Haimeng. Progress on the study of coiled coils in protein stractrue[J]. Chinese Journal of Biochemistry and Molecular Biology, 2004, 20(5): 565–571.
( 0) 0)
|
 2016, Vol. 14
2016, Vol. 14


