2. 代谢与相关慢病湖北省重点实验室,武汉 430060
2. Hubei Key Laboratory of Metabolic and Chronic Diseases, Wuhan 430060, China
心血管疾病是公众健康的巨大威胁[1]。《中国心血管健康与疾病报告2021》显示,我国心血管疾病现患病人数约有3.3亿,心血管病死亡率仍居于我国城乡居民死亡率之首[2]。绝大多数心血管疾病的共同结局是心力衰竭(简称心衰)[3]。心衰是由各种原因造成的心脏结构和(或)功能异常导致心内压力升高和(或)心输出量不足的一种临床综合征,以呼吸困难为主要临床表现,可能伴有颈静脉压升高、外周水肿、发绀等体征[1]。高血压、瓣膜病、心肌梗死、心肌病,代谢异常等在内的多种疾病最终均可能发展为心衰。心衰的发生发展过程涉及多种机制,如交感神经和肾素-血管紧张素-醛固酮系统激活, 胶原蛋白合成异常, 细胞凋亡, 自噬等。目前越来越多的研究表明活性氧(Reactive oxygen species,ROS)及氧化应激损伤与心衰密切相关[4]。
氧化应激是指ROS的产生与身体解毒能力不平衡的状态[5]。在正常生理状态下,心肌细胞中的线粒体、NADPH氧化酶、黄嘌呤氧化酶等会产生少量ROS以维持细胞正常功能,调控多种酶, 离子通道和转录因子[6]。通过调控超氧化物歧化酶、过氧化氢酶、谷胱甘肽还原酶和过氧化物酶等抗氧化酶的活性能控制ROS的产生水平。ROS的过度产生和积累会对心肌细胞的功能产生负面影响,引起收缩性衰竭和结构损伤,从而导致心功能障碍[5, 7]。在压力负荷诱导的心肌重构小鼠模型中,ROS过度升高导致小鼠发生明显心肌肥厚,扩张及心功能障碍[8]。同时ROS增加还会导致细胞凋亡或其他细胞死亡机制导致心肌细胞损伤[7]。有研究表明,使用抗氧化剂能有效减轻心肌重构,改善心功能[9-10]。然而,在心衰中涉及氧化应激的确切病理生理机制尚未明晰。氧化应激通常受差异表达的氧化应激相关基因调控,这些基因直接或间接地调控疾病的发生发展[11]。到目前为止,在心衰相关机制研究中只有小部分氧化应激相关基因被深入研究,因此,识别更多的关键氧化应激相关基因可能有助于研究心衰的潜在机制。
随着测序技术的发展,生物信息学分析已被广泛应用于识别基因表达特征与疾病之间的相互作用。然而,氧化应激相关基因的生物信息学分析尚未被用于发现与心衰进展相关的疾病特异性生物标志物。因此,本研究旨在从生物信息学分析的角度探寻心衰的关键氧化应激相关基因,并寻找关键基因及其潜在的候选药物,从而为心衰的进一步研究提供参考。
1 数据与方法 1.1 数据从基因表达数据库(Gene expression omnibus,GEO,https://www.ncbi.nlm.nih.gov/geo)下载GSE120895基因表达图谱,数据集来自GPL570平台Affymetrix Human Genome U133 Plus 2.0基因芯片,其中包含8个心功能正常个体心内膜组织和47个有左心室收缩功能障碍(LVEF<45%)和心衰症状(NYHA功能分级Ⅱ和Ⅲ级)的扩张性心肌病患者心内膜组织。
下载GSE17800基因表达图谱,数据集同样来自GPL570平台,其中包含8个LVEF(对照)正常患者的心内膜组织和40个DCM患者的心内膜心肌组织的转录组数据。
1.2 方法 1.2.1 数据处理及差异表达基因筛选使用GEO2R对GSE120895中的基因表达数据进行分析,获得差异表达基因列表,使用Excel筛选差异表达基因(adj.P. Value<0.05,∣log2FC∣>1)并用分别R软件“ggplot”和“pheatmap”包绘制火山图和热图。
从GeneCard数据库(https://www.genecards.org)筛选相关性评分>7分的氧化应激相关基因,之后与GSE120895数据集差异表达基因取交集为氧化应激相关差异表达基因(Differentially expressed genes related to oxidative stress,OS-DEGs)。
从GEO数据集中下载GSE17800中的基因表达数据,利用R软件“ggpubr”包绘制关键基因表达箱式图,利用R软件“pROC”包绘制关键基因的受试者工作特征(ROC)曲线。
1.2.2 GO及KEGG富集分析利用R软件“clusterProfiler”包对OS-DEGs进行KEGG(Kyoto encyclopedia of genes and genomes)分析及GO(Gene ontology)分析。KEGG分析对OS-DEGs进行信号通路富集,对排行的前10位通路绘制柱状图。GO分析分别从生物过程(Biological process,BP)、细胞成分(Cellular component,CC)和分子功能(Molecular function,MF)对OS-DEGs进行富集,并对三个部分注释排行的前10位绘制气泡图,对关键的5个通路绘制圆圈图。
1.2.3 蛋白互作网络构建及功能模块分析将筛选出来的OS-DEGs导入STRING网站(https://www.string-db.org)进行分析获得PPI网络。利用Cytoscape软件中的MCODE插件对蛋白互作(Protein-protein interaction networks,PPI)网络进行功能模块分析。
1.2.4 关键基因筛选利用Cytoscape中的cytoHubba插件,采用6种算法对OS-DEGs筛选排行前10的关键基因,得到在各种算法中均排前10的关键基因之后,取这些关键基因的交集,得到在每种算法中均位于前10的关键基因。
1.2.5 关键基因验证利用GSE17800作为验证数据集,验证关键基因在两组样本中的表达水平,绘制箱式图。此外,采用ROC曲线评估Hub基因与心衰的相关性。
1.2.6 潜在药物预测DGIdb在线数据库(https://dgidb.org/)整合了现有30多个数据库中药物与基因互作关系,将得到的关键基因分别输入DGIdb数据库挖掘靶基因潜在相互作用药物。
2 结果 2.1 差异表达基因筛选利用GEO2R对GSE120895进行差异表达分析,得到差异表达基因720个,其中上调基因713个,下调基因7个,图 1(a)所示为差异表达基因的火山图,图 1(b)为显著表达的前20位基因的热图。
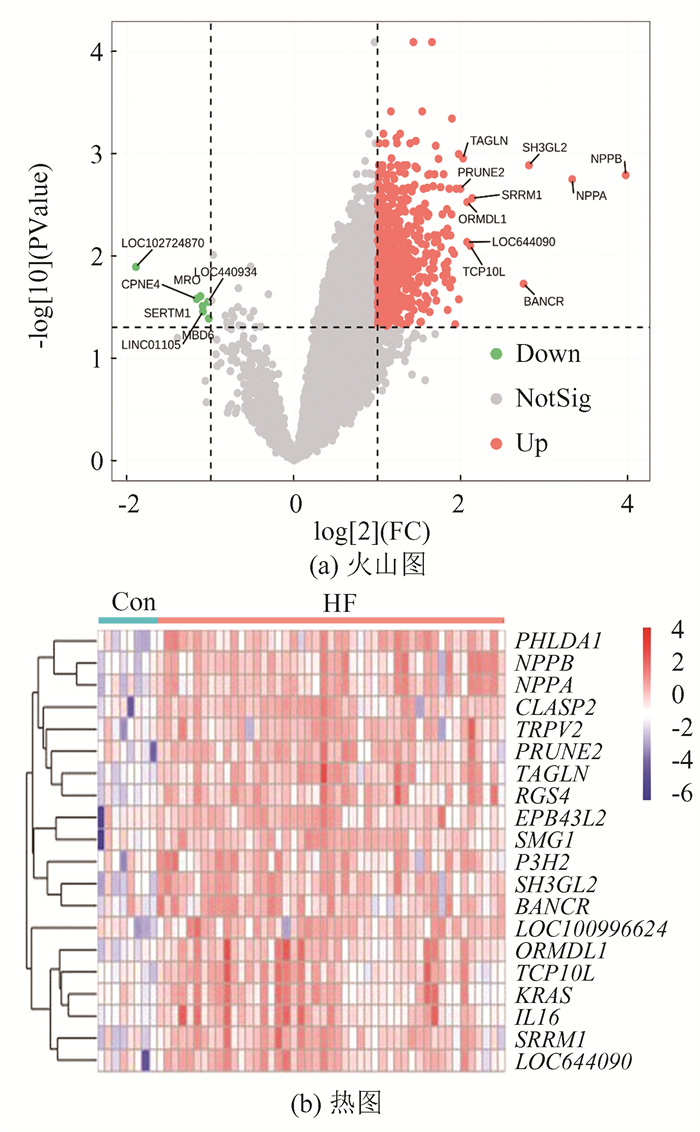
|
图 1 差异表达基因筛选 Figure 1 Screening for differentially expressed genes |
从GeneCards中得到899个氧化应激相关基因,将其与GSE120895的720个差异表达基因进行韦恩分析,得到OS-DEGs共52个(图 2(a))。
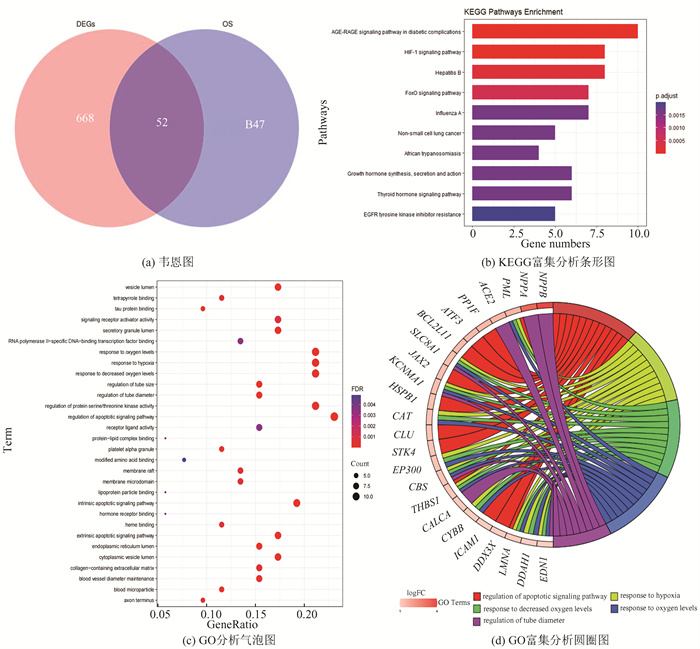
|
图 2 氧化应激相关差异表达基因富集 Figure 2 Enrichment of oxidative stress-related differentially expressed genes |
KEGG分析结果显示,OS-DEGs主要富集于糖尿病并发症中的晚期糖基化终产物-晚期糖基化终产物受体(Advanced glycation end product-receptor for advanced glycation end products,AGE-RAGE)信号通路、缺氧诱导因子1(Hypoxia-inducible factor 1,HIF-1)信号通路、乙型肝炎、叉头框家族O亚科(Forkhead box O,FoxO)信号通路等(图 2(b))。
GO分析显示,OS-DEGs主要富集在凋亡、缺氧反应、管径调节、蛋白丝氨酸/苏氨酸激酶活性调节等生物学过程,主要定位于血小板α颗粒、细胞质囊泡腔、内质网腔等,参与Tau蛋白结合、血红素结合、信号受体激活剂活化等分子功能(图 2(c))。GO富集圆圈图展示了前5个GO term和基因之间的关系(见图 2(d))。
2.3 蛋白质相互作用网络构建及功能模块分析将52个OS-DEGs导入STRING数据库构建PPI网络,预测差异表达基因编码的蛋白质之间的相互作用。通过Cytoscape创建了一个共有48个节点,215条相互作用线的PPI网络图(图 3(a))。利用MCODE插件分析PPI网络图的关键模块,共有2个模块得分≥4分(图 3(b),3(c))。
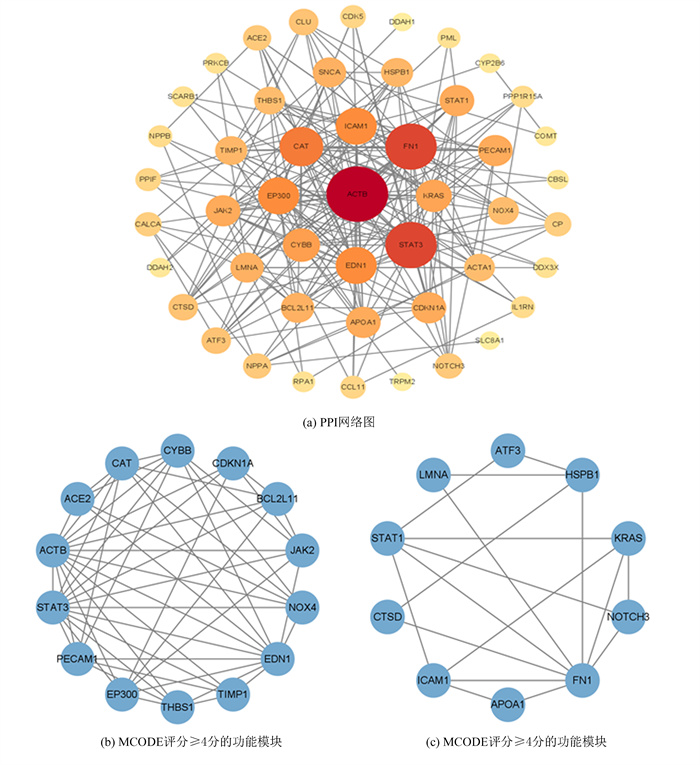
|
图 3 蛋白质相互作用网络及功能模块分析 Figure 3 Analysis of protein interaction networks and functional modules |
基于Cytoscape中的cytoHubba插件,利用其中6种不同的算法分别筛选出评分最高的10个关键基因,结果如表 1所示,这6种算法中的关键基因取交集,得到共有的关键基因为:肌动蛋白β(Actin Beta,ACTB)、信号转导和转录激活因子3(Signal transducer and activator of transcription 3,STAT3)、纤连蛋白1(Fibronectin,FN1)、内皮素-1(Endothelin-1,EDN1)、过氧化氢酶(Catalase,CAT)。
| 表 1 cytoHubba 6种算法关键基因排名 Table 1 Ranking of key genes for 6 algorithms |
在数据集GSE17800中,关键基因的表达水平结果显示,在扩张型心肌病心肌组织样本中ACTB, CAT, EDN1和FN1的表达均显著高于正常心脏心肌组织,如图 4(a)-4(d)所示,而STAT3的表达在两组中无显著差异,如图 4(e)所示。ROC曲线显示ACTB, CAT, EDN1和FN1的曲线下面积分别是0.819,0.787,0.797和0.887,而STAT3的曲线下面积仅为0.469(图 4(f))。表明关键基因ACTB, CAT, EDN1和FN1这四个基因与心衰的发生发展中关系密切,而STAT3有待进一步的研究和确认。
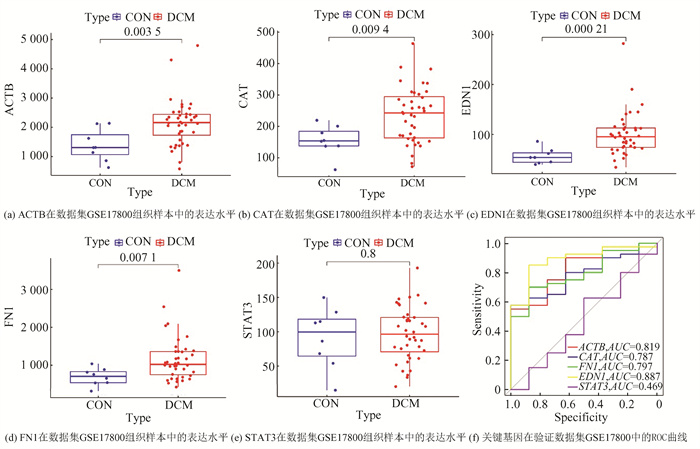
|
图 4 关键基因表达验证 Figure 4 Validation of key gene expression |
利用DGIdb数据库筛选针对核心基因ACTB, FN1, EDN1, CAT的药物共19种(表 2),包括塞来昔布、布地奈德、贝伐珠单抗,去铁胺等,这些药物可能通过影响心衰的氧化应激相关通路,对心衰的发生发展过程产生影响。
| 表 2 靶基因筛选潜在相互作用药物 Table 2 Potentially interacting drugs |
随着人口老龄化问题的加剧,心衰不仅影响患者的生活质量,更给社会带来了巨大的经济负担。而心衰的病因众多,发病机制复杂。近年来越来越多的研究表明氧化应激在心衰中发挥重要作用,氧化应激增加是各种心血管疾病的潜在病因之一,通过抗氧化治疗能保护心肌细胞免受损伤,但氧化应激相关通路在心衰发病机制中的作用尚有争议[1, 10, 12]。虽然许多研究在细胞或动物模型中显示抗氧化应激对心衰有保护作用,但大型临床试验尚未能证明抗氧化治疗策略的显著益处,滥用抗氧化剂甚至可能是有害的[13]。心衰的发病机制非常复杂,单一的机制无法解释其生理病理学改变,使用直接抗氧化药物进行治疗可能无法应对复杂病理生理学机制。因此寻找心衰患者氧化应激的相关标志物,帮助识别受到氧化应激损伤的患者及最有可能从抗氧化剂治疗中受益的患者,在心衰治疗中意义重大。
本研究采用生物信息学分析方法对GEO数据库GSE120895数据集基因表达图谱进行分析,筛选出52个氧化应激相关差异表达基因。GO富集结果显示这些基因主要参与凋亡、缺氧反应。KEGG富集分析结果显示,目标蛋白主要参与AGE-RAGE信号通路、HIF-1信号通路、FoxO信号通路等。AGE-RAGE信号通路可刺激细胞因子释放激活纤维化, 炎症和血栓形成反应,在冠心病的发生中发挥功能[14]。已有研究表明,敲除RAGE可以减轻慢性心衰小鼠模型的心脏纤维化并改善心脏功能[15]。HIF-1是调节氧稳态的主要转录因子,通过调节血管生成和血管重塑来控制氧气输送,并通过调节葡萄糖代谢和氧化还原稳态来控制氧利用[16]。HIF-1可抑制线粒体氧化代谢,从而减少缺氧或缺氧复氧条件下活性氧的产生[16]。FoxO亚家族的三个成员,FoxO1, FoxO3和FoxO4对于维持心脏功能至关重要。FoxO家族通过转录参与氧化应激、代谢、自噬, 衰老和细胞凋亡的基因来介导应激反应[17]。
此研究利用Cytoscape软件对蛋白互作结果进行分析,利用插件CytoHubba鉴定了6种不同的算法中共同关键的氧化应激相关基因。FN1是一种二聚糖蛋白,存在于大多数细胞外基质中。最近的研究已将FN视为限制组织纤维化的潜在靶标[18]。在组织稳态和损伤后伤口愈合期间均需要FN参与,但过度的细胞外基质重塑会加速心功能下降,诱发成熟瘢痕的形成,严重损害器官顺应性。在缺血再灌注模型中,使用FN聚合抑制剂可减少细胞外基质中的胶原沉积,并通过减弱心脏成纤维细胞增殖和心脏的不良纤维化重塑来发挥心脏保护作用[19]。本研究发现心衰组织样本中FN1增加,抑制FN1的表达,靶向FN1的奥克纤溶酶、免疫治疗融合蛋白L19-IL2和L19TNFα,及放射性标记的抗纤连蛋白抗体L19SIP-131I可能作为干预心衰的潜在药物。L19-IL2和L19TNFA为免疫治疗融合蛋白细胞,在肿瘤如胶质细胞瘤,卵巢癌,肾癌中发挥抗肿瘤作用。在心脏相关疾病中,研究报道L19-IL2可通过扩增调节性T细胞减少动脉粥样硬化,而其在心衰中作用的相关研究尚未见报道,值得深入研究[20]。奥克纤溶酶是一种重组蛋白酶,用于治疗玻璃体黄斑粘连等病变,其在心衰中尚未有研究,值得深入研究[21]。
CAT是机体抗氧化系统重要组成部分,是过氧化物酶体的关键酶。ROS过度积累时CAT可被核因子E2相关因子2通过脂质过氧化诱导激活[22]。CAT影响心脏疾病和衰老主要生物学途径的氧化状态,包括细胞应激反应、抗氧化系统、细胞凋亡等。心脏特异性CAT过表达小鼠可防止过度氧化应激,保留舒张期心脏功能并延缓心脏衰老[23]。本研究发现,心衰组织中CAT表达显著高于正常心脏组织,且与CAT关系密切的药物是乙醇。已有研究显示,CAT可参与乳酸刺激的肝脏乙醇氧化[24]。因此,少量,适量或过量饮酒与心衰的关系是我们倍感兴趣的研究课题。
ACTB编码的β-肌动蛋白是一种重要的细胞骨架蛋白,在细胞分裂、迁移、侵袭、囊泡运输和细胞结构调节中起着至关重要的作用[25]。肌动蛋白家族可以调节内皮一氧化氮合酶活性以改变一氧化氮的产生,随后导致内皮功能障碍。此外,肌动蛋白细胞骨架信号传导的氧化还原调节可能会影响血管重塑和功能障碍,导致血管疾病的发展[26]。临床研究发现外周血中ACTB的高甲基化与冠心病风险增加之间存在显着关联[27]。分析结果显示,ACTB在心衰患者心脏组织中表达水平显著上调,结合既往研究猜测,ACTB可能参与氧化应激、凋亡、血管重塑等过程从多方面促进心衰的发生。与ACTB相互作用的乙炔雌二醇是用于月经紊乱及卵巢功能不全的患者或前列腺癌的患者,或者用于口服避孕药[28]。根据本研究,我们须重视此药在临床应用过程中,其对心衰的作用。环磷酰胺是光谱抗肿瘤药物之一,主要用于恶性肿瘤的治疗和免疫抑制治疗,已有研究显示其可能导致心室功能不全和心衰[29],因此靶向ACTB药物的应用,需保护心脏功能。
EDN1是人类心血管系统中含量最高的内皮素亚型,是目前已知的最有效和最持久的血管收缩肽[30]。临床研究表明,未患心血管疾病的情况下,较高的EDN1水平可能与较低的心衰风险有关[31]。本研究显示,心衰心脏组织中EDN1表达增加,已有研究显示扩张型心肌病患者的血浆EDN1水平和心脏EDN1 mRNA水平升高[32]。在动物实验中,心肌细胞特异性EDN1低表达的小鼠随着年龄增长易发展为扩张型心肌病,EDN1对于维持心肌细胞正常的收缩功能,控制超氧化物水平及确保心肌具有足够的胶原蛋白以防止收缩期间过度拉伸至关重要[30]。然而,成年小鼠心脏中EDN1过表达会引起NF-κB核易位,激活炎症反应,导致扩张性心肌病的发生[33]。因此对EDN1表达的控制能否控制疾病尚需深入研究。与EDN1相互作用的莫格他唑、塞来昔布、布地奈德、去铁胺、贝伐珠单抗, 阿替洛尔等与心衰的关系,在基础实验中已有研究[34-38],如研究显示塞来昔布可通过减少细胞凋亡,炎症和氧化应激来抑制压力超负荷诱导的病理性心脏肥大和纤维化[34, 39]。而目前其在临床实践中主要用作各种非心脏病的抗炎药,在心血管领域的应用有待未来在临床试验中得到进一步验证。
STAT3负责将细胞外信号从质膜传递到细胞核和线粒体,从而影响转录和线粒体功能调节不同的生物过程[40]。在生理和病理生理条件下,STAT3能转导肥大信号,促进心肌分化和心脏血管元素形成,调节β肾上腺素能功能和细胞外基质稳态[41-42]。心肌细胞STAT3敲除小鼠心脏缺血再灌注24 h后梗死面积增大[43]。心肌细胞中STAT3的过表达或激活可增强血管内皮生长因子的表达,从而促进心肌毛细血管的形成。目前STAT3在调节电子传递链活性和ROS产生的分子基础尚不清楚,STAT3与心衰的关系,有待进一步的研究和确认。
综上所述,本研究基于生物信息学分析方法,利用GSE120895基因表达数据集和GeneCard数据库筛选出心衰患者氧化应激相关差异表达基因,并在GSE17800数据库中验证了关键基因的表达。之后,本研究重点分析了ACTB, STAT3, FN1, EDN1, CAT与心衰的关系,并预测了存在相互作用的潜在药物,为深入研究心衰的发病机制和治疗提供新思路。但本研究需要仍存在一定的局限性:①本研究分析数据来自于GEO数据库,该数据的准确性和样本量的局限性可能造成结果偏差,需要在更多的数据库或实验中进一步验证;②关键基因的药物预测具有一定的局限性,需要根据已有研究,筛选出抑制剂或激动剂,从而进行深入的探究。
| [1] |
MCDONAGH T A, METRA M, ADAMO M, et al. 2021 Esc guidelines for the diagnosis and treatment of acute and chronic heart failure[J]. European Heart Journal, 2021, 42(36): 3599-3726. DOI:10.1093/eurheartj/ehab368 (  0) 0) |
| [2] |
《中国心血管健康与疾病报告2021》编写组. 《中国心血管健康与疾病报告2021》要点解读[J]. 中国心血管杂志, 2022, 27(4): 305-318. The Writing Committee of the Report on Cardiovascular Health and Diseases in China. Interpretation of report on cardiovascular health and diseases in China 2021[J]. Chinese Journal of Cardiovascular Medicine, 2022, 27(4): 305-318. DOI:10.3969/j.issn.1007-5410.2022.04.001 (  0) 0) |
| [3] |
VIRANI S S, ALONSO A, APARICIO H J, et al. Heart disease and stroke statistics-2021 update: A report from the american heart association[J]. Circulation, 2021, 143(8): e254-e743. DOI:10.1161/cir.0000000000000950 (  0) 0) |
| [4] |
WANG Heru, WEI Jinlong, ZHENG Qingshuang, et al. Radiation-induced heart disease: A review of classification, mechanism and prevention[J]. International Journal of Biological Sciences, 2019, 15(10): 2128-2138. DOI:10.7150/ijbs.35460 (  0) 0) |
| [5] |
RABABA'H A M, GUILLORY A N, MUSTAFA R, et al. Oxidative stress and cardiac remodeling: an updated edge[J]. Current Cardiology Reviews, 2018, 14(1): 53-59. DOI:10.2174/1573403x14666180111145207 (  0) 0) |
| [6] |
VAN DER POL A, VAN GILST W H, VOORS A A, et al. Treating oxidative stress in heart failure: past, present and future[J]. European Journal of Heart Failure, 2019, 21(4): 425-435. DOI:10.1002/ejhf.1320 (  0) 0) |
| [7] |
PLANAVILA A, REDONDO-ANGULO I, RIBAS F, et al. Fibroblast growth factor 21 protects the heart from oxidative stress[J]. Cardiovascular Research, 2015, 106(1): 19-31. DOI:10.1093/cvr/cvu263 (  0) 0) |
| [8] |
TAKIMOTO E, CHAMPION H C, LI M, et al. Oxidant stress from nitric oxide Synthase-3 uncoupling stimulates cardiac pathologic remodeling from chronic pressure load[J]. The Journal of Clinical Investigation, 2005, 115(5): 1221-1231. DOI:10.1172/jci21968 (  0) 0) |
| [9] |
WEN J J, WILLIAMS T P, CUMMINS C B, et al. Effect of mitochondrial antioxidant (Mito-Tempo) on burn-induced cardiac dysfunction[J]. Journal of the American College of Surgeons, 2021, 232(4): 642-655. DOI:10.1016/j.jamcollsurg.2020.11.031 (  0) 0) |
| [10] |
SAHEERA S, POTNURI A G, NAIR R R. Protective effect of antioxidant tempol on cardiac stem cells in chronic pressure overload hypertrophy[J]. Life Sciences, 2019, 222: 88-93. DOI:10.1016/j.lfs.2019.02.054 (  0) 0) |
| [11] |
LU Di, YANG Ning, WANG Shuai, et al. Identifying the predictive role of oxidative stress genes in the prognosis of glioma patients[J]. Medical Science Monitor: International Medical Journal of Experimental and Clinical Research, 2021, 27: e934161. DOI:10.12659/msm.934161 (  0) 0) |
| [12] |
SENONER T, DICHTL W. Oxidative stress in cardiovascular diseases: Still a therapeutic target?[J]. Nutrients, 2019, 11(9): 2090. DOI:10.3390/nu11092090 (  0) 0) |
| [13] |
MVNZEL T, CAMICI G G, MAACK C, et al. Impact of oxidative stress on the heart and vasculature: Part 2 of a 3-Part series[J]. Journal of the American College of Cardiology, 2017, 70(2): 212-229. DOI:10.1016/j.jacc.2017.05.035 (  0) 0) |
| [14] |
ZHANG Lu, GUO Yining, LIU Jing, et al. Plantamajoside attenuates cardiac fibrosis via inhibiting ages activated-rage/autophagy/endmt pathway[J]. Phytotherapy Research, 2022, 37(3): 834-847. DOI:10.1002/ptr.7663 (  0) 0) |
| [15] |
ZHANG Lu, HE Jiaqi, WANG Junyan, et al. Knockout rage alleviates cardiac fibrosis through repressing endothelial-to-mesenchymal transition (Endmt) mediated by autophagy[J]. Cell Death & Disease, 2021, 12(5): 470. DOI:10.1038/s41419-021-03750-4 (  0) 0) |
| [16] |
SEMENZA G L. Hypoxia-inducible factor 1 and cardiovascular disease[J]. Annual Review of Physiology, 2014, 76: 39-56. DOI:10.1146/annurev-physiol-021113-170322 (  0) 0) |
| [17] |
RONNEBAUM S M, PATTERSON C. The foxo family in cardiac function and dysfunction[J]. Annual Review of Physiology, 2010, 72: 81-94. DOI:10.1146/annurev-physiol-021909-135931 (  0) 0) |
| [18] |
TITUS A S, VENUGOPAL H, USHAKUMARY M G, et al. Discoidin domain receptor 2 regulates at1r expression in angiotensin ii-stimulated cardiac fibroblasts via fibronectin-dependent integrin-Β1 signaling[J]. International Journal of Molecular Sciences, 2021, 22(17): 9343. DOI:10.3390/ijms22179343 (  0) 0) |
| [19] |
VALIENTE-ALANDI I, POTTER S J, SALVADOR A M, et al. Inhibiting fibronectin attenuates fibrosis and improves cardiac function in a model of heart failure[J]. Circulation, 2018, 138(12): 1236-1252. DOI:10.1161/circulationaha.118.034609 (  0) 0) |
| [20] |
DIETRICH T, HUCKO T, SCHNEEMANN C, et al. Local delivery of IL-2 reduces atherosclerosis via expansion of regulatory T cells[J]. Atherosclerosis, 2012, 220(2): 329-336. DOI:10.1016/j.atherosclerosis.2011.09.050 (  0) 0) |
| [21] |
JACKSON T L, HALLER J, BLOT K H, et al. Ocriplasmin for treatment of vitreomacular traction and macular hole: A systematic literature review and individual participant data meta-analysis of randomized, controlled, double-masked trials[J]. Survey Of Ophthalmology, 2022, 67(3): 697-711. DOI:10.1016/j.survophthal.2021.08.003 (  0) 0) |
| [22] |
DUBOIS-DERUY E, PEUGNET V, TURKIEH A, et al. Oxidative stress in cardiovascular diseases[J]. Antioxidants, 2020, 9(9): 864. DOI:10.3390/antiox9090864 (  0) 0) |
| [23] |
WU Shan, LI Qun, DU Min, et al. Cardiac-specific overexpression of catalase prolongs lifespan and attenuates ageing-induced cardiomyocyte contractile dysfunction and protein damage[J]. Clinical and Experimental Pharmacology & Physiology, 2007, 34(1-2): 81-87. DOI:10.1111/j.1440-1681.2007.04540.x (  0) 0) |
| [24] |
CONTRERAS-ZENTELLA M L, VILLALOBOS-GARCÍA D, HERNÁNDEZ-MUÑOZ R. Ethanol metabolism in the liver, the induction of oxidant stress, and the antioxidant defense system. antioxidants (Basel)[J]. Antioxidants, 2022, 11(7): 1258. DOI:10.3390/antiox11071258 (  0) 0) |
| [25] |
ARTMAN L, DORMOY-RACLET V, VON RORETZ C, et al. Planning your every move: The role of β-actin and its post-transcriptional regulation in cell motility[J]. Seminars in Cell & Developmental Biology, 2014, 34: 33-43. DOI:10.1016/j.semcdb.2014.05.012 (  0) 0) |
| [26] |
XU Qian, HUFF L P, FUJⅡ M, et al. Redox regulation of the actin cytoskeleton and its role in the vascular system[J]. Free Radical Biology & Medicine, 2017, 109: 84-107. DOI:10.1016/j.freeradbiomed.2017.03.004 (  0) 0) |
| [27] |
JIN Jialie, ZHU Chao, WANG Jinxin, et al. The association between actb methylation in peripheral blood and coronary heart disease in a case-control study[J]. Frontiers in Cardiovascular Medicine, 2022, 9: 972566. DOI:10.3389/fcvm.2022.972566 (  0) 0) |
| [28] |
HUBBARD W J, YANG Shaolong, CHAUDRY I H. Ethinyl estradiol sulfate acts without fluid resuscitation through estrogen receptors to rapidly protect the cardiovascular system from severe hemorrhage[J]. The Journal of Trauma And Acute Care Surgery, 2021, 90(2): 353-359. DOI:10.1097/TA.0000000000002978 (  0) 0) |
| [29] |
LEONG D P, LENIHAN D J. Clinical practice guidelines in cardio-oncology[J]. Heart Failure Clinics, 2022, 18(3): 489-501. DOI:10.1016/j.hfc.2022.02.002 (  0) 0) |
| [30] |
HATHAWAY C K, GRANT R, HAGAMAN J R, et al. Endothelin-1 critically influences cardiac function via superoxide-mmp9 cascade[J]. Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(16): 5141-5146. DOI:10.1073/pnas.1504557112 (  0) 0) |
| [31] |
LEARY P J, JENNY N S, BLUEMKE D A, et al. Endothelin-1, cardiac morphology, and heart failure: the mesa angiogenesis study[J]. The Journal of Heart and Lung Transplantation: The Official Publication of the International Society for Heart Transplantation, 2020, 39(1): 45-52. DOI:10.1016/j.healun.2019.07.007 (  0) 0) |
| [32] |
PLUMPTON C, ASHBY M J, KUC R E, et al. Expression of endothelin peptides and mrna in the human heart[J]. Clinical Science, 1996, 90(1): 37-46. DOI:10.1042/cs0900037 (  0) 0) |
| [33] |
YANG L L, GROS R, KABIR M G, et al. Conditional cardiac overexpression of endothelin-1 induces inflammation and dilated cardiomyopathy in mice[J]. Circulation, 2004, 109(2): 255-261. DOI:10.1161/01.Cir.0000105701.98663.D4 (  0) 0) |
| [34] |
ZHAO Yanli, ZHENG Qi, GAO Hanchao, et al. Celecoxib alleviates pathological cardiac hypertrophy and fibrosis via M1-like macrophage infiltration in neonatal mice[J]. IScience, 2021, 24(3): 102233. DOI:10.1016/j.isci.2021.102233 (  0) 0) |
| [35] |
FU Yao, HU Nan, CAO Ming, et al. Anthelmintic niclosamide attenuates pressure-overload induced heart failure in mice[J]. European Journal of Pharmacology, 2021, 912: 174614. DOI:10.1016/j.ejphar.2021.174614 (  0) 0) |
| [36] |
HENDERSON B C, SEN U, REYNOLDS C, et al. Reversal of systemic hypertension-associated cardiac remodeling in chronic pressure overload myocardium by ciglitazone[J]. International Journal of Biological Sciences, 2007, 3(6): 385-392. DOI:10.7150/ijbs.3.385 (  0) 0) |
| [37] |
XIAO Yang, YANG Zheng, WU Qingqing, et al. Cucurbitacin b protects against pressure overload induced cardiac hypertrophy[J]. Journal of Cellular Biochemistry, 2017, 118(11): 3899-3910. DOI:10.1002/jcb.26041 (  0) 0) |
| [38] |
JIN Tao, HE Qing, CHENG Cheng, et al. Uamc-3203 or/and deferoxamine improve post-resuscitation myocardial dysfunction through suppressing ferroptosis in a rat model of cardiac arrest[J]. Shock, 2022, 57(3): 344-350. DOI:10.1097/shk.0000000000001869 (  0) 0) |
| [39] |
ZHANG Chi, WANG Fan, ZHANG Yingxia, et al. Celecoxib prevents pressure overload-induced cardiac hypertrophy and dysfunction by inhibiting inflammation, apoptosis and oxidative stress[J]. Journal of Cellular and Molecular Medicine, 2016, 20(1): 116-127. DOI:10.1111/jcmm.12709 (  0) 0) |
| [40] |
PIPICZ M, DEMJÁN V, SÁRKÖZY M, et al. Effects of cardiovascular risk factors on cardiac stat3[J]. International Journal of Molecular Sciences, 2018, 19(11): 2572. DOI:10.3390/ijms19113572 (  0) 0) |
| [41] |
ZHANG Wenjun, QU Xiuxia, CHEN Biyi, et al. Critical roles of stat3 in β-adrenergic functions in the heart[J]. Circulation, 2016, 133(1): 48-61. DOI:10.1161/circulationaha.115.017472 (  0) 0) |
| [42] |
HAGHIKIA A, RICKE-HOCH M, STAPEL B, et al. Stat3, a key regulator of cell-to-cell communication in the heart[J]. Cardiovascular Research, 2014, 102(2): 281-289. DOI:10.1093/cvr/cvu034 (  0) 0) |
| [43] |
ZOUEIN F A, ALTARA R, CHEN Qun, et al. Pivotal importance of stat3 in protecting the heart from acute and chronic stress: New advancement and unresolved issues[J]. Frontiers in Cardiovascular Medicine, 2015, 2: 36. DOI:10.3389/fcvm.2015.00036 (  0) 0) |
 2024, Vol. 22
2024, Vol. 22


