2. 南京师范大学 海洋科学与工程学院, 南京 201123
2. School of Marine Science and Engineering, Nanjing Normal University, Nanjing, 201123, China
精氨酸琥珀酸合成酶(Argininosuccinate synthetase, ASS)能在ATP作用下催化瓜氨酸(L-Citrulline)和天冬氨酸(L-Aspartate)形成精氨琥珀酸(Argininosuccinate),该产物经精氨琥珀酸裂解酶(Argininosuccinate lyase, ASL)裂解形成精氨酸(L-Arginine)和延胡索酸(L-Fumarate);其中精氨酸能被精氨酸酶(Arginase)水解生成尿素(Urea),也可与一氧化氮合酶(Nitric oxide synthase, NOS)反应生成一氧化氮(Nitric oxide, NO)和瓜氨酸[1-2]。ASS是生成精氨酸、尿素和一氧化氮的关键限速酶,研究报道ASS调控产生的这些产物与生物体的免疫功能息息相关,可增强生物体细胞的杀菌和吞噬能力,提高免疫球蛋白含量,从而起到提高生物体自身免疫功能的作用[3-4]。
在人体中,ASS基因受到炎症因子、激素等因素的刺激后,其转录水平会发生明显的变化进而影响其他生理功能,ASS基因已成为癌症、肿瘤等疾病个体化治疗研究的新靶点,是医疗研究的热点[5-8];植物中仅见棉花(Gossypium hirsutum)ASS1基因的克隆与鉴定,研究证明该基因具有调控植物的生长和耐盐的能力[9];干酵母(Yeast)和大肠杆菌(Escherichia coli)等菌类中也有ASS基因的相关报道[10-11];水产动物中,ASS基因的相关研究很少,仅见非洲肺鱼(Protopterus annectens)中有报道,Chng等[12]克隆获得了非洲肺鱼ASS基因的全长序列,研究分析了该基因结构特征和功能,证明非洲肺鱼在高温、缺水的夏眠期,该基因在肝脏、肾脏、脑、骨骼肌等各组织中发挥重要的调节作用。ASS基因的下游基因精氨酸酶基因(Arg)及下游产物精氨酸却是水产动物研究的热点,Arg基因参与鱼类抗感染免疫应答过程[13-15];精氨酸作为功能性氨基酸,具有促进鱼体生长、改善免疫系统及肠道功能的作用,饲料中添加一定水平的精氨酸有利于鱼类的健康养殖[16-17]。ASS处于Arg合成代谢的中心地位,必然也发挥着重要的作用。而在贝类中,仅见NCBI数据库中上传的ASS基因序列,具体的基因特征、功能研究等还未见有报道。
文蛤是我国重要的海产经济贝类之一,文蛤养殖尤其是以江苏省为主产区的规模化养殖推动了贝类经济产业的发展,同时,为响应国家绿色健康养殖的号召,江苏沿海地区开展了文蛤与虾蟹混养模式,取得良好的经济和生态效益。但由于近年来气候原因引起的夏季温度整体上升,文蛤在高温季节死亡率明显上升,给养殖户带来严重的经济损失。水温是影响贝类摄食、生长、代谢和免疫反应的重要外界环境因素之一,更甚至会影响贝类的免疫系统和抗病能力,进而诱发贝类的高死亡率[18]。本研究筛选获得了文蛤ASS基因的EST序列,使用RACE克隆技术获得该基因的cDNA全长序列,使用生物信息学方法分析该基因的结构特征,以期为深入了解文蛤的免疫机制,也为后续项目组开发文蛤抗逆新品种奠定理论基础。
1 材料与方法 1.1 MmASS基因克隆使用RACE技术(Rapid amplification of cDNA ends)克隆获得MmASS基因cDNA全长。根据RNA提取试剂盒(天根)的说明书提取文蛤肝胰腺的总RNA,根据Clontech RACE试剂盒说明合成cDNA第一条链。在已知的MmASS基因EST序列上设计3’和5’RACE引物,F1:TTGGATCGGGAGGTGAGAAAAAT,R1:CAGCGCCTAGTTTCATAGCTTTC。PCR获得目的基因产物进行琼脂糖凝胶电泳检测,使用胶回收试剂盒(天根)进行纯化回收,将纯化产物与pMD18-T载体进行连接,使用E.coli Competent Cells DH5α细胞开展目的基因的阳性克隆,筛选含有目的基因片段的菌液测序,并拼接获得目的基因cDNA全长序列。引物合成和测序均由上海生工生物有限公司完成。
1.2 MmASS基因生物信息学分析使用NCBI的ORF Finder寻找MmASS基因cDNA全长序列开放阅读框,并使用blast验证该基因与其他物种的相似性;运用DNAMAN 6.0软件进行序列拼接以及理化特性分析;使用ExPASy中的Compute pI/Mw工具计算分子量和理论等电点;使用SMART在线软件分析蛋白质结构域;使用Swiss-Model工具预测MmASS蛋白质三维结构;使用ProtParam软件分析该蛋白序列的亲水和疏水性;使用TMHMM-2.0在线工具预测蛋白质的跨膜结构域;使用PSORT Prediction在线网页进行亚细胞定位分析;运用MEGA 5.1软件,Neighbor-joining方法,采用Bootstrap法重复计算1 000次,进行系统进化树构建。
1.3 MmASS基因的表达特征分析试验所用文蛤为江苏如东天然野生文蛤,运至实验室后水泥池暂养,水泥池内铺设海沙,24 h连续充气,定期换水,每日定期投喂金藻(Dicrateria)、扁球藻(Tetraselmis)等人工饵料,半个月后取样。选取6个大小规格均一、壳色鲜亮、外表无破损的自然文蛤,低温麻醉后分别取其鳃、外套膜、闭壳肌、足、肝胰腺等不同组织样品,用1×PBS(磷酸盐缓冲盐水, 0.01 mol/L)洗涤后, 液氮速冻, -80 ℃冰箱冻存, 用于RNA提取。使用RNA提取试剂盒分别提取各个组织样品的总RNA,使用1.5 %琼脂糖凝胶电泳及One Drop 2000超微量分光光度计检测RNA的质量和浓度。RNA样本检测合格后,根据反转录试剂盒(天根)的操作说明合成cDNA,用于荧光定量分析实验。
使用Bio-Rad CFX Connect荧光定量PCR仪分析MmASS基因的表达特征,设计并筛选荧光定量特异性引物,qPCR-F:GAGTATGCGAGGGTGAAAGGTAT,qPCR-R:GCATCTGTCTTAACTGTGCCATC。根据荧光定量试剂盒(Bio-Rad, USA)说明书配置体系:总体积25 μL, 其中cDNA 1 μL(100 ng), SsoFastTM EvaGreenSupermix (BioRad, USA)10 μL,特异性正向和反向引物各0.5 μL(10 μmol/L), ddH2O 13 μL。反应条件:95 ℃温浴15 min, 活化Hot Start Taq DNA聚合酶, 然后按95 ℃ 10 s、60 ℃ 30 s进行40个循环。使用β-actin作为内参基因,β-F:TTGTCTGGTGGTTCAACTATG,β-R:TCCACATCTGCTGGAAGGTG。每个样品做4个重复,每次PCR分析结束时进行扩增产物的解离曲线分析。根据2-ΔΔCt方法计算荧光定量数据[19],数据均以平均值±标准差表示,使用SPSS 20.0软件对结果进行单因素方差(One-Way ANOVA)分析。
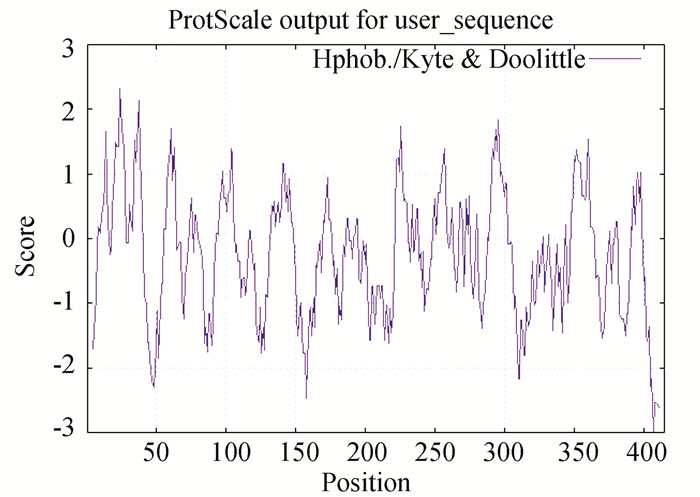
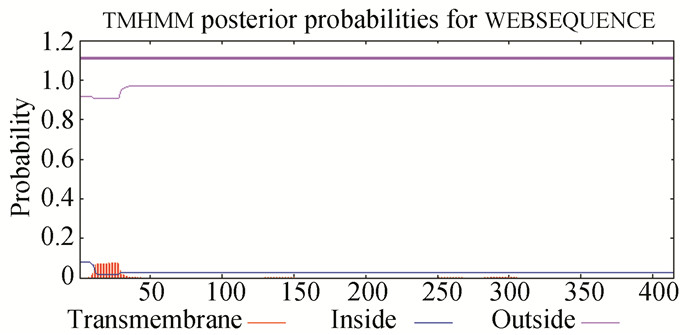
2 结果与分析 2.1 MmASS基因全长及结构域分析使用RACE技术克隆文蛤ASS基因,使用DNAMAN软件拼接获得该基因全长序列,并将该基因命名为MmASS。结果显示,该基因cDNA全长1 588 bp,其中1-59 bp为5’非翻译区(Untranslated regions, UTR),60-1 307 bp为开放阅读框(Open reading frame, ORF),共编码415个氨基酸,1 308-1 588 bp为3’非翻译区,起始密码为ATG,终止密码为TGA,3’非翻译区包含一个加尾信号AATAA和poly(A)尾巴。该基因分子量为46.81 kD,理论等电点pI为5.51。预测蛋白序列包含6个保守序列:(1)[A/S/L]-[F/Y]-S-G-G-[L/V]-D-T-[S/T](13-21 aa),(2)[F/Y/L]-[T/M/L]-A-[D/N]-[V/L/I]-G-Q(37-43 aa),(3)Y-x(3)-T-x(3)-R(90-98 aa),(4)G-x-T-x-[K/R/M]-G-N-D-x(2)-R-F(120-131 aa),(5)S-x-D-x-N-x(6)-E(183-194 aa),(6)E-[N/D]-R-x(4)-K-x(4)-Y-E(273-286 aa)。这些保守结构域主要集中了ATP结合位点、天门冬氨酸L-Asp结合位点以及瓜氨酸L-Cit结合位点(见图 1)。三维结构预测显示该蛋白序列包含15个α螺旋和16个β折叠(见图 2)。ProtParam在线软件分析结果显示MmASS蛋白序列具有亲水性(见图 3)。MmASS蛋白无跨膜结构域(见图 4)。

|
图 1 文蛤ASS基因的cDNA和预测氨基酸序列全长 Figure 1 Full-length of cDNA and the deduced amino acid sequence of MmASS 注:6个保守结构域由黄色标注;L-Cit结合位点由绿色标注;ATP结合位点由方框标注;L-Asp结合位点由双下划线标注. |

|
图 2 文蛤ASS蛋白三维结构预测 Figure 2 Three dimensional structure prediction of MmASS |
|
图 3 文蛤ASS蛋白的亲疏水性分析 Figure 3 Hydrophilic and hydrophobic properties of ASS in M.meretrix |
|
图 4 文蛤ASS蛋白的跨膜结构域分析 Figure 4 Analysis of transmembrane structure of ASS in M.meretrix |
使用MEGA5.1软件构建系统进化树,进化树分析所用物种及登陆号见表 1,结果如图 5所示。文蛤MmASS基因与缢蛏(Sinonovacula constricta)亲缘关系最近,随后与长牡蛎、贻贝、虾夷扇贝等聚为一支。氨基酸序列相似性结果显示,文蛤MmASS基因与缢蛏的ASS基因蛋白序列相似度最高,达78.31%;其次是长牡蛎(Crassostrea gigas)72.36%和紫贻贝(Mytilus galloprovincialis)71.33%。氨基酸序列对比图(见图 6)中不同颜色表示氨基酸序列保守性的高低,深蓝色表示序列的高保守性,由图中可以看出,各物种的ASS基因的保守结构域相似度极高。
| 表 1 系统进化树中各物种ASS蛋白序列登录号 Table 1 Accession number of ASS proteins sequence in the phylogenetic tree |

|
图 5 ASS系统进化树分析 Figure 5 Phylogenetic tree analysis of ASS proteins |

|
图 6 文蛤ASS基因与其他物种的氨基酸序列对比图 Figure 6 Multi-sequence alignment of ASS in M. meretrix and other species 注:保守结构域由红色下划线标注. |
表 2为MmASS蛋白预测亚细胞定位的具体结果,预测MmASS在可能定位于细胞质、细胞核以及线粒体中,定位于细胞质中的可能性最高。
| 表 2 文蛤ASS亚细胞定位预测 Table 2 Predicted subcellular localization of ASS in M.meretrix |
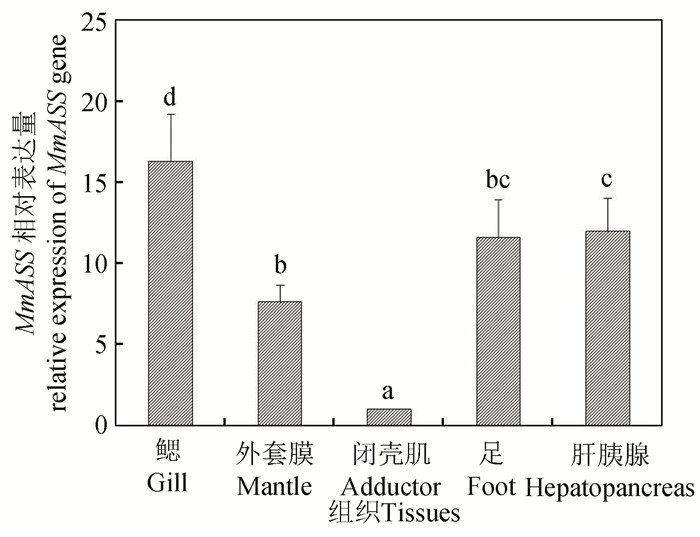
使用qPCR检测MmASS基因在文蛤各个组织中的表达规律,结果如图 7所示。在被检测的5个组织中(鳃、外套膜、闭壳肌、足、肝胰腺),MmASS均有表达,且在鳃中的表达量最高(P < 0.05),其次是肝胰腺。
|
图 7 MmASS基因在不同组织中的表达 Figure 7 Expression levels of MmASS in different tissues 注:不同的字母表示不同组织间差异显著(P < 0.05). |
ASS是精氨酸代谢过程中的关键酶,同时也是尿素循环和NO合成的限速酶,一般分子量约46 kD,是由单肽构成的同源四聚体,ASS序列高度保守,主要包括核苷酸结合结构域、精氨酸琥珀酸合成结构域以及C端多聚化螺旋功能区域[3, 20]。本文运用3’和5’RACE技术首次克隆获得文蛤MmASS基因的全长,共包含415个氨基酸残基,分子量为46.81 kD。MmASS的预测氨基酸序列包含上述三大功能结构域,并存在6个高度保守片段,富集了ATP结合位点、天门冬氨酸L-Asp结合位点以及L-Cit结合位点。氨基酸序列比对结果显示,MmASS的功能结构域与其他物种相似度极高,说明文蛤的ASS基因较为保守,且可能与其他物种的ASS一样具有相似的基因功能。进化树分析结果表明,MmASS基因与双壳类亲缘关系较近,聚为一大支,符合进化规律。贝类中还未见有ASS基因的详细报道,本文首次开展了文蛤MmASS基因的克隆及特征分析,可为后续贝类的相关研究提供借鉴。
早期的研究认为ASS是一种胞质酶[21-22]。Cohen等[23]开展的亚细胞分离研究表明,该酶的一部分与线粒体的外膜相连。哺乳动物的ASS因组织细胞的不同或发育阶段的不同而具有不同的亚细胞定位。在人体内皮细胞中,ASS定位于小泡和高尔基体外[24-25];牛的肠上皮细胞、肾小管细胞中,ASS分布于细胞质中,在动脉内皮细胞中,ASS分布在质膜周围[26-27];大鼠胎儿时期,90%的ASS定位于的肝细胞中的线粒体,到大鼠成年时期,只有30%的ASS定位在的肝细胞线粒体中[28]。在大肠杆菌中,ASS定位在细胞质中[29]。本研究中亚细胞定位分析发现,MmASS蛋白位于细胞质的可能性最大。
ASS是一种普遍存在的酶,许多研究确定其活性存在于许多组织中。成年大鼠中,ASS的mRNA在各个组织中均有表达,如肝脏、肾脏、巨噬细胞、平滑肌细胞、眼细胞以及胶质细胞等,其表达量和蛋白酶活性在肝脏和肾脏中最高,而在肠中的表达量最低[20-21, 30-31];此外,在人的胰岛细胞、淋巴细胞,牛的肝脏、主动脉内皮细胞等均检测到ASS的存在。Chng等[12]研究发现,ASS基因在非洲肺鱼的肝脏、肾脏、脑以及骨骼肌中均有表达。本研究的结果显示,MmASS基因在文蛤的各个组织中均有表达,这与上述的研究结果相似。ASS的功能与其所在的组织,细胞的类型相关,不同的调控机制决定了ASS的不同生理功能。MmASS在文蛤的鳃中表达量最高,其次是肝胰腺。在双壳贝类中,鳃和肝胰腺是重要的免疫组织,对调节贝类自身的免疫机制至关重要,可合成免疫因子启动免疫反应以抵抗外来有害物质的入侵[32-33]。据此推测,MmASS参与调节文蛤各个组织的生理活动,可能在文蛤的免疫防御机制中发挥重要功能。本研究对文蛤ASS基因开展生物信息学分析,具体的功能还有待深入研究,可结合细胞亚细胞定位等技术深入开展基因功能的挖掘,以期为文蛤抗逆新品系的选育奠定理论基础。
4 结论首次克隆获得文蛤MmASS基因cDNA序列,该基因共编码415个氨基酸,预测蛋白序列包含的6个保守功能域与其他物种具有较高的相似度,说明该基因高度保守。文蛤MmASS与缢蛏、贻贝、牡蛎等双壳贝类的亲缘关系最近。MmASS在文蛤鳃组织中的表达量最高,该基因可能在文蛤的免疫防御机制中发挥重要功能。本研究旨在为深入了解文蛤的免疫机制提供理论基础。
| [1] |
KARLBERG T, COLLINS R, BERG S, et al. Structure of human argininosuccinate synthetase[J]. Acta Crystallographica Section D: Structural Biology, 2008, 64: 279-286. DOI:10.1107/s0907444907067455 (  0) 0) |
| [2] |
YU B, HOWELL P L. Intragenic complementation and the structure and function of argininosuccinate lyase[J]. Cellular & Molecular Life Sciences, 2000, 57: 1637-1651. DOI:10.1007/PL00000646 (  0) 0) |
| [3] |
黄祝. 精氨酸琥珀酸合酶的研究进展[J]. 生理科学进展, 2014, 45(1): 41-44. HUANG Zhu. Research development of argininesuccinate synthase[J]. Progress in Physiological Sciences, 2014, 45(1): 41-44. (  0) 0) |
| [4] |
石丹, 周小秋, 赵叶, 等. 精氨酸对鱼类免疫功能的影响及其机制[J]. 动物营养学报, 2015, 27(10): 3026-3032. SHI Dan, ZHOU Xiaoqiu, ZHAO Ye, et al. Effects of Arginine on immune function in fish and its mechanism[J]. Chinese Journal of Animal Nutrition, 2015, 27(10): 3026-3032. DOI:10.3969/j.issn.1006-267x.2015.10.006 (  0) 0) |
| [5] |
李越. 精氨酸琥珀酸合成酶(ASS1)对人肝癌细胞系SMMC-7721细胞增殖和凋亡的影响[D]. 郑州: 郑州大学, 2017. LI Yue. Effects of Argininosuccinate synthetase 1 (ASS1) on cell proliferation and migration in human hepatocellular carcinoma cell line SMMC-7721[D]. Zhengzhou: Zhengzhou University, 2017. (  0) 0) |
| [6] |
陆岽, 庄则豪, 王承党. 精氨琥珀酸裂解酶及合成酶在人胃癌组织中表达的意义[J]. 胃肠病学和肝病学杂志, 2010, 19(2): 138-140. LU Dong, ZHUANG Zehao, WANG Chengdang. Expressions of ASL and ASS in human gastric carcinoma[J]. Chinese Journal of Gastroenterology and Hepatology, 2010, 19(2): 138-140. DOI:10.3969/j.issn.1006-5709.2010.02.011 (  0) 0) |
| [7] |
叶相楠, 王静萱, 张清媛. 精氨酸琥珀酸合成酶作为乳腺癌个体化治疗新靶点的研究[J]. 现代肿瘤医学, 2017, 25(14): 2340-2343. YE Xiangnan, WANG Jingxuan, ZHANG Qingyuan. Study on the new target of the individual treatment of breast cancer by argininosuccinate synthetase 1[J]. Journal of Modern Oncology, 2017, 25(14): 2340-2343. DOI:10.3969/j.issn.1672-4992.2017.14.041 (  0) 0) |
| [8] |
YAN L, TSAI W B, WANG D. Argininosuccinate synthetase 1 (ASS1) is a common metabolic marker of chemosensitivity for targeted arginine- and glutamine-starvation therapy[J]. Cancer Letters, 2017, 388: 54-63. DOI:10.1016/j.canlet.2016.11.028 (  0) 0) |
| [9] |
王慧飞, 孙艳香, 冯雪, 等. 棉花精氨琥珀酸合成酶基因GhASS1的克隆及表达分析[J]. 中国农业科学, 2016, 49(7): 1242-1253. WANG Huifei, SUN Yanxiang, FENG Xue, et al. Cloning and Expression Analysis of Argininosuccinate Synthetase Gene GhASS1 from Gossypium hirsutum[J]. Scientia AgriculturaSinica, 2016, 49(7): 1242-1253. DOI:10.3864/j.issn.0578-1752.2016.07.003 (  0) 0) |
| [10] |
HILGER F, SIMON J P, STALON V. Yeast argininosuccinate synthetase: Purification; Structural and kinetics properties[J]. European Journal of Biochemistry, 1979, 94: 153-163. DOI:10.1111/j.1432-1033.1979.tb12882.x (  0) 0) |
| [11] |
LEMKE C, YEUNG M, HOWELL P L. Expression, purification, crystallization and preliminary X-ray analysis of Escherichia coli argininosuccinate synthetase[J]. Acta Crystallographica Section D, 2007, 55(12): 2028-2030. DOI:10.1107/S0907444999011816 (  0) 0) |
| [12] |
CHNG Y R, ONG J, CHING B, et al. Molecular characterization of argininosuccinate synthase and argininosuccinate lyase from the liver of the African lungfish Protopterus annectens, and their mRNA expression levels in the liver, kidney, brain and skeletal muscle during aestivation[J]. Journal of Comparative Physiology B, 2014, 184(7): 835-853. DOI:10.1007/s00360-014-0842-z (  0) 0) |
| [13] |
马慧鑫, 王磊, 王林庆, 等. 牙鲆精氨酸酶Ⅱ基因的克隆以及免疫应答表达分析[J]. 渔业科学进展, 2018, 39(3): 44-52. MA Huixin, WANG Lei, WANG Linqing, et al. The different expression patterns of the gene Arginase Ⅱ in Paralichthys olivaceus and the correlation between its expression and Edwardsiella tarda infection[J]. Progress in Fishery Sciences, 2018, 39(3): 44-52. DOI:10.19663/j.issn2095-9869.20170401002 (  0) 0) |
| [14] |
刘华, 施婷婷, 施志仪. 牙鲆精氨酸酶基因片段的克隆及序列分析[J]. 广东农业科学, 2016, 43(12): 108-114. LIU Hua, SHI Tingting, SHI Zhiyi. Cloning and sequencing of gene fragments of Paralichthys olivaceus arginase[J]. Guangdong Agricultural Sciences, 2016, 43(12): 108-114. DOI:10.16768/j.issn.1004-874X.2016.12.019 (  0) 0) |
| [15] |
丁斐斐, 李长红, 陈炯, 等. 香鱼精氨酸酶Ⅱ基因的cDNA克隆及其表达与鳗弧菌感染的相关性[J]. 生物技术通报, 2016, 32(2): 109-115. DING Feifei, LI Changhong, CHEN Jiong, et al. cDNA Cloning of Arginase Ⅱ Gene in Ayu(Plecoglossus altivelis) and the Correlation Between Its Expression and Vibrio anguillarum Infection[J]. Biotechnology Bulletin, 2016, 32(2): 109-115. DOI:10.13560/j.cnki.biotech.bull.1985.2016.02.014 (  0) 0) |
| [16] |
赵红霞, 陈启明, 黄燕华, 等. 饲料精氨酸水平对黄颡鱼幼鱼生长性能、消化吸收相关指标、免疫功能和抗氧化能力的影响[J]. 动物营养学报, 2018, 30(12): 5040-5051. ZHAO Hongxia, CHEN Qiming, HUANG Yanhua, et al. Effects of dietary Arginine level on growth performance, digestive and absorptive related indexes, immune function and antioxidant ability of juvenile yellow catfish (Pelteobagrus fulvidraco)[J]. Chinese Journal of Animal Nutrition, 2018, 30(12): 5040-5051. DOI:10.3969/j.issn.1006-267x.2018.12.032 (  0) 0) |
| [17] |
CHENG Z Y, BUENTELLO A, Ⅲ D M G, et al. Effects of dietary arginine and glutamine on growth performance, immune responses and intestinal structure of red drum, Sciaenops ocellatus[J]. Aquaculture Amsterdam, 2011, 319(1): 247-252. DOI:10.1016/j.aquaculture.2011.06.025 (  0) 0) |
| [18] |
郝振林, 唐雪娇, 丁君, 等. 不同高温水平对虾夷扇贝存活率、耗氧率和体腔液免疫酶活力的影响[J]. 生态学杂志, 2014, 33(6): 1580-1586. HAO Zhenlin, TANG Xuejiao, DING Jun. Survival rate, oxygen consumption rate and immune enzymetic activity of Mizuhopecten yessoensis at high temperature[J]. Chinese Journal of Ecology, 2014, 33(6): 1580-1586. DOI:10.13292/j.1000-4890.20140327.013 (  0) 0) |
| [19] |
LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 (  0) 0) |
| [20] |
HUSSON A, BRASSE-LAGNEL C, FAIRAND A, et al. Argininosuccinate synthetase from the urea cycle to the citrulline-NO cycle[J]. European Journal of Biochemistry, 2003, 270(9): 1887-1899. DOI:10.1046/j.1432-1033.2003.03559.x (  0) 0) |
| [21] |
KATO H, OYAMADA I, MIZUTANI-FUNAHASHI M, et al. New radioisotopic assays of argininosuccinate synthetase and argininosuccinase[J]. Journal of Biochemistry, 1976, 79: 945-953. DOI:10.1016/0020-711X(76)90106-3 (  0) 0) |
| [22] |
YU Y, TERADA K, NAGASAKI A, et al. Preparation of recombinant argininosuccinate synthetase and argininosuccinateyase: expression of the enzymes in rat tissues[J]. Journal of Biochemistry, 1995, 117: 952-957. DOI:10.1016/j.agwat.2004.10.010 (  0) 0) |
| [23] |
COHEN N S, KUDA A. Argininosuccinate synthetase and argininosuccinate lyase are localized around mitochondria: An immunocytochemicalstudy[J]. Journal of Cellular Biochemistry, 2015, 60(3): 334-340. DOI:10.1002/(SICI)1097-4644(19960301)60:3<334::AID-JCB5>3.0.CO;2-X (  0) 0) |
| [24] |
BEAUDET A L, O'BRIEN W E, BOCK H G O, et al. The human argininosuccinate synthetase locus and citrullinemia[J]. Advances in human genetics, 1986, 15(161): 161-196, 291-292. DOI:10.1007/978-1-4615-8356-1_3 (  0) 0) |
| [25] |
ENGEL K, HOHNE W, HABERLE J. Mutations and polymorphisms in the human argininosuccinate synthetase (ASS1) gene[J]. Human Mutation, 2010, 30(3): 300-307. DOI:10.1002/humu.20847 (  0) 0) |
| [26] |
FLAM B R, HARTMANN P J, HARRELL-BOOTH M, et al. Caveolar localization of arginine regeneration enzymes, argininosuccinate synthetase, and lyase, with endothelial nitric oxide synthase[J]. Nitric Oxide, 2001, 5(2): 187-197. DOI:10.1006/niox.2001.0340 (  0) 0) |
| [27] |
RATNER S. Argininosuccinate synthetase of bovine liver: chemical and physicalproperties[J]. Proceedings of the National Academy of Sciences of the United States of America, 1982, 79(17): 5197-5199. DOI:10.2307/12503 (  0) 0) |
| [28] |
DEMARQUOY J, FAIRAND A, GAUTIER C, et al. Demonstration of argininosuccinate synthetase activity associated with mitochondrial membrane: characterization and hormonal regulation[J]. Molecular and Cellular Biochemistry, 1994, 136: 145-155. DOI:10.1007/BF00926075 (  0) 0) |
| [29] |
VAN VLIET F, CRABEEL M, BOYEN A, et al. Sequences of the genesencoding argininosuccinate synthetase in Escherichia coli and Saccharomyces cerevisiae: Comparison with methanogenic archaebacteria and mammals[J]. Gene, 1990, 95(1): 99-104. DOI:10.1016/0378-1119(90)90419-R (  0) 0) |
| [30] |
GELDRE L A V, TIMMERMANS J P, LEFEBVRE R A. L-citrulline recycling by argininosuccinate synthetase and lyase in rat gastric fundus[J]. European Journal of Pharmacology, 2002, 455(2-3): 149-160. DOI:10.1016/S0014-2999(02)02584-0 (  0) 0) |
| [31] |
TUNG M L, LV Yongke, YAN Wei, et al. Argininosuccinate synthase conditions the response to acute and chronic ethanol-induced liver injury in mice[J]. Hepatology, 2012, 55(5): 1596-1609. DOI:10.1002/hep.25543 (  0) 0) |
| [32] |
杜俊俏, 刁晓平, 郑鹏飞, 等. 芘暴露对马氏珠母贝鳃和肝胰腺抗氧化酶活性的影响[J]. 生态环境学报, 2013, 22(10): 1711-1716. DU Junqiao, DIAO Xiaoping, ZHENG Pengfei, et al. The effects of pyrene exposure on antioxidant enzymes activity in the gill and hepatopancreas of pearl oyster Pinctada martensi[J]. Ecology and Environmental Sciences, 2013, 22(10): 1711-1716. DOI:10.3969/j.issn.1674-5906.2013.10.012 (  0) 0) |
| [33] |
IWANAGA S, LEE B L. Recent advances in the innate immunity of invertebrate animals[J]. Journal of Biochemistry and Molecular Biology, 2005, 38(2): 128-150. DOI:10.5483/bmbrep.2005.38.2.128 (  0) 0) |
 2023, Vol. 21
2023, Vol. 21


