普氏野马(Equus przewalskii)属国家Ⅰ级保护野生动物,是目前地球上唯一存活的野生马,保留着马的原始基因,曾栖息在从准噶尔盆地到蒙古高原西南部的荒漠草原地带,是保存马类动物遗传多样性及用于家马性状改良和育种的珍贵物种。由于捕猎和环境问题,普氏野马的野生种群已于20世纪60年代在我国灭绝。从20世纪80年代末期以来,我国陆续从欧洲引回普氏野马,在新疆卡拉麦里和甘肃武威半散放养殖。将普氏野马与家马染色体数量进行对比,由于其染色体数目(2n=66)不同于家马(2n=64),一些研究者将普氏野马划分为一个独特的物种。对GTG显带核型的研究表明,两种马类动物的染色体都是同源的,染色体数目的差异是由于EPR中涉及两对端中心染色体的罗伯逊事件引起的[1-2],由此可推测普氏野马为家马的祖先。有研究表明,野马的血液白细胞含量一般高于家马而低于斑马,血沉比家马缓慢[3]。普氏野马与家马在头骨形态上的变异, 是由环境和进化的两个方面决定的。将普氏野马的头骨与家马进行比较, 发现野马头长与体长之比大于家马头长与体长之比,野马脑区体积在马属动物中仅属中等程度,但脸区却明显大于家马,野马下颌骨较家马的粗大,翼肌窝较家马的深,上、下臼齿列也明显比家马长,以上特点和野马的野生习性相适应[4]。在外貌和形态上,普氏野马在体型上酷似家马,但还存在着明显的差别, 通过普氏野马的额毛,鬃毛和体色就足以与家马区分出来,普氏野马和家马的行为谱基本相似,如采食,休息,运动,繁殖,玩耍等行为基本无差别。综上研究表明,野马和家马间不仅只有同源性,也存在一定的品种差异。现有的针对普氏野马的研究包括普氏野马肠道寄生虫以及普氏野马血液生理参数测定等[5-6],而对于普氏野马GH基因的相关研究还未见报道。
生长激素(Growth Hormone, GH)是大脑垂体前叶分泌的一种多肽类激素, 对动物个体的生长、发育的影响极其明显。除神经组织外, GH几乎对所有组织的生长都有刺激作用,通过调节内分泌系统的激素水平, 提高动物的生产性能, 已成为畜牧业发展的热点。当哺乳动物身体感到压力时,下丘脑-垂体-肾上腺系统被激活[7-11],在不同应激类型(身体或精神)和发病模式(急性或慢性)[12-14]下,都可以观察到应激反应。由于普氏野马的应激反应较大,易受外部环境影响和干扰,当其处于运输[15]或者竞赛等压力环境时其胃溃疡的发生率会明显增加[16-18]。垂体前叶分泌的催乳素和生长激素(GH)是应激反应中抗应激的必需激素[19]。曾有研究表明,马可以通过运动增强催乳素和生长激素的分泌[20]。综上,生长激素不仅是生理生化指标的重要部分,其水平变化对于考量普氏野马的行为表现具有十分重要的意义。因此,本研究以普氏野马的GH基因为研究对象,旨在探明其基因组结构特点,预测分析编码蛋白的理化性质和结构功能特点,为利用GH基因的功能来研究提高普氏野马的野外生存与繁殖能力奠定分子信息基础。
1 材料与方法 1.1 普氏野马全血样采集自国家林业局甘肃濒危动物保护中心,存放于-70 ℃以下条件保存备用。
1.2 主要试剂与仪器LA Taq DNA聚合酶购自TaKaRa公司;DNA Marker购自艾科瑞生物公司;血液/细胞/组织基因组DNA提取试剂盒(DP304)购自天根生化科技(北京)有限公司;干粉引物由生工生物工程(上海)股份有限公司合成;其他常规试剂均为进口或国产分析纯级产品;梯度PCR仪购自美国ABI公司。
1.3 普氏野马DNA全基因组的提取从超低温冰箱中取出普氏野马的全血,37 ℃水浴锅溶解,按照血液基因组DNA提取试剂盒(TIANGEN)说明提取普氏野马血液中的总DNA,琼脂糖凝胶电泳检测DNA(电压120 V,电流400 A)。
1.4 引物的设计与GH基因的扩增参照Gene Bank中家马的GH基因序列(Gene ID: 100034180),设计引物,参考序列长度为1 683 bp,引物序列和纯化方法如表 1所示。
| 表 1 引物序列和纯化方法 Table 1 Primer sequences and purification methods |
PCR反应的总体积为20 μL,其中含:LA Taq DNA聚合酶0.2 μL;dNTP 3.2 μL;LA Taq Buffer 2 μL;DNA模板1 μL;F、R引物各0.5 μL;dd H2O 12.6 μL。
PCR反应条件设置为: 94 ℃预变性4 min;98 ℃变性20 s,退火58 ℃ 15 s,72 ℃延伸30 s,35个循环;最后72 ℃延伸10 min,4℃保存。PCR产物用1%的琼脂糖凝胶电泳检测分析。
1.5 生物信息学分析首先利用Augustus预测该序列的外显子和内含子;然后再利用NCBI检索相关物种的氨基酸序列,用于后续序列比对;通过MEGA7软件构建17个物种的氨基酸序列系统进化树;利用ExParam tool在线工具预测GH氨基酸序列的物理化学性质;再利用Cell-PLoc 2.0算法进行亚细胞定位分析;利用TMHMM Server v.2.0、SignalP-5.0对蛋白质的跨膜结构域及信号肽进行预测;应用SOPMA分析蛋白质二级结构及相关功能并应用NCBI平台上的CDD进行保守结构域的分析;利用SWISS-MODEL进行同源建模并分析蛋白质的3D结构[21]。
2 结果与分析 2.1 GH基因的扩增及测序结果对普氏野马基因组进行扩增,得到5条特异性较高的目的条带(见图 1),PCR扩增产物大小与预期片段大小一致,条带清晰、明亮,可用于核酸测序。将核酸测序结果在NCBI数据库中进行BLAST搜索,比对结果表明扩增得到的序列是普氏野马GH基因,长度为1 577 bp,测序结果见图 2。
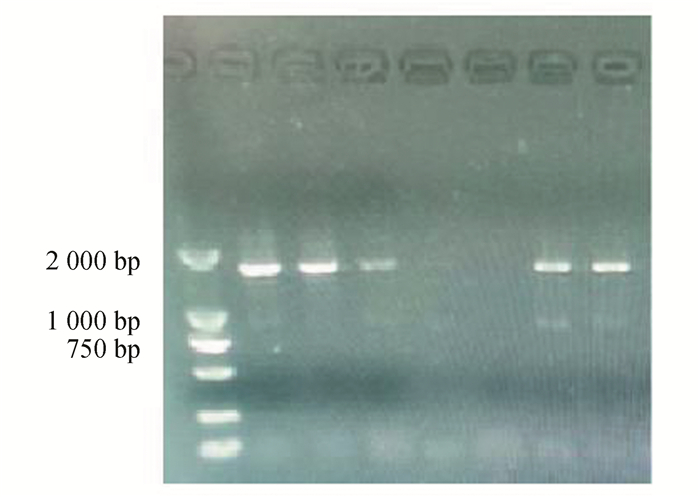
|
图 1 GH基因的PCR扩增结果 Figure 1 Results of PCR amplification of GH gene |

|
图 2 普氏野马GH基因的测序结果序列 Figure 2 Sequencing results of GH gene of Equus przewalskii |
根据核酸测序结果,将普氏野马与家马(GenBank: EU939446.1)的GH基因及其编码的氨基酸序列利用NCBI上的BLAST进行比对,结果显示,普氏野马GH基因与家马的GH基因相似性达到99.68%,可推测普氏野马与家马的GH基因序列是同源序列,二者具有同源性。与家马相比,普氏野马GH氨基酸序列未发生较大改变。
将普氏野马GH氨基酸序列与从GeneBank中获得的16个物种的GH氨基酸序列进行相似性分析,在NCBI上利用在线BLAST功能进行多序列对比并构建系统发育树,见图 3。氨基酸序列相似性分析结果表明,普氏野马与家马具有较高的同源性,其亲缘关系较密切;与人、黑猩猩、大猩猩、猕猴等动物同源性较低;与其他物种在系统发育树中距离较近,但也并非处于同一个分支。GH氨基酸序列系统发育树与生物进化的物种树基本一致,说明GH基因编码区在物种间比较保守。

|
图 3 17个物种GH氨基酸序列进化树 Figure 3 GH amino acid sequence phylogenetic tree of 17 species |
利用Augustus在线分析平台来预测其外显子和内含子数目及位置,结果表明,该DNA序列中含有5个外显子和4个内含子,外显子长度分别介于1-10, 318-401, 631-747, 932-1 093和1 366-1 577 bp,内含子长度分别介于11-317, 402-630、748-931和1 094-1 365 bp。其中,蛋白质的编码序列如表 2所示。
| 表 2 CDS区编码的蛋白质序列 Table 2 Protein sequences encoded by CDS region |
利用ExPASY ProtParam tool在线工具对普氏野马GH氨基酸序列的基本性质进行理论的预测分析,结果表明,该蛋白质的氨基酸数量为152个,分子量为17 638.54 Da,理论等电点为9.01,带负电荷的残基总数(Asp+Glu)为19个,正电荷残基总数(Arg+Lys)为23个,分子式为C790H1274N216O226S7,消光系数以M-1 cm-1为单位,在水中测量时为280 nm,假设所有对Cys残基形成胱氨酸, 则其消光系数为外部系数13 075 Abs 0.1%(=1 g/l)0.741;假设所有Cys残留物都减少, 外部系数12 950 Abs 0.1%(=1 g/l)0.734。
预测的半衰期为:所考虑序列的N端为M(Met),估计半衰期为:30 h(哺乳动物网织红细胞,体外),>20 h(酵母,体内),>10 h(大肠杆菌,体内)。
不稳定性指数(Ⅱ)为:38.57;脂肪族氨基酸指数为:101.38;总的亲水性平均系数为:-0.214;氨基酸组成为:
Ala (A) 9 5.9%
His (H) 2 1.3%
Arg (R) 12 7.9%
Ile (I) 4 2.6%
Thr (T) 7 4.6%
Asn (N) 4 2.6%
Leu (L) 28 18.4%
Trp (W) 1 0.7%
Asp (D) 10 6.6%
Lys (K) 11 7.2%
Tyr (Y) 5 3.3%
Cys (C) 3 2.0%
Met (M) 4 2.6%
Val (V) 7 4.6%
Gln (Q) 8 5.3%
Phe (F) 8 5.3%
Pyl (O) 0 0.0%
Glu (E) 9 5.9%
Pro (P) 3 2.0%
Sec (U) 0 0.0%
Gly (G) 6 3.9%
Ser (S) 11 7.2%
原子组成为:
Carbon
C
790
Nitrogen
N
216
Oxygen
O
226
Hydrogen
H
1 274
Sulfur
S
7
原子总数为:2 513
2.4.2 亚细胞定位分析利用Cell-PLoc 2.0算法预测蛋白质的亚细胞定位,分析结果显示,普氏野马GH蛋白定位于细胞外。
2.4.3 跨膜结构与分析利用生物学在线软件TMHMM Server v. 2.0对蛋白质是否具有跨膜螺旋进行预测,分析结果表明,普氏野马GH蛋白并不具有相关的跨膜结构,如图 4所示。

|
图 4 普氏野马GH蛋白质跨膜结构与分析 Figure 4 Transmembrane structure and analysis of GH protein in Equus przewalskii |
利用SignalP-5.0在线分析网页预测信号肽的存在情况,分析结果表明,普氏野马GH蛋白质中含有信号肽的可能性为0.35%。
2.4.5 蛋白质二级结构分析蛋白质二级结构主要指多肽链主链骨架中局部的构象,对其进行预测分析有助于认识蛋白的空间结构。应用在线分析工具SOPMA来预测蛋白质的二级结构,分析结果见图 5、图 6,其中c表示无规卷曲,h表示α-螺旋,e表示β-折叠,t表示β-转角。

|
图 5 GH蛋白质的二级结构组成分析 Figure 5 Secondary structure analysis of GH protein |
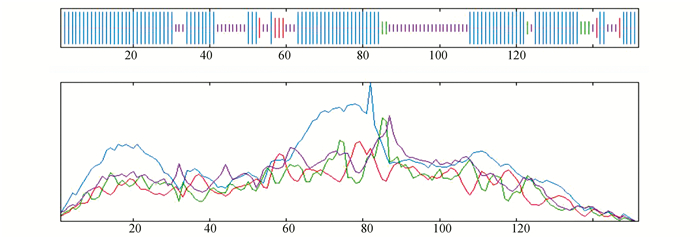
|
图 6 蛋白质的二级结构分析
Figure 6 Secondary structure analysis of proteins
注意:蓝色线条代表:Alpha helix (Hh);紫色线条代表:Random coil (Cc);绿色线条代表:Beta turn (Tt) 红色线条代表:Extended strand (Ee) |
分析结果显示,普氏野马GH蛋白中共有63.16%氨基酸残基为Alpha helix(α-螺旋),有3.95%的氨基酸残基为Extended strand(β-折叠),有3.95%的氨基酸残基为Betaturn(β-转角),有28.94% 的氨基酸残基为Random coil(无规则卷曲),见表 3。
| 表 3 蛋白质的二级结构组成占比分析 Table 3 Analysis of secondary structure composition ratio of proteins |
利用NCBA平台上的CDD在线生物学工具,对蛋白质的保守结构域进行预测分析。结果表明,其蛋白质分类为:Somatotropin_like domain-containing protein,即含有生长激素样结构域的蛋白质,CDD的分析结果以Graphical summary和List of domain hits形式显示。在图形和列表的分析结果中,均表明GH蛋白质含有1个结构域,为somatotropin_like--cd10285(见图 7),受体结合面见图 8,保守结构域比对结果如图 9所示,属于生长激素/催乳素激素家族。生长激素(GH)是垂体合成的一种肽类激素,在发育过程中介导合成代谢效应。已知GH通过与特定细胞受体结合激活MAPK/ERK和JAK-STAT信号通路,通过后者,它触发胰岛素样生长因子1(主要在肝脏)的分泌。除了增加身高,生长激素还被证明有许多其他的影响。

|
图 7 保守蛋白质结构域家族类生长激素 Figure 7 Growth hormone like family of conserved protein domains |
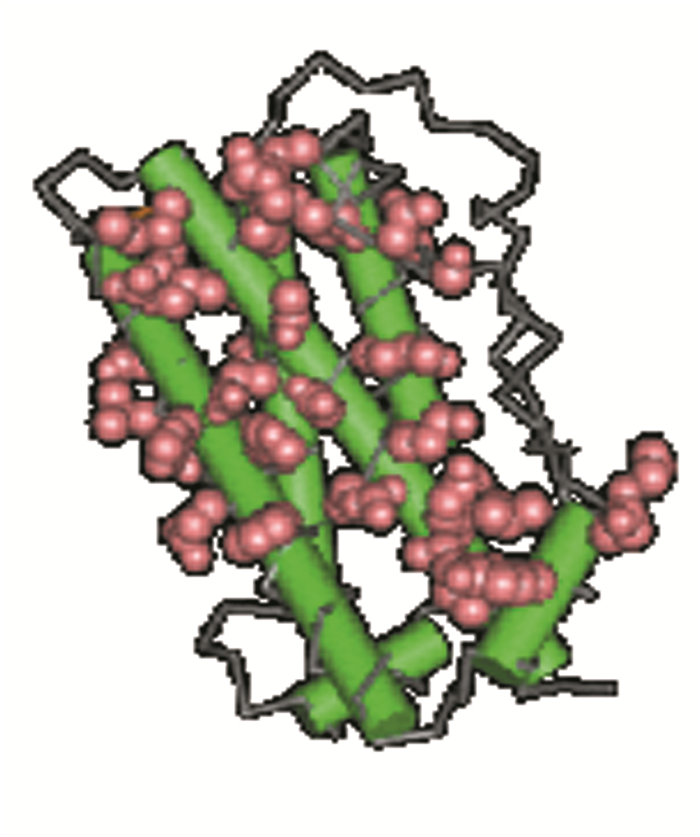
|
图 8 受体结合界面[多肽结合位点] Figure 8 Receptor binding interface [polypeptide binding site] |

|
图 9 保守结构域比对结果 Figure 9 Conservative structure and comparison results |
利用在线生物学工具SWISS-MODEL(https://swissmodel.expasy.org)进行同源建模预测蛋白质3D结构,结果获得GH蛋白三级结构模型(见图 10),该结果表明普氏野马GH基因呈“three-over-three”三明治夹心型折叠结构,由α-螺旋与无规卷曲构成,这与二级结构预测结果基本一致。

|
图 10 蛋白质3D结构 Figure 10 Protein 3D structure |
动物的生长发育研究一直备受科学家们的关注,其适应机制十分复杂。GH与生长关系密切,是生长可调节型表达指示器。目前,国内外对于动物的GH研究多见于大鼠、人、牛、绵羊、猪、猫、狗等,对于马属动物的研究相对较少,而GH基因在普氏野马身上表达特征的研究更是未见报道。因此本研究从DNA水平和蛋白质水平上分析普氏野马GH基因的结构与特性,为进一步研究其调控普氏野马生长发育机制的生物学作用奠定分子生物信息学基础。利用ExPASY ProtParam tool、Cell-PLoc 2.0、TMHMM Server v. 2.0、SignalP-5.0、SOPMA、SWISS-MODEL等生物学软件对GH序列结构、核苷酸组成及所编码的氨基酸进行了初步分析,并将其与多个各物种的GH氨基酸序列进行了BLAST比对,构建了包含普氏野马GH的系统发育进化树。普氏野马外显子数目、大小、位置与哺乳类其他物种相比, 表现出高度保守性[22]。普氏野马GH基因外显子在编码氨基酸时, 对同义密码子的使用表现有强烈的偏好性。不同物种对同义密码子使用的偏倚程度与偏好类型各不相同,也具有种属特异性。普氏野马GH基因所编码的蛋白质中,亮氨酸含量最高,达18.4%;色氨酸最低,为0.7%。此外,半胱氨酸的含量与其他哺乳类差别不大,而且半胱氨酸的位置在不同物种中高度保守,说明半胱氨酸对维持GH的空间结构起到极其关键的作用[23][24]。普氏野马GH基因不同区段进化速率不同,外显子区域进化速率最慢;内含子序列中碱基变异频繁,进化较快。利用NCBI在线比对功能对GH编码产物进行同源性比对,并对17个物种GH氨基酸序列进行系统发育进化树分析,发现普氏野马与家马在系统发育树中距离最近,其亲缘关系最为密切。同时进化树分枝显示普氏野马与人、大猩猩、猕猴等物种已形成明显的种间进化分歧。对GH蛋白质物理化学性质进行预测分析,结果显示GH蛋白具有较长的半衰期,其不稳定性指数为38.57,可认为是稳定蛋白。蛋白质半衰期与其稳定性之间存在密切联系,一般来说,半衰期长则蛋白质稳定性高,这一特性与其生理功能的发挥是否存在某种联系有待更进一步的研究和探讨。
3 结论1) 普氏野马与家马(GenBank: EU939446.1)GH基因序列相似性高达99.68%,属于同源序列。
2) 普氏野马GH基因序列中含有5个外显子和4个内含子,编码蛋白质的氨基酸数量为152个,分子量为17638.54 Da,理论等电点为9.01,半衰期较长,且属于稳定蛋白。
3) 普氏野马GH基因编码的是含有生长激素样结构域的蛋白质,GH蛋白质含有1个结构域,属于生长激素/催乳素激素家族,可对普氏野马的生长发育起调节作用。
| [1] |
ISHIDA N, OYUNSUREN N, MASHIMA S, et al. Mitochondrial DNA sequences of various species of the genus Equus with special reference to the phylogenetic relationship between Przewalskii's wild horse and domestic horse[J]. Molecular Biology and Evolution, 1995, 41: 180-188. (  0) 0) |
| [2] |
MYKA J L, LEAR T L, HOUCK M L, et al. FISH analysis comparing genome organization in the domestic horse (Equus caballus) to that of the Mongolian wild horse (E. przewalskii)[J]. Cytogenet Genome Research, 2003, 102: 222-225. DOI:10.1159/000075753 (  0) 0) |
| [3] |
王墨清. 普氏野马血像值测定[J]. 动物学杂志, 1996, 2(18): 50-52. WANG Moqing. Determination of hemogram value of Equus przewalskii[J]. Journal of Zoology, 1996, 2(18): 50-52. DOI:10.13859/j.cjz.cjz (  0) 0) |
| [4] |
杜迨先, 姚刚, 魏彬, 等. 普氏野马头骨观察研究[J]. 八一农学院学报, 1991, 14(3): 60-62. DU Daixian, YAO Gang, WEI Bin, et al. Morphologic study on skull of wild horse[J]. Journal of Bayi Agricultural College, 1991, 14(3): 60-62. (  0) 0) |
| [5] |
李乔, 赵建友, 杜晓华, 等. 普氏野马两种肠道寄生虫ITS序列的扩增与分析[J]. 农业生物技术学报, 2020, 28(7): 1277-1286. LI Qiao, ZHAO Jianyou, DU Xiaohua, et al. Amplification and analysis of ITS sequences of intestinal parasites in przewalskii's wild horse[J]. Journal of Agricultural Biotechnology, 2020, 28(7): 1277-1286. DOI:10.3969/j.issn.1674-7968 (  0) 0) |
| [6] |
李萍, 马志诚, 张琳, 等. 普氏野马血液生理参数测定及与家马的差异研究[J]. 生理解剖, 1995, 18(3): 42-45. LI Ping, MA Zhicheng, ZHANG Lin, et al. Determination of physiological reference values and comparation between Equus przewalskii and domestic horse[J]. Physiological Anatomy, 1995, 18(3): 42-45. DOI:10.19711/j.cnki.issn2310-1490.cnki.issn2310-1490 (  0) 0) |
| [7] |
ALEXANDER S L, IRVINE C H, ELLIS M J, et al. The effect of acute exercise on the secretion of corticotropin-releasing factor arginine vasopressin and adrenocorticotropin as measured in pituitary venous blood from the horse[J]. Endocrinology, 1991, 128: 65-72. DOI:10.1210/endo-128-1-65 (  0) 0) |
| [8] |
HADA T, ONAKA T, TAKAHASHI T, et al. Effects of novelty stress on neuroendocrine activities and running performance in thoroughbred horses[J]. Neuroendocrinol, 2003, 15: 638-648. DOI:10.1046/j.1365-2826.2003.01042.x (  0) 0) |
| [9] |
KUROSAWA M, NAGATA S, TAKEDA F, et al. Effect of caffeine on performance, cardiorespiratory function and plasma hormonal responses during exhaustive treadmill exercise in the thoroughbred horse[J]. Equine Science, 1998, 9: 33-43. DOI:10.1294/jes.9.33 (  0) 0) |
| [10] |
KUROSAWA M, NAGATA S, TAKEDA F, et al. Plasma catecholamine, adrenocorticotropin and cortisol responses to exaustive incremental treadmill exercise of the thoroughbred horse[J]. Equine Science, 1998, 9: 9-18. DOI:10.1294/jes.9.9 (  0) 0) |
| [11] |
NAGATA S, TAKEDA F, KUROSAWA M, et al. Plasma adrenocorticotropin, cortisol and catecholamines response to various exercises[J]. Equine Veterinary Journal, 1999, 30: 570-574. (  0) 0) |
| [12] |
RIVIER C, RIVEST S. Effect of stress on the activity of the hypothalamic-pituitary-gonadal axis: Peripheral and central mechanisms[J]. Biology of Reproduction, 1991, 45: 523-532. DOI:10.1095/biolreprod45.4.523 (  0) 0) |
| [13] |
TAYA K. Stress and reproduction[J]. Clinical and Translational Medicine, 1990, 8: 27-37. (  0) 0) |
| [14] |
TAYA K. Stress and prolactin[J]. Hor Front Gynecol, 2011, 18: 275-283. (  0) 0) |
| [15] |
NAMBO Y, OIKAWA M, YOSHIHARA T, et al. Effects of transport stress on concentrations of LH and FSH in plasma of mares: a preliminary study[J]. Equine Sciences, 1996, 7: 1-5. DOI:10.1294/jes.7.1 (  0) 0) |
| [16] |
ENDO Y, TSUCHIYA T, SATO F, et al. Efficacy of omeprazole paste in the prevention of gastric ulcers in 2 years old T horoughbreds[J]. Veterinary Medicine and Science, 2012, 74: 1079-1081. DOI:10.1292/jvms.11-0545 (  0) 0) |
| [17] |
MURRAY M J, GRODINSKY C, ANDERSON C W, et al. Gastric ulcers in horses: a comparison of endoscopic findings in horses with and without clinical signs[J]. Equine Veterinary Journal, 1989, 7: 68-72. (  0) 0) |
| [18] |
MURRAY M J, SCHUSSER G F, PIPERS F S, et al. Factors associated with gastric lesions in thoroughbred racehorses[J]. Equine Veterinary Journal, 1996, 28: 368-374. DOI:10.1111/j.2042-3306.1996.tb03107.x (  0) 0) |
| [19] |
TAYA K. Stress and prolactin[J]. Hor Front Gynecol, 2011, 18: 275-283. (  0) 0) |
| [20] |
THOMPSON D L, DEPEW C L, ORTIZ A, et al. Growth hormone and prolactin concentrations in plasma of horses: Sex differences and the effects of acute exercise and administration of growth hormone-releasing hormone[J]. Anim Science, 1994, 72: 2911-2918. DOI:10.2527/1994.72112911x (  0) 0) |
| [21] |
米晓钰, 李乔, 马睿, 等. 天祝白牦牛与黄牛NGB蛋白三级结构比较分析[J]. 生物信息学, 2021, 19(1): 55-65. MI Xiaoyu, LI Qiao, MA Rui, et al. Comparative analysis of tertiary structure of Ngb protein between Tianzhu White Yak and yellow cattle[J]. Bioinformatics, 2021, 19(1): 55-65. DOI:10.12113/202004003 (  0) 0) |
| [22] |
张焱如, 芒来. 马生长激素(GH)基因的PCR-SSCP研究[J]. 畜牧兽医学报, 2007, 38(3): 209-213. ZHANG Yanru, MANG Lai. PCR-SSCP study on horse growth hormone (GH) gene[J]. Journal of Animal Husbandry and Veterinary Medicine, 2007, 38(3): 209-213. (  0) 0) |
| [23] |
邹思湘. 动物生物化学[M]. 北京: 中国农业出版社, 2015: 30-55. ZOU Sixiang. Animal biochemistry[M]. Beijing: China Agricultural Press, 2015: 30-55. (  0) 0) |
| [24] |
王镜岩, 朱圣庚, 徐长法. 生物化学[M]. 北京: 高等教育出版社, 2002: 150-180. WANG Jingyan, ZHU Shenggeng, XU Changfa. Biochemistry[M]. Beijing: Higher Education Press, 2002: 150-180. (  0) 0) |
 2023, Vol. 21
2023, Vol. 21


