2. 聊城市职业技术学院,山东 聊城 252000;
3. 聊城市人民医院 转化医学实验室, 山东 聊城 252000;
4. 聊城市人民医院 内分泌科, 山东 聊城 252000;
5. 聊城市人民医院 病案信息科, 山东 聊城 252000
2. Liaocheng Vocational and Technical College, Liaocheng 252000, Shandong, China;
3. Laboratory of Translational Medicine, Liaocheng People's Hospital, Liaocheng 252000, Shandong, China;
4. Department of Endocrinology, Liaocheng People's Hospital, Liaocheng 252000, Shandong, China;
5. Medical Record Information Department, Liaocheng People's Hospital, Liaocheng 252000, Shandong, China
肺动脉高压(PAH-Pulmonary Arterial Hypertension)是一种罕见、致命的心血管疾病[1, 12-13],其预后较差,严重降低了患者的生存质量。肺动脉高压是由遗传、环境等多种病因共同作用导致的[12-13]。PAH临床特征主要是内皮功能障碍、血管细胞增殖、代谢紊乱和肺小动脉炎症等,肺动脉压升高和血管阻力增加,通常导致右心衰竭,严重者导致死亡[6-9]。PAH的血流动力学诊断标准mPAP ≥ 25 mmHg,同时肺小动脉楔压(Pulmonary Artery Wedge Pressure, PAWP)≤15 mmHg及肺血管阻力>3 Wood单位[14-15]。
肺动脉高压的发病机制较为复杂,目前尚不清楚,研究指出PAH涉及细胞功能异常、离子通道等多个生物过程,肺血管平滑肌细胞、内皮细胞、成纤维细胞及血小板等多个种类细胞异常参与其形成及进展,多种血管活性物质功能失衡促进其发生[6, 8, 14-15]。近年来已经发现PAH与Notch3、BMPR2、PTEN、ALK1等基因参与的信号通络和调节机制密切相关。但由于目前肺动脉高压样本较难获取,相关研究数据样本量较小,其疾病机理尚未阐述清楚。
炎症细胞侵润是肺动脉高压血管重塑的典型特质,这提示PAH可能与人体免疫机制相关[9]。新型冠状病毒肺炎(Corona Virus Disease 2019(COVID-19))是一种急性感染性肺炎,在全球范围内流行,其病原体是新型冠状病毒,之前未在人类中发现[2-5],具有较强的传染性。有研究指出COVID-19会通过多种机制影响患者的心血管系统,同时具有心血管疾病的患者为新型冠状病毒易感人群[16]。肺动脉高压作为心血管疾病的一种,其进展较快,如果患者一旦合并肺部感染,会加快疾病进程,使病情恶化,故COVID-19感染会加重PAH患者病情,为其治疗提出更多挑战。
为了更深入的探索PAH的发病机制,挖掘新型冠状病毒感染对PAH患者的影响机制,合并了多个PAH表达谱数据,并构建了PAH差异基因和冠状病毒相关免疫基因的互作网络,从而从系统生物学角度探索新型冠状病毒对PAH致病机理的影响,挖掘潜在的基因靶点,为肺动脉高压的研究和治疗提供新思路。
1 材料与方法 1.1 数据来源表达谱数据来自Gene Expression Omnibus(GEO- https://www.ncbi.nlm.nih.gov/geo/),编号分别为GSE113439,GSE117261,GSE131793,GSE17400。使用R包GEOquery下载相应数据集,并获取对应的芯片注释信息。本次实验共获得PAH表型及其对照数据129例,其中PAH数据81例,对照数据41例。蛋白质互作网络数据采用STRING[17]数据库的最新版本(V11.0),本次不考虑互作关系的方向,网络节点对应为gene symbol,统计得到网络中共包括16 073个基因,共500 111对互作关系。
1.2 数据预处理本次实验合并了3套关于PAH的数据,为了去除批次效应,提高后续分析数据的质量,使用R包sva[18]的经验贝叶斯模型ComBat对合并的数据进行去除批次效应,然后使用芯片平台注释文件解析为Gene Symbol表达数据,相同基因不同探针的表达数据使用均值进行合并,表达谱数据进行标准化。
1.3 PAH通络注释及功能网络构建使用GSEA[19]软件(V4.0.3)对较正后的表达谱数据进行功能富集分析,并使用limma[20]包,对表达数据进行差异基因筛选,错误发现率(False Discovery Rate, FDR) 设定为FDR < 0.01。
从蛋白质互作网络中提取出肺动脉高压差异表达基因相关的网络做为PAH功能相关网络,为了能抓取和冠状病毒毒性因子相关的基因互作关系,从PAH功能网络中提取出与其功能直接相关基因构成的网络,此背景网络作为研究肺动脉高压和新冠状病毒互作网络的基础背景。
1.4 SARS-CoV-2与SARS-CoV-1、MERS-COV的序列一致性比较有研究指出SARS-CoV-2的序列与SARS-CoV-1的序列具有较高的一致性[21],本研究通过全长的参考序列其核心蛋白质的序列一致性来进行验证。本次使用的数据包括SARS-CoV-2参考序列(NC_045512.2),SARS-CoV-1(NC_004718.3),MERS-COV(NC_019843.3),多序列比对使用Mega[22]和MAFFT[23](https://www.ebi.ac.uk/Tools/msa/mafft/)。
1.5 SARS-CoV相关功能基因挖掘及互作网络构建研究指出,SARS-CoV-2与SARS-CoV-1具有较高得基因组相似度,而且都通过ACE2基因影响人类的免疫基础功能[24]。所以本次使用GSE17400数据集,提取其主要的差异功能基因,然后注释其相关的功能通络。通络中主要的因子即为SARS-CoV-1病毒与人免疫互作的功能因子。这些功能因子作为新型冠状病毒侵入人体后的免疫因子。
从GSEA MsigDB数据中提取与SARS-CoV-1病毒因子及免疫相关的基因集合,然后从背景网络中挖掘二者互作的核心功能节点。使用软件Cytoscape V3.6.0对构建的网络进行可视化,网络模块分析采用cytoHubba[25]。
2 结果分析 2.1 PAH功能相关通路注释为了探索PAH发病机理,阐述其致病机理,文中使用经过校正的表达谱数据进行KEGG、BioCarta、PID、Reactome通路富集分析,并进行GO Biological Processes功能注释。筛选P < 0.01,|NES|>1的显著通路,结果显示,血管平滑肌细胞、成纤细胞等细胞异常通路与PAH的进展密切相关;此外转化生长因子-β信号通路、Wnt信号传导途径等信号转导通路也与PAH密切相关。细胞增值、T/B细胞参与的免疫反应,炎症反应等重要生物过程也与PAH紧密相关。筛选的部分显著通路,主要包括FOXP3 TARGETS IN THYMUS,TGFBETA1 IL6 IL23A CD4 TCELL,IFNA STIM STAT4 KO EFFECTOR CD8 TCELL,NFKB INHIBITOR TREATED HCMV INF MONOCYTE等通路(见图 1),这些通路涉及细胞信号调控,固有免疫反应,机体对外界刺激反应等重要的免疫生物学过程,这提示PAH的过程与机体免疫密切关联。
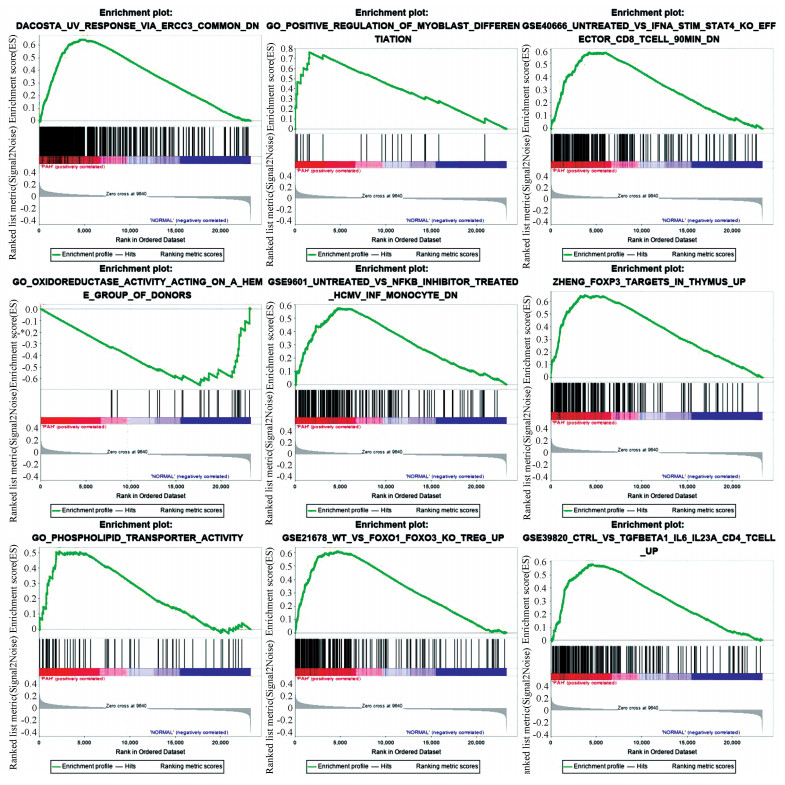
|
图 1 肺动脉高压功能相关部分显著通路及生物过程 Figure 1 Significant pathways and biological processes related to pulmonary arterial hypertension function |
使用R的limma包中的贝叶斯方法对处理后的数据进行差异表达基因筛选,显著性P < 0.01,通过筛选共得到179个差异表达基因,为了更好的阐述差异表达基因相关的功能机制以及相互作用,从STRING蛋白质互作网络中提取了差异表达基因相关的功能网络,共提取出与差异基因直接相关的18 087个基因,共138 807条互作关系对,这些互作关系对是肺动脉高压功能进展密切相关的,是肺动脉高压致病机理潜在的分子基础。
2.3 SARS-CoV-2与SARS-CoV、MERS-COV结构蛋白比对通过全长参考基因组序列的比对,发现与MERS-COV相比较,SARS-CoV-2的序列与SARS-CoV-1具有更高的相似性。为了验证是否在蛋白质水平也存在类似的结论,整理出了全长参考基因组的结构蛋白质序列,然后进行多序列比对,结果发现SARS-CoV-2和SARS-CoV-1的M、N和E蛋白具有90%以上的遗传相似性,而S蛋白的遗传相似性略有降低,达77.54%。通过基因组序列和结构蛋白序列比对,发现SARS-CoV-2与SARS-CoV-1具有更高的相似性(见图 2)。
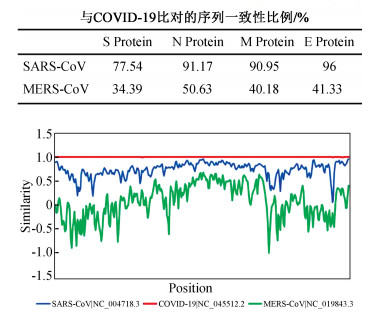
|
图 2 SARS-CoV-2与SARS-CoV-1、MERS-COV序列及结构蛋白相似性比较 Figure 2 Comparison of sequence and structural protein similarity between SARS-CoV-2 and SARS-CoV-1, MERS-COV |
SARS-CoV-1与SARS-CoV-2的平均序列相似性高达70%,SARS-CoV-1是通过与人的ACE2蛋白互作结合进入人体的[26]。新型冠状病毒S-蛋白中与人体ACE2蛋白结合的关键氨基酸有部分改变,但依旧维持了SARS-CoV-1的S-蛋白与ACE2蛋白互作的结构构象,所以COVID-19很可能通过ACE2蛋白影响人体的免疫反应[27]。有研究指出ACE2的表达主要与先天及后天免疫应答相关,与B细胞相关的免疫调节及相关细胞因子、IL8、IL16等密切相关[1, 9]。为了弄清SARS-CoV在感染人后对体内对生化过程的影响,我们使用GSE17400数据集的SARS-CoV-1感染12 h、24 h、48 h后的表达数据,分析其进展相关功能机制。发现SARS-CoV-1在侵入宿主后会激活机体的免疫反应,相关功能主要有病毒反应、病毒复制机制调控,同时还会影响细胞周期控制、细胞分化等重要生物过程。显著GO注释结果(见图 3)。
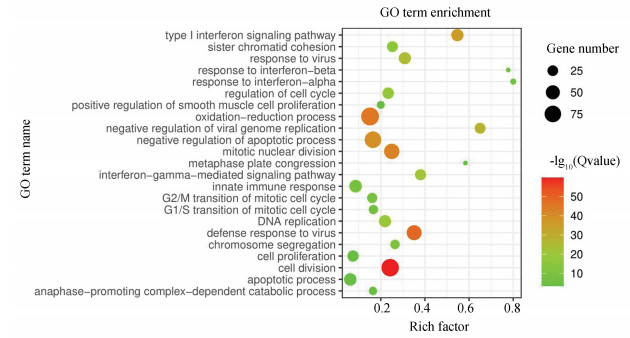
|
图 3 SARS-CoV-1侵染人体差异基因GO功能富集显著生物过程 Figure 3 GO function enrichment of significant biological process of SARS-CoV-1 infects human differential gene 注:图中圆点的大小代表富含差异基因的多少,颜色由绿到红代表显著程度. |
上述注释结果表明PAH差异表达基因与免疫应答相关通路密切相关,为了深入研究其具体的互作情况,整理出二者分别对应的基因列表,并进行统计,PAH差异表达基因112个,MSigDB中免疫应答相关基因2 916个,二者交集基因共328个(见图 4a)。PAH与正常组对比分析发现ACE2表达差异不显著(P=0.053), 但GSE17400数据分析发现,感染前后,及感染后12 h、24 h、48 h,ACE2表达差异显著(见图 4b, 4c)。为了探索病毒入侵宿主后,相关差异表达基因情况,统计GSE17400数据集的表达差异基因,并分别与PAH差异表达基因和免疫应答相关基因进行分析,共有4个基因同时参与三类生物学过程,具体情况。4个基因分别为ITGAM,SHMT2,PLAC8,CCR1。从统计结果来看,三者的交集相对较小,不利于深入探索COVID-19对PAH的影响机制,接下来我们通过蛋白质互作网络的形式进一步扩展核心基因,并从系统学的角度阐述其可能的发病和进展机理。
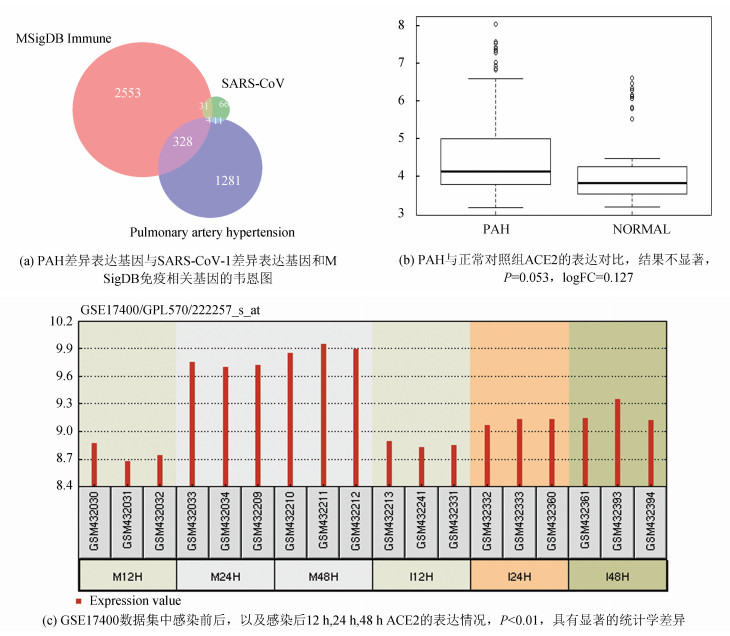
|
图 4 PAH和免疫相关基因以及SARS-CoV-1差异表达基因的分析 Figure 4 Analysis of PAH and immune related genes and SARS-CoV-1 differential expressed genes |
为了探索PAH的疾病进展与新型冠状病毒感染后的机体反应重要过程,从Molecular Signatures Database(v7.1)的GO生物过程中提取与机体免疫相关的生物过程,并综合免疫细胞因子、T/B细胞介导的免疫反应等过程的重要基因,与PAH的差异基因相关互作网络进行网络分析。本次构建的互作网络包含2 364个基因,共22 720条互作关系对。使用Cytoscape的cytoHubba插件进行网络分析,因为聚类系数代表了网络群体中“关系”重要的程度,故本次选择聚类系数较高的30个基因,作为互作网络中关键基因,进行后续核心功能解释和分析。
从网络的统计特性可以得到,提取的核心网络满足无尺度特性,少数调控基因在网络中起关键的调控作用。重要的基因如VCAM1,HBB,IL1R2,RNASE2,ITGAM,FGR等。在GeneCard数据库中查询相关基因的主要功能可知,这些基因参与信号调控,细胞免疫反应等重要生物学过程,在机体响应外界刺激,启动自身免疫及炎症等反应中起到重要的调控作用。核心网络(见图 5)。

|
图 5 肺动脉高压差异基因与冠状病毒感染后免疫基因蛋白质互作网络显著模块 Figure 5 Significant module of interaction network between differential genes of pulmonary arterial hypertension and immune genes and proteins after coronavirus infection 注:图中圆圈的大小代表节点在互作网络中的中国要程度;红色节点代表关键节点. |
肺动脉高压发病机制复杂,是由环境因素、遗传因素等多种病因共同作用而导致的肺血管阻力增加,病理改变的一类致死性较高的心血管疾病。PAH的预后较差,严重影响患者的生存质量。近几年,随着靶向用药的不断更新和普及,肺动脉高压的一年生存期提高了10%~20%,改善较为显著,但整体而言,其治疗效果仍不容乐观,究其原因是PAH的致病机理尚未研究清楚,这主要是因为PAH组织样本较难获取,样本量较小,全基因组范围内的研究较少等导致的。本研究合并了来自GEO数据库的三个同一平台的表达数据,深度挖掘PAH致病相关基因及信号通路。研究发现转化生长因子-β信号通路、血管平滑肌细胞、成纤细胞、细胞增殖及分化以及T细胞或B细胞介导的免疫反应与PAH的致病和发展紧密相关。
转录生长因子-β信号通路在炎症反应、细胞分化、固有免疫等生物过程中起到关键的作用,BMPR2基因编码BMPR-II,是骨形态发生蛋白配体的细胞表面受体,在与配体结合时,TGF-β II型受体磷酸化I型受体,导致调节SMAD的受体的磷酸化并被激活,然后与coSMAD复合并转移到细胞核以激活特定的转录程序[28]。CAV1作为细胞膜内的一种支架蛋白与CAV2形成稳定的复合物,并驱动caveolae的形成,CAV1参与T细胞受体介导的T细胞活化信号通路。KCNK3基因是编码钾通道蛋白超家族的成员,其编码的蛋白质是一个向外整流的通道,对细胞外pH值的变化较为敏感,并受到细胞外酸化的抑制。CAV1、KCNK3等基因变异是肺动脉高压相关的重要遗传因素。
炎症细胞浸润是肺动脉高压患者血管重塑异常的一个显著特征,这表明免疫效应细胞参与PAH的进展。通路富集分析发现PAH的进展与T/B细胞参与的免疫过成,固有免疫相关过程。SARS-CoV-2感染人体后,会引起发热、乏力、干咳呼吸困难等症状,这对PAH患者而言无疑是雪上加霜,所以探索PAH的免疫相关机制与人体内免疫过程,可能提示有效的基因靶点,从而有效的缓解和治疗PAH的症状。通过蛋白质互作网络研究发现HBB、ITGAX、VCAM1、CLEC7A、TLR8等基因在网络中发挥了重要的调控作用。
HBB参与固有免疫和红细胞吸收二氧化碳释放氧气等重要调控通路,参与氧气从肺部运输到周围组织的重要功能[29];此外还有研究指出HBB还参与疼痛和炎症反应等相关生物过程。ITGAX基因编码整合素αX链蛋白,该蛋白与β2链(ITGB2)结合形成白细胞特异性整合素,αXβ2复合物与αMβ2整合素在中性粒细胞和单核细胞与受刺激内皮细胞粘附功能相关。VCAM1在细胞识别过程中很发挥重要作用,同时在白细胞与内皮细胞粘附中起关键作用,与白细胞上的整合素α-4/β-1(ITGA4/ITGB1)相互作用,介导粘附和信号转导。另外VCAM1基因在免疫应答和白细胞迁移到炎症部位中起重要作用。
这些基因在肺动脉高压的发病及进展中起关键作用,并且这些基因在SARS-CoV-2侵染人体后的相关免疫中也发挥这重要的生物功能,这可能提示以这些基因为靶点,可能发现新的治疗药物,这对PAH机理研究和治疗有重要意义。
4 结论通过PAH表达谱数据,深入探索了PAH相关的遗传机制,同时通过蛋白互作网络,研究了冠状病毒感染相关的免疫相关基因与PAH致病机理相关基因的互作关系,发现了一些潜在的基因靶点,这对PAH遗传研究和挖掘靶向药物研究提供了新的研究思路。
1) 互作网络研究结果发现HBB、ITGAX、VCAM1、CLEC7A、TLR8等基因在PAH与机体免疫调控中发挥了重要作用,这可能是PAH合并冠状病毒感染患者的治疗提供了候选靶点。
2) 转化生长因子-β信号通路、T/B细胞介导的免疫通路等调控通路在PAH的发生和发展中发挥了重要的作用。
| [1] |
ZHOU L T, QIU S, LV L L, et al. Integrative bioinformatics analysis provides insight into the molecular mechanisms of chronic kidney disease[J]. Kidney and Blood Pressure Research, 2018, 43(2): 568-581. DOI:10.1159/000488830 (  0) 0) |
| [2] |
HUANG C, WANG Y, LI X, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China[J]. The Lancent, 2020, 395(10223): 497-506. DOI:10.1016/S0140-6736(20)30183-5 (  0) 0) |
| [3] |
KHAILAY R A, SAFDAR M, OZASLAN M. Genomic characterization of a novel SARS-CoV-2[J]. Gene Reports, 2020, 19: 100682. DOI:10.1016/j.genrep.2020.100682 (  0) 0) |
| [4] |
LI W, SUI J, HUANG I C, et al. The S proteins of human coronavirus NL63 and severe acute respiratory syndrome coronavirus bind overlapping regions of ACE2[J]. Virology, 2007, 367(2): 367-74. DOI:10.1016/j.virol.2007.04.035 (  0) 0) |
| [5] |
HE L, DING Y, ZHANG Q, et al. Expression of elevated levels of pro-inflammatory cytokines in SARS-CoV-infected ACE2+ cells in SARS patients: Relation to the acute lung injury and pathogenesis of SARS[J]. The Journal of Pathology, 2006, 210(3): 288-297. DOI:10.1002/path.2067 (  0) 0) |
| [6] |
AWAD K S, ELIONFF J M, WANG S, et al. Raf/ERK drives the proliferative and invasive phenotype of BMPR2-silenced pulmonary artery endothelial cells[J]. American Journal of Physiology Lung Cellular and Molecular Physiology, 2016, 310(2): L187-L201. DOI:10.1152/ajplung.00303.2015 (  0) 0) |
| [7] |
BONNET S, ROCHEFORT G, SUTENDRA G, et al. The nuclear factor of activated T cells in pulmonary arterial hypertension can be therapeutically targeted[J]. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(27): 11418-11423. DOI:10.1073/pnas.0610467104 (  0) 0) |
| [8] |
NASIM M T, OGO T, AHMED M, et al. Molecular genetic characterization of SMAD signaling molecules in pulmonary arterial hypertension[J]. Human Mutation, 2011, 32(12): 1385-1389. DOI:10.1002/humu.21605 (  0) 0) |
| [9] |
ELINOFF J M, MAZER A J, CAI R, et al. Meta-analysis of blood genome-wide expression profiling studies in pulmonary arterial hypertension[J]. American Journal of Physiology Lung Cellular and Molecular Physiology, 2020, 318(1): L98-L111. DOI:10.1152/ajplung.00252.2019 (  0) 0) |
| [10] |
YOSHIKAWA T, HILL T E, YOAHIKAWA N, et al. Dynamic innate immune responses of human bronchial epithelial cells to severe acute respiratory syndrome-associated coronavirus infection[J]. PLoS One, 2010, 5(1): e8729. DOI:10.1371/journal.pone.0008729 (  0) 0) |
| [11] |
曾绮娴, 熊长明. 肺动脉高压遗传基因研究进展[J]. 中华医学杂志, 2017, 97(8): 632-634. ZENG Qixian, XIONG Changming. Advances in genetic research of pulmonary hypertension[J]. Chinese Medical Journal, 2017, 97(8): 632-634. DOI:10.3760/cma.j.issn.0376-2491.2017.08.016 (  0) 0) |
| [12] |
伍洋子, 张旭, 张智伟. 肺动脉高压基因异常的研究进展[J]. 岭南心血管病杂志, 2018(2): 242-244. WU Yangzi, ZHANG Xu, ZHANG Zhiwei. Research progress of gene abnormalities in pulmonary hypertension[J]. Lingnan Journal of Cardiovascular Diseases, 2018(2): 242-244. DOI:10.3969/j.issn.1007-9688.2018.02.32 (  0) 0) |
| [13] |
张炜, 荆志成. 肺动脉高压遗传学研究进展[J]. 中华心血管病杂志, 2007, 35(11): 1063-1066. ZHANG Wei, JING Zhicheng. Advances in genetics of pulmonary hypertension[J]. Chinese Journal of Cardiology, 2007, 35(11): 1063-1066. DOI:10.3760/j.issn:0253-3758.2007.11.020 (  0) 0) |
| [14] |
DODSON M W, BROWN L M, ELLIOT C G. Pulmonary arterial hypertension[J]. Heart Failure Clinics, 2018, 14(3): 255-269. DOI:10.1097/MAJ.0b013e31815d2647 (  0) 0) |
| [15] |
COONS J C, POGUE K, KOLODZIEZ A R, et al. Pulmonary arterial hypertension: A pharmacotherapeutic update[J]. Current Cardiology Reports, 2019, 21(11): 141. DOI:10.1007/s11886-019-1235-4 (  0) 0) |
| [16] |
陈晨, 陈琛, 严江涛, 等. 新型冠状病毒肺炎危重症患者心肌损伤及患有心血管基础疾病的情况分析[J]. 中华心血管病杂志, 2020, 48: E008-E008. CHEN Chen, CHEN Chen, YAN Jiangtao, et al. Analysis of myocardial injury and cardiovascular basic diseases in critically ill patients with New Coronavirus pneumonia[J]. Chinese Journal of Cardiology, 2020, 48: E008-E008. DOI:10.3760/cma.j.cn112148-20200225-00123 (  0) 0) |
| [17] |
SZKLARCZYK D, GABLE A L, LYON D, et al. STRING v11: protein-protein association networks with increased coverage, supporting functional discovery in genome-wide experimental datasets[J]. Nucleic Acids Research, 2019, 47(D1): D607-D613. DOI:10.1093/nar/gky1131 (  0) 0) |
| [18] |
LEEK J T, JOHNSON W E, PARKER H S, et al. The sva package for removing batch effects and other unwanted variation in high-throughput experiments[J]. Bioinformatics, 2012, 28(6): 882-883. DOI:10.1093/bioinformatics/bts034 (  0) 0) |
| [19] |
SUBRAMANIAN A, TAMAYO P, MOOTHA V K, et al. Gene set enrichment analysis: a knowledge-based approach for interpreting genome-wide expression profiles[J]. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(43): 15545-15550. DOI:10.1073/pnas.0506580102 (  0) 0) |
| [20] |
GORDON S N. limma: Linear models for microarray data user's guide[M]. [S.L. ] The Walter and Eliza Hall Institute of Medical Research, 2005.
(  0) 0) |
| [21] |
CAO W, TAI S L. COVID-19: Towards understanding of pathogenesis[J]. Cell Research, 2020, 30(5): 367-369. DOI:10.1038/s41422-020-0327-4 (  0) 0) |
| [22] |
SUDHIR K, KOICHIRO T, MASATOSHI N. MEGA: Molecular evolutionary genetics analysis, version 1.01[CP]. University Park, PA: The Pennsylvania State University, 1993.
(  0) 0) |
| [23] |
MADEIRA F, PARK Y M, LEE J, et al. The EMBL-EBI search and sequence analysis tools APIs in 2019[J]. Nucleic Acids Research, 2019, 47(W1): W636-W641. DOI:10.1093/nar/gkz268 (  0) 0) |
| [24] |
DEVAUX C A, JEAN M R, DIDIER R. ACE2 receptor polymorphism: Susceptibility to SARS-CoV-2, hypertension, multi-organ failure, and COVID-19 disease outcome[J]. Journal of Microbiology, Immunology and Infection, 2020, 53(3): 425-435. DOI:10.1016/j.jmii.2020.04.015 (  0) 0) |
| [25] |
CHIN C H, CHEN S H, WU H H, et al. cytoHubba: Identifying hub objects and sub-networks from complex interactome[J]. BMC Systems Biology, 2014, 8(4): S11. DOI:10.1186/1752-0509-8-S4-S11.DOI:10.1186/1752-0509-8-S4-S11 (  0) 0) |
| [26] |
LU R, ZHAO X, LI J, et al. Genomic characterisation and epidemiology of 2019 novel coronavirus: Implications for virus origins and receptor binding[J]. The Lancet, 2020, 395(10224): 565-574. DOI:10.1016/S0140-6736(20)30251-8 (  0) 0) |
| [27] |
XU X, CHEN P, WANG J, et al. Evolution of the novel coronavirus from the ongoing Wuhan outbreak and modeling of its spike protein for risk of human transmission[J]. Science China Life Sciences, 2020, 63(3): 457-460. DOI:10.1007/s11427-020-1637-5 (  0) 0) |
| [28] |
NASIM M T, OGO T, AHMED M, et al. Molecular genetic characterization of SMAD signaling molecules in pulmonary arterial hypertension[J]. Human Mutatation, 2011, 32(12): 1385-1389. DOI:10.1002/humu.21605 (  0) 0) |
| [29] |
MAÑÚ PEREIRA M D, ROPERO P, LOUREIRO C, et al. Low affinity hemoglobinopathy (Hb Vigo) due to a new mutation of beta globin gene (c200 A>T; Lys>Ile). A cause of rare anemia misdiagnosis[J]. American Journal of Hematology, 2017, 92(4): E38-E40. DOI:10.1002/ajh.24649 (  0) 0) |
 2022, Vol. 20
2022, Vol. 20

