作者曾于生命信息安全控制原理探讨的基础上[1],在《生命信息安全控制原理的再探讨》一文中将该机制归纳形成了一个生命信息安全控制原理图[2],接着在生命机体与危险因子间建立了一个生命物质信息对话平台[3]
1 整体结构性图形构想表述与解析由图 1(a)(三视图为圆台形)、1(b)(正视图为梯形)、1(c)(俯视图为同心圆)可见,生命信息安全控制体系由2大部分构成,即内在部分与外延部分。前者由特异性识别系统(适应性识别方式)、泛特异性识别系统(古老固有识别方式)、皮肤与黏膜(属纯粹组织学性质的连接部)和共生微生物(位于基底层)4个层次(以实线标示)构成;后者即外环境开放接触面(以虚线标示)。在此需要特别注明的是,内在部分各部间以及与外延部分之间存在物质、能量、信息交流沟通传递的空间界面,并以粗实线条标识。3个图形中共同的存在一个中心轴,以虚线标示,即生命信息安全控制轴。
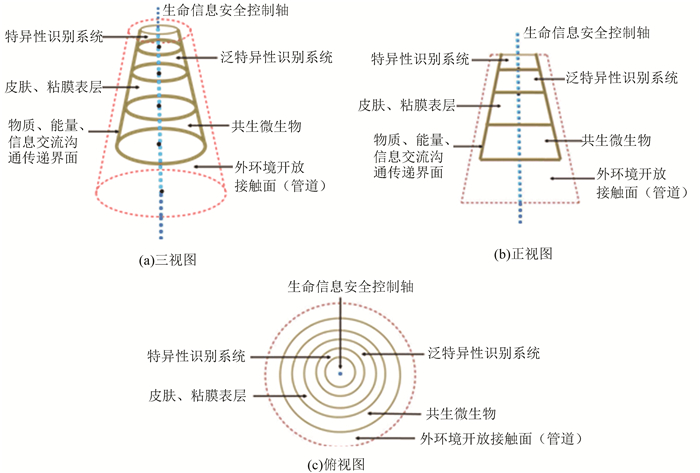
|
图 1 生命信息安全控制体系整体结构图示 Figure 1 Sketch map of system structure on the life information security control system |
特异性识别系统与泛特异性识别系统,这样二个层次在本系列图形中是以抽象而笼统、概括的概念所作的图形安排(设计),众所周知,其又是具体而有着极为复杂丰富内容所指的。皮肤与黏膜组织在本系列图形中是以纯粹解剖学性质所作的设计,这里需要说明的是,在皮肤与黏膜中既有泛特异性识别存在,又有特异性识别存在。在图形设计构思过程中,将特异性识别系统及泛特异性识别系统与共生微生物层次联系起来,其中安排皮肤与黏膜组织这个层次,这是基于,也是符合宏生物与微生物之间实际存在的客观事实情况。皮肤与黏膜组织在整个系统中所占分量仅次于共生微生物(体系中份额最大的层次),在功能性质上具有极其重要的生物学地位,不仅是指重要性上,特别其所占份额比例上也是比想象的大。在此必须有上述说明,因为本系列图形本身就是一个高度抽象观念的,其意义旨在将体内一个结构极其复杂、内涵超级丰富、不一定连续成一体且广泛分散分布、遍布机体所有细胞及细胞外环境的功能系统,以较为明了的几何立体结构图形呈现系统的实质组成和内容,也很难有一个万全的形式去表述如此庞大而复杂的体系。
从高层次看,特异性识别系统处在系统的最高位置,其次位是泛特异性识别系统。特异性识别系统是高级表现形式,也是生物进化高级发展的结果,由此很自然,其理所当然会处在体系图中的最顶端。泛特异性识别系统所处的位置,在此不用多赘言。特异性识别系统从总体上看是依靠着并建立在泛特异性识别系统之上的。从份额比例上看,泛特异性识别系统较之于特异性识别系统要更宽广。
综上解析,生命信息安全控制体系整体结构设计成一个圆台形,是合符各个层次份额比例所决定的,而且层次安排顺序也是合理的,这也许就是自然生成逻辑的结果,同时也寓意着整个体系的安全稳定性。
2 泛特异性识别系统与特异性识别系统结构特征以及彼此相关关系特异性识别系统与泛特异性识别系统是生命信息安全控制的两个重要平台(见图 1(b)),也是整个体系的两个核心要素,在某种意义上可以说,舍此再没有其他要素可言。
2.1 泛特异性识别系统所谓泛特异性,与天然免疫、固有免疫是同等的一类概念。泛特异性识别系统包括范围极其广泛,其中涉及模式识别受体(Pattern recognition receptor, PRR)、抗微生物肽(Antimi-crobial peptide,AMP)、防御素(Defensin)、补体系统以及其它诸多生物分子。
2.1.1 PRR[3]所识别的有两大类,即病原体相关分子模式(Pathogen associated molecule patterns,PAMPs)和损伤相关分子模式(Damage associated molecule patterns,DAMPs)。前者有微生物的保守性结构信息(如细菌甘露糖、脂多糖、肽聚糖、脂磷壁酸、鞭毛蛋白、胞壁酸等各种细菌的细胞壁成分等)、微生物生理产物信息(如病毒dsRNA、病毒ssRNA、病毒和细菌的非甲基化CpG DNA及弓形虫的穿孔素样分子等),后者即机体受到损伤后形成的信息物质。另外,NK细胞对由变应因素诱导产生的信息分子进行受体识别。
2.1.2 AMPAMP据知多达1 500多种,具有广泛的抗微生物作用,有与TLR共同构成泛特异性识别系统“双臂”之称[4]。其中阳离子肽的分布最为广泛,具有两亲性(Amphipathic)特点。此外,还有阴离子肽、芳香族肽、氧结合蛋白和富含某种氨基酸的肽等。在高等有机体中,AMP主要产生于上皮细胞(存在于黏膜上皮细胞分泌黏液中,构成一种重要的黏膜保护成分)、天然防御性细胞及淋巴细胞系统。AMP对病原因子的作用效应具有快速反应机制(几分钟之内发生响应),具有广谱抗击作用,其抗击对象有G+菌、G-菌、真菌、寄生虫、囊膜病毒及肿瘤细胞。AMP附着在微生物表面,从而使附着的微生物更易被吞噬细胞识别、吞噬。某些AMP能激活宿主细胞产生趋化因子、趋化因子受体、整合素等,因而具有引发炎性应答的作用。来自脊椎动物的AMP除抗菌功能外,还有介导趋化作用、细胞凋亡作用以及血管生成作用。AMP根据结构特征可分为:α螺旋、富含半胱氨酸、β片层、富含常规氨基酸及含少量修饰氨基酸这样5大类[5]。其中Cathelicidin家族哺乳动物中已发现多种,但人体目前仅发现一种,即LL-37。其对G+菌和G-菌抗菌作用机理:细菌脂多糖或磷壁酸等带有负电荷,LL-37的阳离子螺旋二级结构带正电荷,通过电荷吸引,结合到细菌细胞膜表面,随后LL-37穿过细胞外层膜到达内层细胞膜,并引起细胞膜的破坏,导致细菌死亡。LL-37主要在黏膜表面和皮肤表面起作用[6]。
2.1.3 防御素[7]防御素是广泛表达的古老的防御机制,以其阳离子多肽分子与细菌表面带负电荷部分作用,首先是通过带正电荷的氨基酸残基与带负电荷的细菌细胞膜通过静电吸附作用结合,然后在已形成的跨膜电动势趋动下, 以多聚体方式插入细胞膜,细菌细胞膜发生不可逆的损伤, 形成的离子孔道使内含物外泄,而其它物质进入细胞内,破坏了细菌细胞生活的平衡, 导致细胞死亡。
2.1.4 补体系统[8-9]补体受体3(Complement receptor 3,CR3)除了可识别内源性配体如C3bi、细胞外基质蛋白、凝聚蛋白、细胞间黏附分子-1、细胞间黏附分子-2等外,还能与许多外源性配体,如多种蛋白和非蛋白性质的微生物及其产物结合,具有广谱配体识别能力,具有很强的信号转导能力,通过激酶级联反应和细胞骨架重排途径传导信号,从而激活白细胞的抗微生物功能,能协同激活其它重要的黏附和防御受体或直接与其它受体协同作用。备解素(Properdin)作为一种PRR识别细菌的表面以及凋亡、坏死细胞,与这些靶标结合,能够启动C3转化酶、C5转化酶的形成,导致吞噬或溶解。其机制直接结合细胞膜表面蛋白聚糖的黏多糖链,无需其它补体蛋白的参与即能介导吞噬摄取。补体成分C3b以及甘露糖结合凝集素(MBL)结合细菌成分以激活补体旁路途径以及MBL途径发挥溶菌效应。MBL由胶原样结构域和糖类识别域组成,糖类识别域在Ca2+存在下结合甘露糖和N-乙酰葡萄糖胺。胶原样结构域结合MBL相关的丝氨酸蛋白酶(MASP)形成复合物。MBL-MASP和微生物表面糖蛋白结合,MASPs获得蛋白水解活性并分解C4、C2和C3,这种补体激活途径称为补体激活的凝集素途径。
2.1.5 其它主要有肽聚糖结合蛋白(Peptidoglycan-recognition protein,PGLYRPs)、CD14、清道夫受体(Scavenger receptor,SR)、淋巴细胞活化信号分子(Signaling lyphocyte activation molecule,SLAM)、巨噬细胞甘露糖受体(Macrophage mannose receptor,MMR)、MR、脂多糖识别蛋白[抗菌/通透性增加蛋白(Bactericidal /permeability-increasing protein,BPI)和脂多糖结合蛋白(Lipopolysaccharide-binding protein,LBP)]、凝集杀菌素(Lecticidin)、弹性蛋白酶抑制物、C型凝集素、铁代谢蛋白、乳铁蛋白、溶菌酶、纤维胶凝蛋白(Ficolin)及趋化因子等。肽聚糖结合蛋白由多个肽聚糖识别(PGR)基序构成,PGR结构域有酰胺酶活性。结合在细菌的肽聚糖层,通过水解肽聚糖或促进细菌调理化杀菌[4]。CD14作为LPS的受体。CD14不仅是LPS的受体,识别、结合LPS或LPS/LBP复合物,还可作为G+菌和G-菌等其它产物的受体,识别并结合分枝杆菌的脂肪阿拉伯甘露聚糖、G+菌细胞壁成分——可溶性肽糖和磷壁酸等,激活单核细胞,介导一系列生物学反应[10]。巨噬细胞的SR结合G+菌细胞壁脂磷壁酸成分、G-菌细胞壁脂多糖成分及整个细菌,以此作为吞噬受体清除入侵病原因子[11]。SLAM为巨噬细胞调控G-菌杀伤的微生物识别分子。其机制与细菌外膜蛋白OmpC和OmpF接触后,调控NADPH氧化酶NOX2复合物的活性和吞噬小体的成熟[11]。MR是细胞表面的跨膜蛋白、钙离子依赖的凝集素,属于多凝集素受体,识别细菌细胞壁上的甘露糖苷成分。其识别机制与MBL类似,并且每个受体分子具有多个识别结构域,其效应于结合配体后引发吞噬作用。此外,通过参与受体介导的内吞作用和吞噬作用、来维持内环境的稳定,在维持内稳态、诱导细胞因子、抗原递呈等过程中发挥重要作用,由此组成机体的一种防御系统。MR还可以识别细胞壁的多糖成分,如酵母甘露聚糖、细菌荚膜、LPS和脂质阿拉伯甘露聚糖,Mφ可通过MR来吞噬许多非调理素化的微生物, 包括细菌、真菌和原生动物等。Mφ的MR识别病原体后, 可导致细胞活化, 使超氧化阴离子释放增加, 并诱导细胞因子的合成[12]。BPI由N端、C端和富含脯氨酸的21个氨基酸残基形成的中间连接单位这三部分组成。N端功能是杀菌、结合/中和LPS,C端具有膜锚定功能,保护BPI不被胞内酶消化降解,调理吞噬及部分中和LPS。BPI为带正电荷的阳离子蛋白,以静电作用和吸水作用与LPS结合,导致LPS在菌体上正常排列被破坏,由此细菌体通透性显著增强以至细菌体裂解,于是造成细菌亚致死(早期,可逆)和致死效应(晚期,不可逆)[13-14]。凝集杀菌素属于分泌性C型凝集素,含有碳水化合物识别结构(Carbohydrate recognition domain,CRD),与溶菌酶一样主要作用于肽聚糖,因此优先杀伤G+菌[8]。
2.2 特异性识别系统[3]主要包括2个方面:即B细胞的BCR以及抗体,即抗原识别系统。另外,T细胞识别系统。基于抗原一词最初的意义,在此将需要信息承载分子(如MHC、CD1及MR1等)递呈的抗原物质冠之为抗原样(Antigen-like),以示明确与抗原一词最初的意义有所区别,所以T细胞识别系统为抗原样识别系统。
2.3 相关关系由图 2所示,整体系统信息、物质、能量的运行始于泛特异性识别系统,其中以PRR对PAMP和DAMP的识别过程;以PGLYRP、CD14、SR、SLAM、MMP、BP1、LBP及Lecticidin等为代表的元件动态过程产生诸多系列效应,其中主要有:识别、杀伤作用、趋化作用、调理作用、抗原递呈、细胞凋亡、吞噬作用、活化细胞及血管生成等。上述层面运行获得危险因子信息,以MHC-P、共刺激及细胞因子共同组合的形式向特异性识别系统传递危险因子信息,并激活特异性识别系统。特异性识别系统主要由T细胞系统与B细胞系统两大组件构成。泛特异性识别系统经MHC-P将信息传递给TCR,危险因子以抗原的形式将信息传递给BCR。T细胞的活化依赖于B细胞的抗原递呈和特异性抗体的产生。作为专职抗原递呈细胞(Antigen presentation cell,APC),B细胞递呈的抗原是非专职抗原递呈细胞的103~104倍。B细胞系统以MHC-P、共刺激双信号递呈并活化T细胞系统,而T细胞系统反馈B细胞系统,即释放细胞因子、提供活化信号。

|
图 2 特异性识别系统与泛特异性识别系统的相关关系 Figure 2 Correlation between specific and pan-specific recognition systems |
众所周知,机体是一个共生微生物的载体。人类微生物基因组计划(Human microbiome project,HMP)的研究进展表明[4],人体微生物的数目10倍于人体细胞的数目,人体微生物基因组的数目则百倍于人体基因组的数目。这其中包括细菌,真菌(酵母)及病毒等。共生微生物分布于机体的皮肤及黏膜(包括口腔,消化道,呼吸道,生殖道等部位)。在肠道中就有近千种微生物寄宿或通过,据估计成人肠道内约有1013~1014个共生菌[15]。肠道为微生物提供最佳的生存环境,机体与这些微生物通过彼此亿万年间协同进化形成互惠互利的共生复合体。
研究表明[16],无菌动物的淋巴组织的情况,由于缺乏生活的微生物所产生的刺激,致使胸腺、法氏囊、肠壁上的淋巴滤泡的发育迟缓;脾脏小,无二级滤泡;淋巴小结内缺乏生发中心。胸腺重量一般明显低于普通动物。胸腺髓质以小淋巴细胞为主,皮质细胞结构疏松、淋巴细胞少;脾脏组织重量轻,滤泡周边细胞发育差,生发中心几乎不可见,红髓巨噬细胞稀少。周围淋巴结体积小、重量轻,肠系膜淋巴结尤为明显,周围淋巴滤泡界限不明显,生发中心不发达,巨噬细胞少见,以小淋巴细胞为主。吞噬细胞活性和体内的免疫球蛋白水平相对较低。小肠免疫系统发育成熟依赖于共同进化宿主特定的微生物,T淋巴细胞、B淋巴细胞、单核巨噬细胞、M细胞的激活以及发挥作用的过程均与微生物有关。据此表明,生命信息安全控制体系的发生、发育及成熟是基于共生微生物的存在。也就是说,生命信息安全控制体系的产生是建立在共生微生物层次的基础上的。因而清楚地表明,共生微生物层次是生命信息安全控制体系一个有着举足轻重的大组分。可以想象,共生微生物层次的变数将主导生命信息安全控制体系的安危与稳定,这样共生微生物层次在图形中位于基底层是科学而合乎实际的设计安排,因为它是整个体系的基座。
4 黏膜与皮肤的特征以及功能作用 4.1 黏膜的特征以及功能作用黏膜表面面积约有1.5个网球场大小,约为皮肤面积的200倍[17]。黏膜相关淋巴组织(Mucosa-associated lymphoid tissue,MALT)由肠相关淋巴组织、鼻咽相关淋巴组织,支气管相关淋巴组织以及生殖泌尿道黏膜相关淋巴组织、耳中的黏膜相关淋巴组织、眼内的黏膜相关淋巴组织组成[18]。其功能以持续性防御病原体的攻击。MALT包括黏膜诱导部位和黏膜效应部位,二者之间通过黏膜网络相联系[19]。
在诱导部位初次遭遇抗原后启动初始免疫应答,这样黏膜T细胞、B细胞在既定的诱导部位激活后诱生出效应细胞,即被激活的淋巴细胞经淋巴和血流迁移到各黏膜效应区,然后在黏膜效应部位完成向效应Th细胞、CTL细胞和浆细胞的分化。由此,可能来源于一个诱导部位,由于抗原激活淋巴细胞所产生的应答就能够给多重广泛的黏膜效应区提供防御效应,形成共同黏膜免疫系统(Common-mucosal immune system,CMIS),即黏膜移行系统(Mucosal migration system,MMS)。该系统中,黏膜B细胞通过共享黏膜归巢受体的调控,经血液和淋巴系统迁移到效应部位。在归巢受体介导下,Peyer氏结中致敏的淋巴细胞移行到致敏部位的肠黏膜上皮和固有层,或移行到肠黏膜外效应部位[20]。
肠道黏膜上皮细胞间有规律地分布有M细胞。M细胞具有转吞作用,即从肠腔摄取分子和颗粒,以囊泡形式转移到细胞基底面,释放到细胞外空间。M细胞以巨吞饮、网络蛋白介导内吞或吞噬内化病原体。M细胞下方集结有巨噬细胞、未成熟树突状细胞(Immature DC,IDC)、初始T细胞和初始B细胞以及Treg细胞、Th3调节性T细胞。肠滤泡生发中心内包含激活的B细胞和滤泡树突状细胞(Follicular dendritic cell,FDC)。肠道受感染时,IDC捕获病原体抗原,然后IDC进行抗原递呈过程[5]。
肠相关淋巴组织(Gut-associated lymphatic tissue,GALT)中存在不同亚型的树突状细胞(DC),肠道炎症时,于病原体侵袭场所,GALT IDC以PRR识别PAMP,而后IDC转变为成熟DC,成熟的DC促使黏膜中的初始T细胞特异性的活化。正在成熟的DC也能从Peyer氏结穹顶区迁移至肠的引流肠系膜淋巴结。由于成熟DC的抗原递呈活化初始T细胞和初始B细胞,而后引起全身应答反应。Peyer氏结内的浆细胞样DC能通过分泌IFNα或IFNβ参与肠道的防御反应[18]。
由于Peyer氏结IDC的诱导,产生了对共栖菌的特异性分泌型sIgA,形成了阻止共栖菌渗入黏膜的效应。正是由于这种特异性分泌性sIgA产生机制,形成了一个常态效应,即肠腔中潜在的病原体或者共栖菌不会对机体造成危害,侵袭者被sIgA阻止不能穿越上皮组织。大部分机体活化的B细胞能够转换为sIgA的多聚sIgA,这种外分泌型Ig是黏液和其它分泌液(如唾液、泪液等)中的重要成分,其功效在黏膜表面发挥针对试图侵袭或毒害上皮细胞的病原体或毒素的中和作用。另外其还有一些重要性质:sIgA分子中的糖类成分能够与病原体表面表达的黏附分子相结合,因而成为能捕获侵袭者的一种方式;基于sIgA不能激活补体系统,因而限制了补体系统级联反应的损伤性炎症效应;存在于黏液中的sIgA对蛋白酶类不敏感,因而其表现出常态的稳定性。这样sIgA——包被机体黏膜抗体的持续产生形成的抵御作用,实现了保护黏膜、维持内环境稳态效应[8, 21]。
机体维持肠道常态形成了两套机制,即sIgA在肠腔中排斥微生物,使之难以接触或无法侵入肠黏膜。另外,抑制对肠腔无害抗原的过度应答,肠系膜淋巴结在DC提供的抗原刺激下产生大量调节性T细胞,降低对食物抗原和共生菌的应答[8]。
位于机体最前线的黏膜系统,赋有特殊的机制,一方面保障机体的安全防御,另一方面于通常情况下以维持黏膜的正常稳定状态。肠道黏膜应答系统在对“无害”抗原的包容机制和对“有害”抗原的激活应答中必需处于微妙的平衡,才能维持机体健康。因此准确识别有害、无害抗原以及对有害抗原产生迅速有效的应答反应对机体来说至关重要。
由肠道杯状细胞分泌的黏液形成物理屏障,所分泌的黏蛋白是肠道固有应答第一防线黏液层的主要组成部分。黏蛋白类对维持肠黏膜动态平衡、调控微生物-宿主应答反应起着重要作用。杯状细胞数从十二指肠尾端的4%增至末端结肠的16%,这与微生物有机体的数目从近端肠段到结肠逐渐增加的情势呈正相关。肠道黏液屏障是一个复杂的结构,由肠道杯状细胞所分泌的黏蛋白与水、无机盐、抗菌肽等共同组成黏稠的凝胶型网状结构黏液层,是胃肠道抵抗内外源性刺激及致病菌侵入的第一防线。肠道黏液层有两层,即外层为疏松黏液层,是共生菌定居的部位;内层为紧密附着黏液层,以“过滤器”的形式阻止微生物渗入。黏蛋白是覆盖于肠道表面黏液层的主要组成部分,通过隔离肠道微生物与宿主上皮细胞、淋巴细胞的接触,可有效防止肠道过度炎性反应,对维持黏膜稳态起着重要作用[22]。
柱状上皮细胞的顶端表面有紧密连接(Tight junction)和黏着连接,这些连接将细胞间隙与肠腔分隔。细胞之间的黏附结构由蛋白复合物组成,其中有封闭蛋白、闭锁小带-1和闭锁小带-2(Zonula occludens,ZO-1/2)及Claudin封闭蛋白家族。促炎性细胞因子,如IFN-γ下调连接蛋白组分ZO-1的表达。这种上皮细胞中封闭蛋白表达的下调(在肠道炎症中),增加细胞间的通透性,以利中性粒细胞的渗出[17]。
各种TLR配体中以LPS为代表,这LPS不仅为病原菌体成分,而且也是肠道中大量存在常在共生微生物的菌体成分,所以必须有一个与之相适应的特殊的机制系统,以面对大量存在的常在微生物,需要实现维持黏膜系统通常性正常稳定的状态。为此上皮细胞方面所呈现的是,显著降低以LPS等为配体的TLR的表达,从而形成一种包容机制状态。另一方面,上皮细胞还表达负调控TLR信号分子,如Tollip(Toll-interacting protein),以此抑制肠道应答的过度活化[23]。不仅在上皮细胞,而且肠管存在的DC几乎不表达TLR4(LPS受体),而代之高表达识别鞭毛的TLR5。这样可以避免由常在菌所产生的LPS引起的DC的过度活化,同时增强识别具有鞭毛的病原菌的防御机制,以调控维护常规性稳定与机体防御两者间的平衡。
4.2 皮肤的特征以及功能作用[24]皮肤是机体与外环境接触的界面,也是众多微生物的栖息地。皮肤由表皮层、真皮层及皮下脂肪组织构成。表皮包括基底层、棘层、颗粒层以及最外层的角质层,其中角质层是皮肤至关重要的生理屏障。表皮内还分布有黑素细胞和朗格汉斯细胞(Langerhans cell,LC)。少量的T细胞(主要是CD8+T细胞)存在于基底层和棘层中。真皮由胶原纤维、弹力纤维、网状纤维、血管、淋巴管和神经组成。真皮内分布有多种淋巴细胞,其中有真皮DC和浆细胞样DC及CD4+Th1细胞、CD4+Th2细胞、CD4+Th17细胞、γδT细胞和NKT细胞。此外,真皮内还存在巨噬细胞、肥大细胞和纤维母细胞。
角质形成细胞作为皮肤防御系统的第一道屏障能通过产生抗菌肽、细胞因子和趋化因子等机制迅速对有害刺激发生反应并预警皮肤内其它淋巴细胞。角质形成细胞组成性表达TLR,通过TLR和炎症复合体等预警系统感知危险因素。皮肤DC分为表皮内LC和真皮内DC,均为专职APCs。
5 外环境开放接触面效应影响如讨论中所述,如果说人体被视为由人类自身细胞与微生物细胞构成的超有机体,其间所呈现的景观是微生态学性质,那么体系的外延部分,即外环境开放接触面就是宏观层面上的生态学性质,这里不仅仅有生物学因素的影响,更有理化因素所产生的效应。由于篇幅所限,在此就不作详述。
6 讨论1975年,意大利学者Giuseppe Longo在《信息论:新动向和未解决的问题》中论述:在整个人类历史中,至少在西方的哲学中,一直有这样一种思想,认为图形、结构和关系比物质和能量更为本质[25]。学者张长琳在论述《易经》时说[25]:“东方的《易经》是一本科学书,是一本天文和数学书。在这一数学系统中,元素并不重要,重要的是元素的组合关系、关系的变换以及这些关系的谐和。”他进一步认为[25],这本数学书讨论的就是整体论的数学变换关系。
今天的科学在许多方面与上述一期史前文明精神相反,所谓实证科学忽视总体、整体,重视细枝末节,认为把握整体的关键是分化。实际上,由于分得太细,而无法还原到整体,以至于实证科学发展的结果,已经无法把握整体,其局限性一目了然。
本次正是基于《整体论》的思想,以建构图形表述和揭示生命信息安全控制的实质内涵,旨在探讨出更为简略而直观、明了的结构图形,从而首先是把握体系及系统的整体性观念,然后以此展延开相关事件的分析思维。
本次构建的图形中,生命信息安全控制轴,其属性为不可见,其存在是形而上的。这其中的关系是“致虚极,守静笃”的关系。这里的“致虚极”是指整体结构性的生命信息安全控制(即观妙),而“守静笃”是指各个层次之间彼此保持有序性而不紊乱,营造出动态平衡的景象(即观徼)。
老子在《道德经》中说:“常无欲以观其妙,常有欲以观其徼”。人们在几何作图时“致虚极”,是对图形空间的基点和覆盖问题,以非直接观察思维“观妙”,“守静笃”则是人的思想状态与图形整体运行状态保持一目了然的覆盖关系,以直接观察思维“观徼”,这样人的认识会形成更深层的理论关系,即主观思维逻辑与客观自然逻辑保持同步和一致[26]。本次对生命信息安全控制体系从其整体性构思建构的空间结构图形,其中的“生命信息安全控制轴”的勾画正是“观妙”后非直接观察思维的理解,是对无形信息主观特定设置的承载关系并以符号加以表达。而4个层次构成的内在部分与外延部分的设计正是“守静笃”直接观察思维“观徼”的结果,是对有形信息实物承载所加以的体现。
机体的应答始于生命信息的受理与识别,基于识别方式时间的及时性与精度的专一性,大抵分为特异性识别系统和泛特异性识别系统。该二个系统的相关关系,本次由图 2仅举一例,简略地作了勾画与标识,以展示各生物分子所在的位置以及功效反应、趋向,以反映彼此空间界面中物质、能量、信息交流沟通传递情况,其效果在于更为明了而直接观察理解其中的实质内容与过程、变量。是否可以图 2为范例,成为一个分析模型用,根据具体生物学效应变化过程,在这个模型中勾画与标识内容、使用用件,以此有助于更清晰直接的分析与理解。
21世纪初人类基因组的研究表明,与人类共生的微生物参与了人类细胞社会的构成及其进化历程,就此意义,应该将人体视为由人类自身细胞与微生物细胞构成的超有机体(Superorganism)[4]。由此有理由推论,皮肤与黏膜的形成是与共生的微生物共进化形成的一个合理的结局。在组织学层面上,共生微生物直接与机体的皮肤、黏膜联系着。包括有共生微生物层次在内的生命信息安全控制体系是生物亿万年共进化的自然生成逻辑的结果。《易经》经典之语:一阴一阳之谓道。据此可以换一个角度理解,如果没有共生微生物这个层次的存在,整个安全控制体系似乎将显得毫无意义,事实上共生微生物这个层次,其与机体彼此形成完全不可分割的关系,只要讨论生命信息安全控制体系,就一定撇不开共生微生物这个层次。
| [1] |
谌南辉. 生命信息安全控制原理的探讨[J]. 江西农业大学学报, 2013, 35(6): 1236-1241. CHEN Nanhui. Discussion on the life information security control theory[J]. Acta Agriculturae Universitatis Jiangxiensis, 2013, 35(6): 1236-1241. DOI:10.13836/j.jjau.2013214 (  0) 0) |
| [2] |
宋德平, 谌南辉. 生命信息安全控制原理的再探讨[J]. 生物信息学, 2016, 14(50): 49-55. SONG Deping, CHEN Nanhui. Re-discussion on the life information security control theory[J]. Chinese Journal of Bioinformatics, 2016, 14(1): 49-55. DOI:10.3969/J.ISSN.1672-5565.2016.01.09 (  0) 0) |
| [3] |
谌南辉, 宋德平. 生命机体危险因子信息特征分析[J]. 生物信息学, 2017, 15(2): 69-77. CHEN Nanhui, SONG Deping. Analyses on the information characteristics of risk factors in living organisms[J]. Chinese Journal of Bioinformatics, 2017, 15(2): 69-77. DOI:10.3969/j.issn.1672-5565.20160907001 (  0) 0) |
| [4] |
吴克复. 免疫的细胞社会生态学原理[M]. 北京: 科学出版社, 2012. WU Kefu. The theory of social ecology of immune cells[M]. Beijing: Science Press, 2012. (  0) 0) |
| [5] |
庞广昌. 食品免疫论[M]. 北京: 科学出版社, 2008. PANG Guangchang. The theory of food immunity[M]. Beijing: Science Press, 2008. (  0) 0) |
| [6] |
李方舟, 胡海峰. 人cathelicidin抗菌肽LL-37在宿主防御系统中的作用[J]. 世界临床药物, 2011, 32(4): 243-246. LI Fangzhou, HU Haifeng. Function of LL-37 in the host defense system[J]. World Clinical Drugs, 2011, 32(4): 243-246. (  0) 0) |
| [7] |
赵亚华, 徐来祥, 黄蓬亮. 人类防御素的结构与功能研究进展[J]. 中国比较医学杂志, 2006, 16(7): 436-441. ZHAO Yahua, XU Laixiang, HUANG Pengliang. Function progress and structure of human defensin[J]. Chinese Journal of Comparative Medicine, 2006, 16(7): 436-441. DOI:10.3969/j.issn.1671-7856.2006.07.015 (  0) 0) |
| [8] |
周光炎. 免疫学原理(第三版)[M]. 北京: 科学出版社, 2013. ZHOU Guangyan. Principles of immunology (Third edition)[M]. Beijing: Science Press, 2013. (  0) 0) |
| [9] |
舒红兵. 抗病毒天然免疫[M]. 北京: 科学出版社, 2009. SHU Hongbing. Antiviral natural immunity[M]. Beijing: Science Press, 2009. (  0) 0) |
| [10] |
孙东明, 井丽娟, 尹建英. 脂多糖结合蛋白与脂多糖受体的研究进展[J]. 国外医学儿科学分册, 2003, 30(5): 245-247. SUN Dongming, JING Lijiuan, YIN Jianying. Research progress on lipopolysaccharide binding protein and lipopolysaccharide receptor[J]. Foreign Medical Pediatrics Section, 2003, 30(5): 245-247. (  0) 0) |
| [11] |
曹雪涛. 免疫学前沿进展第3版[M]. 北京: 人民出版社, 2014. CAO Xuetao. Advances in immunology (Third edition)[M]. Beijing: People's Health Publishing House, 2014. (  0) 0) |
| [12] |
徐明, 郭宁. 甘露糖受体在免疫调节中的作用[J]. 细胞与分子免疫学杂志, 2002, 18(6): 673-675. XU Ming, GUO Ning. The role of mannose receptor in immune regulation[J]. Chinese Journal of Cellular and Molecular Immunology, 2002, 18(6): 673-675. DOI:10.13423/j.cnki.cjcmi.002617 (  0) 0) |
| [13] |
彭海英, 朱家勇. 杀菌/通透性增加蛋白的研究现状及展望[J]. 医学综述, 2006, 12(1): 1-3. PENG Haiying, ZHU Jiayong. Present status and prospect of the research on bactericidal permeability increasing protein[J]. Medical Recapitulate, 2006, 12(1): 1-3. DOI:10.3969/j.issn.1006-2084.2006.01.001 (  0) 0) |
| [14] |
肖晶, 李晓莉, 童亮, 等. 杀菌/通透性增加蛋白研究进展[J]. 中国畜牧兽医, 2009, 38(11): 41-43. XIAO Jing, LI Xiaoli, TONG Liang, et al. Study progress in bactericidal/permeability increasing protein[J]. Chinese Journal of Animal Husbandry and Veterinary Medicine, 2009, 38(11): 41-43. DOI:10.3969/j.issn.1006-2084.2006.01.001 (  0) 0) |
| [15] |
王涛, 胡旭, 吴晓丽. 肠道共生微生物与免疫[J]. 中国微生态学杂志, 2015, 27(8): 980-986. WANG Tao, HU Xu, WU Xiaoli. Gut microbiota and immunity[J]. Chinese Journal of Microecology, 2015, 27(8): 980-986. DOI:10.13381/j.cnki.cjm.201508032 (  0) 0) |
| [16] |
王自强. 实验动物学[M]. 兰州: 甘肃民族出版社, 1993. WANG Ziqiang. Laboratory zoology[M]. Lan zhou: Gansu Nationalities Publishing House, 1993. (  0) 0) |
| [17] |
TYING S K.黏膜免疫学与病毒学[M].国泰, 王军志, 等译.北京: 科学出版社, 2013. TYING S K.Mucosal immunology and virology[M].GUO Tai, WANG Junzhi, et al.trans.Beijing: Science Press, 2013. (  0) 0) |
| [18] |
名倉宏, 小野克彦, 川内秀之, 等. 医学の あゆみ[M]. 東京都: 医歯薬出版株式会社, 2001.
(  0) 0) |
| [19] |
祁珊珊, 郑红星. 动物肠道黏膜免疫系统研究进展[J]. 黑龙江畜牧兽医(科技版), 2014, 7: 46-49. QI Shanshan, ZHENG Hongxing. Research progress on intestinal mucosal immune system in animals[J]. Heilongjiang Animal Science and Veterinary Medicine, 2014, 7: 46-49. DOI:10.13881/j.cnki.hljxmsy.2014.0550 (  0) 0) |
| [20] |
范骏. 肠道黏膜免疫[J]. 国际免疫学杂志, 2006, 29(2): 111-115. FAN Jun. Intestinal mucosal immunity[J]. International Journal of Immunology, 2006, 29(2): 111-115. DOI:10.3760/cma.j.issn.1673-4394.2006.02.013 (  0) 0) |
| [21] |
赵雪, 张辉, 刘禹. 分泌型IgA对肠道黏膜免疫的研究进展[J]. 中国畜牧兽医, 2013, 40(6): 96-99. ZHAO Xue, ZHANG Hui, LIU Yu. Research advances on secretory IgA roles in intestinal mucosal immunity[J]. China Animal Husbandry & Veterinary Medicine, 2013, 40(6): 96-99. DOI:10.3969/j.issn.1671-7236.2013.06.021 (  0) 0) |
| [22] |
胡艳艳, 刘小伟. 肠道杯状细胞结构和功能的研究进展[J]. 国防病理科学与临床杂志, 2013, 33(5): 424-430. HU Yanyan, LIU Xiaowei. Research advance in structure and function of intestinal goblet cell[J]. Journal of Pathology and Clinical Medicine in National Defense, 2013, 33(5): 424-430. DOI:10.3969/j.issn.1673-2588.2013.05.013 (  0) 0) |
| [23] |
高明, 敖越, 栾新红. Toll样受体信号转导的负调控机制研究进展[J]. 动物医学进展, 2015, 36(1): 99-101. GAO Ming, AO Yue, LUAN Xinhong. Progress on negative regulatory mechanism of Toll-like receptor signal transduction[J]. Progress in Veterinary Medicine, 2015, 36(1): 99-101. DOI:10.16437/j.cnki.1007-5038.2015.01.023 (  0) 0) |
| [24] |
郑松, 高兴华. 皮肤的免疫功能[J]. 实用医院临床杂志, 2015, 12(2): 3-7. ZHENG Song, GAO Xinghua. Skin immune sentinels in health and disease[J]. Journal of Practical Hospital Clinical, 2015, 12(2): 3-7. DOI:10.3969/j.issn.1672-6170.2015.02.002 (  0) 0) |
| [25] |
张长琳. 看不见的彩虹:人体的耗散结构[M]. 杭州: 浙江科学技术出版社, 2013. ZHANG Changlin. An invisible rainbow:the dissipative structure of the human body[M]. Hangzhou: Zhejiang Science and Technology Press, 2013. (  0) 0) |
| [26] |
羅廣英. 破解東方神秘主義《道德經》真注[M]. 中国香港: 東方出版社, 2014. LUO Guangying. Cracking oriental mysticism:a true annotation of the Tao Te Chin[M]. China Hongkong: Hongkong Oriental Publishing House, 2014. (  0) 0) |
 2019, Vol. 17
2019, Vol. 17


