肿瘤细胞的自发循环是一部分癌细胞“侵入性行为”的标志,获得强侵袭能力的CTCs和随后的癌细胞转移导致了90%的癌症患者的死亡[1]。由于入侵发生在肿瘤早期阶段[2],此时血液中的CTCs数量非常稀少,这意味着准确有效的CTCs识别与分析对于尽早地确诊肿瘤并采取有效的治疗措施具有重要意义,同时有助于评估单个CTCs的侵袭能力以及预判可能发生的癌细胞转移。
多项研究表明,CTCs在恶性肿瘤发生和发展过程中都可以被检测到,包括肿瘤的临床确诊之前[3]。但外周循环血中CTCs的数量极少,每106~107个单核细胞中才能发现一个CTCs[4],难以直接从数量庞大的白细胞中检测出CTCs。另外还面临着高灵敏度和特异度的挑战[5],因此现有的CTCs检测技术大多数是在富集分离的基础上进行,常用的富集方法基本包含依据形态学原理的膜过滤法[6-7]和密度梯度离心法[8-10],以及依据抗原抗体原理的免疫磁性分离法[11-13]和微芯片技术[14-15]。
目前的富集技术还不能保证富集产物的纯度,分离出来的CTCs往往会跟数量庞大的白细胞混合在一起。如果不进一步识别确认,容易导致假阳性或假阴性结果,造成CTCs数目的不可靠性。因此具备高灵敏度和特异度的CTCs识别技术不仅能进一步验证富集效果,而且将为癌症早期诊断、指导个性化医疗以及药物的疗效监测提供可靠参考。因此如何准确、灵敏的识别CTCs成为当前研究的新重点,本文对几种CTCs识别技术进行总结展望。
1 核酸检测法核酸检测法主要是通过PCR技术或RT-PCR技术靶向扩增上皮源性肿瘤细胞特异性DNA或mRNA来完成对CTCs基因层面上的鉴定分析。此方法灵敏度高于免疫细胞化学术,可以从106~107个正常细胞中识别出一个CTCs[16],但这需要以核酸全部来自于CTCs为前提;稳定性好,成本较低,因此已经成为当前CTCs鉴定分析领域最有效的方法[17]。
传统的PCR技术,常用胶体电泳分离最终产物,并使用溴化乙锭(EB)等染料将其染色,无法监测反应过程和定量分析模板序列。
实时荧光定量PCR技术(fq-PCR)[18]结合传统PCR与荧光共振能量传递技术[19],通过加入与目标DNA特异性结合的荧光探针来表示PCR反应过程中产物的增长。过程中,通过探针信号的连续积累改变实现了实时监测每一轮循环后产物量的增加与否;由指数扩增期的产物数量推算出模板序列的拷贝数,最后利用Ct值或标准曲线对模板序列定量分析,实现了对特异性DNA序列的精准定量。由于荧光探针的引入,除了DNA引物序列的特异性之外,还有探针序列的特异性,从两个方面保证了所扩增序列的特异性。
实时荧光定量PCR能够准确可靠地测出特定癌基因的具体表达量。Schuster R等[20]使用该技术对128例结直肠癌病患外周血液样本中弥散性肿瘤细胞进行了三种不同mRNA标志物的检测实验,所有血液样本中都检测到了三种标志物(ProtM:17%; CEA:86%; CK20 :88%),并且检测到13%的患者血液中的标志物浓度有明显升高。
虽然目前实时荧光定量PCR已经进行过端粒酶hTERT基因、慢性淋巴细胞性白血病BCL2和p53基因、肿瘤MDR1基因等的准确检测[21-24]。但是想要广泛应用于常规临床检测还面临以下问题:(1)荧光素种类以及检测激发光源限制了其用于复合式检测;(2)过高的成本限制了其应用于常规临床分析。
各项PCR或RT-PCR技术都需要有肿瘤细胞的DNA或mRNA才能进行鉴定,但是获得核酸需要裂解细胞,因而无法进行形态学分析,也无法对CTCs数量进行统计。而且坏死肿瘤细胞释放的核酸容易污染目的核酸,造成假阳性。
2 免疫细胞化学术免疫细胞化学术(immunocytochemistry,ICH)[25]基于细胞形态特性和表面特征标记物表达来识别鉴定CTCs,是一种联合抗原抗体反应的高度特异性及荧光标记的直观可见性的生化染色技术。通过荧光标记的抗体与CTCs表面的抗原进行结合,针对肿瘤细胞的特异性蛋白或基因进行定量检测,从而实现CTCs的鉴定以及形态学分析。通常情况下借助于上皮细胞特异性CK抗体,白细胞特异性CD45抗体以及核荧光染料DAPI进行处理,若结果为CK+/ CD45-/ DPAI+,则认为待检细胞为CTCs。2014年郭立民等[26]以细胞角蛋白CK为标记,采用免疫细胞染色在肝癌患者外周血中检测到了完整的CTCs,检出率为63.15%。但是此项技术需要人工在显微镜下寻找已染色肿瘤细胞,检测效率及准确率太低,无法达到临床诊断上的要求。在此基础上发展起来的光纤阵列扫描术(FAST)彻底地摆脱了这一限制。
FAST[27-28]是一种快速准确的CTCs定位计数系统,在不牺牲捕获效率的前提下具备由末端非对称光纤实现的超大观察视野(50 341 mm),不需要提前对CTCs进行富集分离,氩离子激光器直接以快于常规自动数字显微镜500倍的速率正交扫描载玻片,载玻片上经过免疫荧光染色的CTCs受激发后产生的发射荧光经准直透镜到达滤光片,收集后到达光电倍增管,得到的结果被输入到一个完全自动化的扫描数字显微镜系统(REIS)中进行处理,实现了快速且准确定位已荧光染色的CTCs,自动对其进行数量统计,解决了传统免疫化学术准确率低以及检测效率低的问题。Marrinucci[29]用FAST技术对于五例结直肠癌患者进行CTCs检测,所有的血液样本中均检测到CTCs,平均每毫升血液中检测到的CTCs个数为12~282个。
免疫细胞化学术依赖于上皮细胞特异性抗体CK,但是上皮源性肿瘤细胞在经历了上皮-间充质转化(EMT)[30]过程之后,上皮源性标志物(如EpCAM、CK)表达会下调,这就说明此项技术极易漏检发生EMT变化后具有了较强侵袭性的肿瘤细胞,有着不容忽视的假阴性。
3 流式细胞技术流式细胞技术(Flow cytometry,FCM)[31]是借助流式细胞仪作为检测手段的一种针对单个细胞的定量分析技术,基本包括血液样本液流技术、目的细胞识别和计数,以及数据采集和分析等技术。经特定染料标记的细胞悬浮液进入检测室,在鞘液的限制下,通过喷嘴形成单细胞悬液。单细胞悬液通过激光照射区受到光源激发光照射,细胞上的荧光物质被激发,会产生不同波长,分别代表着细胞不同特征物质的荧光信号,由光电接收器接受转换,通过实时的测定库尔特电阻、荧光种类和强度、光散射和吸收来定量检测细胞内外标记物如DNA含量、细胞体积、细胞膜受体和表面抗原等诸多关键参数,完成CTCs识别和分选。
通过流式细胞仪来鉴别分析CTCs,可以实现多个通道同时工作,检测速度较快。另外,该技术保留CTCs的形态学特征和抗原性,能够快速分析数以万计个细胞的多种参数,提高了CTCs鉴定结果的准确率。Takao M等[32]等曾经使用此技术在肺癌PC-9系和乳腺癌MCF-7系上做了CTCs的检测实验并取得了良好的效果。
近年来,PAFC技术[33]即活体流式细胞仪,结合了活体(近红外)实时高速影像方法和体外流式细胞仪。通过激光实时检测某段时间内通过血管某一处截面的被荧光标记的肿瘤细胞,实现实时监测活体CTCs并对其进行定量分析与检测。Galanzha等[34]研究得出在最佳的NIR范围内(例如820 nm或者1 064 nm),PAFC技术能够在100 300个红细胞中检测出单个恶性黑素瘤CTCs。
2011年,Merck Millipore公司推出的FlowSight图像式流式细胞仪[35-36],融合了流式细胞仪的检测功能与荧光显微成像功能,这种独特的组合提供了所获得的单个CTCs的视觉验证,完成CTCs识别的同时观察细胞形态。由双色镜构成的滤光片堆栈(Dichroic Filter Stack)将细胞发射荧光信号的不同波段分别投射到时间延时积分CCD相应的检测通道上,产生一个brightfield,一个darkfield以及至多十个不同荧光检测通道的细胞图像。光路系统通过采用航空遥感CDD、自动调整焦距以及实时测定细胞运动速度等方式保证采集到的CTCs图像的质量和荧光信号的灵敏度。
4 基于表征特性图像识别技术意大利Silicon Biosystems公司开发的DEPArray系统[37](见图 1),结合了介电电泳技术操控单细胞与基于图像的细胞识别技术,包括特殊晶片和Cell Browser分析软件,实现自动化地从异质血液样本中识别和回收单个目的细胞。晶片表面排列着40 000个可控制的电极矩阵,每一个电极都连有嵌入式传感器,使细胞周围形成介电电泳(DEP)环境。将细胞悬浮液注入晶片后,通过配置的五个荧光通道、一个可见光和CCD影像传感器,扫描获取细胞影像,Cell Browser根据细胞影像,确认其荧光强度和形态上的特征,通过表型特征图像识别技术识别到所需荧光标记和形态学特征的目的细胞。相邻电极之间通电之后形成电场,通过不断调整各电极间电场的方向,利用介电电泳力将目的细胞移动到指定位置,完成CTCs的精准识别捕获。
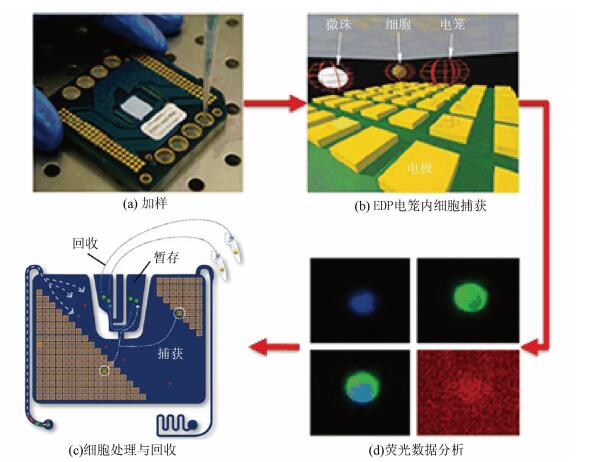
|
图 1 DEPArray工作方式的示例图 Figure 1 DEPArray working method |
Francesco Fabbri等[38]利用肺癌细胞系A549的癌细胞来测试DEPArray系统的检测率。设计20组实验,每组中将一定数量的该细胞加入到外周血液中(每毫升血液中加入5~300个癌细胞细胞)模拟CTCs,经过实验每组样品中都检测到了癌细胞,检测率在11.6%~86.0%范围内不等,但是识别分离出来的细胞里癌细胞纯度达到100%,表明DEPArray系统检测结果具有一定的准确率。
DEPArray系统利用介电电泳技术对细胞施力,结合形态学的信息,完成单个完整CTCs的识别、捕获和回收。整个操作过程用力温和、无物理接触或摩擦,完整保留细胞活性,便于继续实验培养或者用于表达谱、基因测序、拷贝数变异等进一步分析。
5 总结与展望本文所述的各种方法各有其优缺点。通过不同的富集和识别方法,对于同一肿瘤患者的血液样本分别进行检测所得结果的灵敏性和特异性也是不尽相同的,因此CTCs检测领域所面临的一个急需解决的问题是缺少统一的CTCs富集和检测标准。
在精准医疗的时代背景下,肿瘤疾病的精确诊断有着不可忽视的重要性,因此CTCs检测结果的准确性至关重要。核酸检测法和免疫细胞化学术可能存在假阳性和假阴性结果,无法确保其识别鉴定结果的准确可靠。流式细胞术通过测定细胞的存活状态、内外标记物等多个重要参数,从各方面保证了CTCs鉴定结果的准确率,可靠性高。DEPArray系统除了多通道扫描细胞影像保证结果准确率之外,以温和的方式精准识别捕获单个目的细胞,有助于后续精确的分子分析验证,进一步保证了结果的可靠性。此外随着机器视觉、图像处理技术的往更深度和广度不断发展,图像式流式细胞仪和基于表征性图像识别技术将成为CTCs识别检测领域今后发展的新趋势。
| [1] |
WITTEKIND C, NEID M. Cancer invasion and metastasis[J]. Oncology, 2005, 69(Suppl.1): 14-16. DOI:10.1159/000086626 (  0) 0) |
| [2] |
PATERLINI-BRECHOT P, BENALI N L. Circulating tumor cells (CTC) detection: Clinical impact and future directions[J]. Cancer Letters, 2007, 253(2): 180. DOI:10.1016/j.canlet.2006.12.014 (  0) 0) |
| [3] |
TANAKA F, YONEDA K, KONDO N, et al. Circulating tumor cell as a diagnostic marker in primary lung cancer[J]. Clinical Cancer Research An Official Journal of the American Association for Cancer Research, 2009, 15(22): 6980. DOI:10.1158/1078-0432.CCR-09-1095 (  0) 0) |
| [4] |
马清, 陈水平, 陈建魁. 肝癌患者循环肿瘤细胞的检测及其临床应用研究进展[J]. 标记免疫分析与临床, 2014, 21(5): 599-602. MA Qing, CHEN Shuiping, CHEN Jiankui. Progress of circulating tumor cell analysis and clinical application in patients with liver cancer[J]. Labeled Immunoassays and Clinical Medicine, 2014, 21(5): 599-602. DOI:10.11748/bjmy.issn.1006-1703.2014.05.029 (  0) 0) |
| [5] |
BEDNARZKNOLL N, ALIXPANABIRES C, PANTEL K. Clinical relevance and biology of circulating tumor cells[J]. Breast Cancer Research, 2011, 13(6): 228. DOI:10.1186/bcr2940 (  0) 0) |
| [6] |
VONA G, SABILE A, LOUHA M, et al. Isolation by size of epithelial tumor cells[J]. American Journal of Pathology, 2000, 156(1): 57-63. DOI:10.1016/S0002-9440(10)64706-2 (  0) 0) |
| [7] |
ZABAGLO L, ORMEROD M G, PARTON M, et al. Cell filtration-laser scanning cytometry for the characterisation of circulating breast cancer cells[J]. Cytometry Part A, 2003, 55A(2): 102-108. DOI:10.1002/cyto.a.10071 (  0) 0) |
| [8] |
GERTLER R, ROSENBERG R, FUEHRER K, et al. Detection of circulating tumor cells in blood using an optimized density gradient centrifugation[J]. Recent Results in Cancer Research.fortschritte Der Krebsforschung.progres Dans Les Recherches Sur Le Cancer, 2003, 162(162): 149. DOI:10.1007/978-3-642-59349-9_13XIAO (  0) 0) |
| [9] |
LAGOUDIANAKIS E E, KATAKI A, MANOURAS A, et al. Detection of epithelial cells by RT-PCR targeting CEA, CK20, and TEM-8 in colorectal carcinoma patients using OncoQuick density gradient centrifugation system[J]. Journal of Surgical Research, 2009, 155(2): 183-190. DOI:10.1007/s00381-007-0515-2 (  0) 0) |
| [10] |
曹璐, 徐文, 殷正丰. 循环肿瘤细胞分离与检测[J]. 第二军医大学学报, 2010, 31(3): 313-316. CAO Lu, XU Wen, YIN Zhengfeng. Isolation and detection of circulating tumor cells: recent progress[J]. Academic Journal of Second Military Medical University, 2010, 31(3): 313-316. DOI:10.3724/SP.J.1008.2010.00313 (  0) 0) |
| [11] |
PATERLINI-BRECHOT P, BENALI N L. Circulating tumor cells (CTC) detection: Clinical impact and future directions[J]. Cancer Letters, 2007, 253(2): 180. DOI:10.1016/j.canlet.2006.12.014 (  0) 0) |
| [12] |
COHEN S J, PUNT C J A, IANNOTTI N, et al. Relationship of circulating tumor cells to tumor response, progression-free survival, and overall survival in patients with metastatic colorectal cancer[J]. Journal of Clinical Oncology Official Journal of the American Society, 2008, 26(19): 3213. DOI:10.1200/JCO.2007.15.8923 (  0) 0) |
| [13] |
吴源娜.基于ISET技术的晚期胃癌循环肿瘤细胞检测及其临床意义[D].南京: 南京大学, 2016. WU Yuanna. Detection and clinical significance of circulating tumor cells in advanced gastric cancer based on ISET technology[D]. Nanjing: Nanjing University, 2016. (  0) 0) |
| [14] |
NAGRATH S, SEQUIST L V, MAHESWARAN S, et al. Isolation of rare circulating tumour cells in cancer patients by microchip technology[J]. Nature, 2007, 450(7173): 1235-9. DOI:10.1038/nature06385 (  0) 0) |
| [15] |
STOTT S L, HSU C H, TSUKROV D I, et al. Isolation of circulating tumor cells using a microvortex-generating herringbone-chip[J]. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(43): 18392-7. DOI:10.1073/pnas.1012539107 (  0) 0) |
| [16] |
PUNIA S L, BI L, TURKER M A, et al. Clearcell FX microfluidic system for the enrichment and genetic analysis of circulating tumor cells[J]. Journalism History, 2015, 34(6): 204-215. (  0) 0) |
| [17] |
王振丹, 赵文华, 李胜. 循环肿瘤细胞检测方法研究现状[J]. 中华肿瘤防治杂志, 2014, 21(17): 1391-1394. WANG Zhendan, ZHAO Wenhua, LI Sheng. Advance in the detection of circulating tumor cells[J]. Chinese Journal of Cancer Prevention and Treatment, 2014, 21(17): 1391-1394. DOI:10.16073/j.cnki.cjcpt.2014.17.023 (  0) 0) |
| [18] |
赵焕英, 包金风. 实时荧光定量PCR技术的原理及其应用研究进展[J]. 中国组织化学与细胞化学杂志, 2007, 16(4): 492-497. ZHAO Huanying, BAO Jinfeng. The principle and application of real-time fluorescence quantitative PCR[J]. Chinese Journal of Histochemistry and Cytochemistry, 2007, 16(4): 492-497. DOI:10.3870/j.issn.1004-1850.2007.04.023 (  0) 0) |
| [19] |
CLAPP A R, MEDINTZ I L, MAURO J M, et al. Fluorescence resonance energy transfer between quantum dot donors and dye-labeled protein acceptors[J]. Journal of the American Chemical Society, 2004, 126(1): 301-310. DOI:10.1021/ja037088b (  0) 0) |
| [20] |
SCHUSTER R, MAX N, MANN B, et al. Quantitative real-time RT-PCR for detection of disseminated tumor cells in peripheral blood of patients with colorectal cancer using different mRNA markers[J]. International Journal of Cancer, 2004, 108(2): 219-227. DOI:10.1002/ijc.11547 (  0) 0) |
| [21] |
YANG Y J, CHEN H, HUANG P, et al. Quantification of plasma hTERT DNA in hepatocellular carcinoma patients by quantitative fluorescent polymerase chain reaction[J]. Clinical & Investigative Medicine Médecine Clinique Et Experimentale, 2011, 34(4): E238. (  0) 0) |
| [22] |
李承彬, 欧阳耀灵, 周家杰, 等. 不同样本中DD3mRNA和hTERT mRNA检测比较[J]. 中国卫生检验杂志, 2010, 20(11): 2856-2860. LI Chengbin, OUYANG Yaoling, ZHOU Jiajie, et al. Comparison of detection for DD3 mRNA and hTERT mRNA in the different samples[J]. Chinese Journal of Health Laboratory Technology, 2010, 20(11): 2856-2860. (  0) 0) |
| [23] |
SAAED H K, MAHMOOD M A, KHOSHNAW N. Quantitative real time PCR analysis of apoptotic gene expression in chronic lymphocytic leukemia patients and their relationships with chemosensitivity[J]. Applied Cancer Research, 2017, 37(1): 8. DOI:10.1186/s41241-017-0014-z (  0) 0) |
| [24] |
曹建中, 鲍柏军. 晚期进展期胃癌患者外周血多药耐药基因1的表达[J]. 江苏医药, 2015, 41(1): 58-60. CAO Jianzhong, BAO Baijun. Expression of MDR1 in peripheral blood of patients with advanced gastric carcinoma[J]. Jiangsu Medical Journal, 2015, 41(1): 58-60. DOI:10.19460/j.cnki.0253-3685.2015.01.021 (  0) 0) |
| [25] |
JULIA J, BRIGITTE R, FRIEDL T W P, et al. Detection of circulating tumor cells using manually performed immunocytochemistry (MICC) does not correlate with outcome in patients with early breast cancer-Results of the German SUCCESS-A- trial[J]. BMC Cancer, 2016, 16(1): 1-11. DOI:10.1186/s12885-016-2454-3 (  0) 0) |
| [26] |
郭立民, 鲁岩, 彭吉润, 等. 应用免疫激活磁珠分选技术CD45去除方法富集——免疫细胞化学联合苏木素-伊红染色检测肝癌患者循环肿瘤细胞[J]. 中华实验外科杂志, 2014, 31(9): 2019-2021. GUO Limin, LU Yan, PENG Jirun, et al. Combined use of immunomagnetic activated cell sorting technique enrichment and immunocytochemistry with hematoxylin and eosin staining for identification of circulating tumor cells in peripheral blood mononuclcar cells of hepatocellular carcinoma patients[J]. Chinese Journal of Experimental Surgery, 2014, 31(9): 2019-2021. DOI:10.3760/cma.j.issn.1001-9030.2014.09.063 (  0) 0) |
| [27] |
SUN Y F, YANG X R, ZHOU J, et al. Circulating tumor cells: advances in detection methods, biological issues, and clinical relevance[J]. Journal of Cancer Research & Clinical Oncology, 2011, 137(8): 1151. DOI:10.1007/s00432-011-0988-y (  0) 0) |
| [28] |
KRIVACIC R T, LADANYI A, CURRY D N, et al. A Rare-Cell Detector for Cancer[J]. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(29): 10501. DOI:10.1073/pnas.0404036101 (  0) 0) |
| [29] |
MARRINUCCI D, BETHEL K, LAZAR D, et al. Cytomorphology of circulating colorectal tumor cells:a small case series[J]. Journal of Oncology, 2010, 2010(1687-8450): 861341. DOI:10.1155/2010/861341 (  0) 0) |
| [30] |
LOWES L E, GOODALE D, YING X, et al. Epithelial-to-mesenchymal transition leads to disease-stage differences in circulating tumor cell detection and metastasis in pre-clinical models of prostate cancer[J]. Oncotarget, 2016, 7(46): 76125-76139. DOI:10.18632/oncotarget.12682 (  0) 0) |
| [31] |
LÓPEZ-RIQUELME N, MINGUELA A, VILLAR-PERMUY F, et al. Imaging cytometry for counting circulating tumor cells: comparative analysis of the CellSearch vs ImageStream systems[J]. Apmis, 2013, 121(12): 1139-1143. DOI:10.1111/apm.12061 (  0) 0) |
| [32] |
TAKAO M, TAKEDA K. Enumeration, characterization, and collection of intact circulating tumor cells by cross contamination-free flow cytometry[J]. Cytometry Part A:the Journal of the International Society for Analytical Cytology, 2011, 79A(2): 107-117. DOI:10.1002/cyto.a.21014 (  0) 0) |
| [33] |
NEDOSEKIN D A, SARIMOLLAOGLU M, YE J H, et al. In Vivo Ultra-Fast photoacoustic flow cytometry of circulating human melanoma cells using near-ingrared high-pulse rate lasers[J]. Cytometry A: the Journal of the International Society for Analytical Cytology, 2011, 79A(10): 825-833. DOI:10.1002/cyto.a.21102 (  0) 0) |
| [34] |
GALANZHA E I, ZHAROV V P. Circulating tumor cell detection and capture by photoacoustic flow cytometry in vivo and ex vivo[J]. Cancers, 2013, 5(4): 1691. DOI:10.3390/cancers5041691 (  0) 0) |
| [35] |
HENNING A L, SAMPSON J N, MCFARLIN B K. Measurement of low-abundance intracellular mRNA using amplified fish staining and image-based flow cytometry[J]. Current Protocols in Cytometry, 2016, 76(1): 7. DOI:10.1002/0471142956.cy0746s76 (  0) 0) |
| [36] |
BASIJI D. The design and applications of the flowsight, an affordable, high-performance imaging flow cytometer[C]// Bi International Practical Cytometry Workshop, 2012.
(  0) 0) |
| [37] |
MEDORO G. Introducing deparrayTM: individual manipulation and detection of more than 10 000 cells in a drop of sample[C]// Sensors and Microsystems -, Italian Conference, 2014: 361-363.DOI: 10.1142/9789812702944_0056.
(  0) 0) |
| [38] |
FABBRI F, CARLONI S, ZOLI W, et al. Detection and recovery of circulating colon cancer cells using a dielectrophoresis-based device: KRAS mutation status in pure CTCs[J]. Cancer Letters, 2013, 335(1): 225-231. DOI:10.1016/j.canlet.2013.02.015 (  0) 0) |
 2018, Vol. 16
2018, Vol. 16


