2. 西北民族大学榆中校区 化工学院,兰州 730124
2. School of Chemical Engineering, Northwest University for Nationalities, Lanzhou 730124, China
血清白蛋白(serumalbumin,SA)是一种球状蛋白质,是机体循环系统中含量最丰富的储存与运输蛋白。该蛋白有许多重要的生理学与药理学功能,能与许多内源和外源性物质如脂肪酸、氨基酸、荷尔蒙、K2阴阳离子和药物等结合[1]。其对药物的药代动力学特别是其在人体中的分布有着重要的作用,大部分药物成分在人体中的运转首先通过与血清白蛋白的结合,然后到达靶标组织起到存储和转运作用。因此血清白蛋白己成为研究最广泛的目标蛋白之一。血清白蛋白来源广泛,其中由于人血清白蛋白(HSA)与牛血清白蛋白(BSA)分子结构信息确知,故被相关研究人员广泛采用为生物大分子模型。
HSA的三维晶体结构显示,人血清蛋白球状高级结构可分为3个结构域(domain),从N端开始依次为domain Ⅰ (残基1~195),domain Ⅱ (残基196~383)和domain Ⅲ (残基394~585),它们均是由a-螺旋体反向平行而成,每个结构域由槽口相对的两个疏水性空腔亚域(A和B)形成圆筒状结构,几乎所有疏水性氨基酸都包埋在此圆筒腔内部,构成疏水性腔。与药物相互作用的位置就位于这6个亚区之中(如图 1所示), 文献[2]中研究发现大多数药物在血清白蛋白上的结合部位为亚结构域ⅡA和ⅢA,其中ⅢA的活性最高。除此之外,HSA和BSA分子内还有诸如β-折叠、回转以及无规卷曲等二级结构类型。晶体衍射实验表明血清白蛋白呈心脏形构象[3]。然而,其他物种特别是一些与人类亲缘关系较近的哺乳动物上的血清白蛋白的结构、性质等的了解都还比较少。
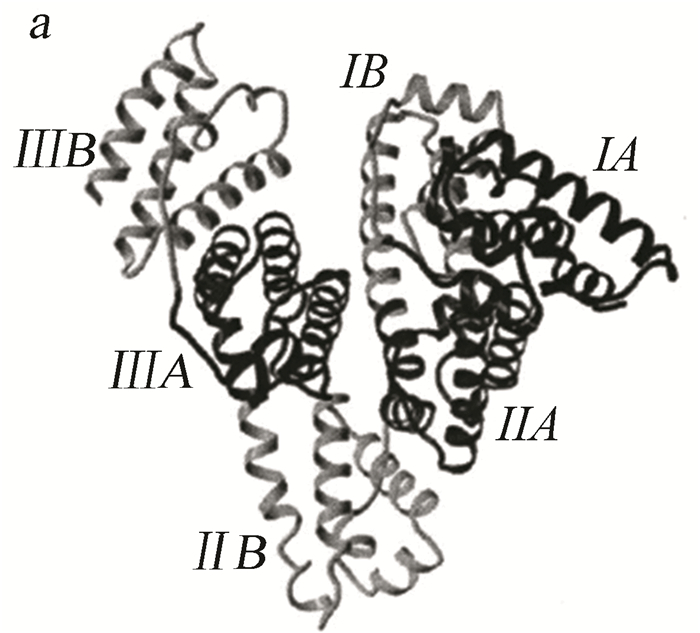
|
图 1 人血清白蛋白的二级结构 Figure 1 Secondary structure of human serum albumin |
米格列醇(Miglitol)和伏格列波糖(Voglibose)是小肠内α-葡萄糖苷酶抑制剂,可以延缓葡萄糖从吸收的复合碳水化合物中释放,从而可减弱餐后血糖水平的增高。已有研究报道表明,米格列醇和伏格列波糖是安全有效的、耐受性较好的、可用于血糖控制不良的需要胰岛素治疗的Ⅱ型糖尿病患者的治疗药物。图 2为米格列醇(Miglitol)和伏格列波糖(Voglibose)的分子结构图。
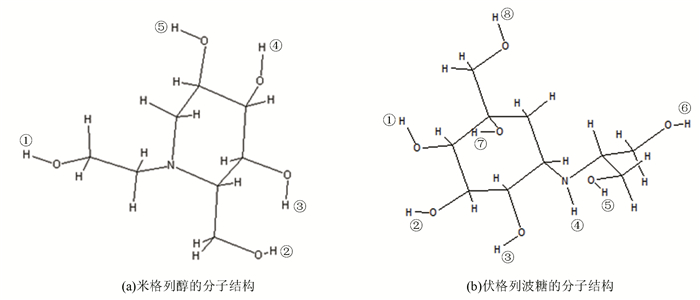
|
图 2 米格列醇和伏格列波糖的分子结构图 Figure 2 The molecular structure of miglitol and voglibose 注:图中极性氢原子用数字进行标注。 |
近年来,药物与血清白蛋白的相互作用的研究越来越多[4-12]。但是到目前为止,研究药物与血清白蛋白的相互作用大部分都基于人和牛的[5-12],由于各种限制条件,例如晶体结构还未获得、物种资源稀缺等,所以在其他物种上研究的还比较少。用生物信息学的方法分析不同物种的血清白蛋白的特点和进化关系,分析米格列醇与人血清白蛋白相互作用位点及其在其他亲缘关系较近的物种中相应的氨基酸变化特点,通过分析血清白蛋白的疏水性及其与米格列醇结合位点处的氨基酸特征,为进一步了解其他物种的血清白蛋白的结构特点以及为分析米格列醇在其他物种中的相互作用等提供理论依据。
1 材料与方法 1.1 蛋白质序列的下载人类(Homo sapiens)、鼠耳蝠(Myotis davidii)、野骆驼(Camelus ferus)、家牛(Bos Taurus)、狼(Canis lupus)、小家鼠(Mus musculus)、膜壳绦虫(Hymenolepis microstoma)、多房棘球绦虫(Echinococcus multilocularis)、双胸斑沙鸟(Charadrius vociferus)、白喉花共鸟(Tinamus guttatus)、金领娇鹟(Manacus vitellinus)、阿德利企鹅(Pygoscelis adeliae)、日鳽(Eurypyga helias)、仓鸮(Tyto alba)、麝雉(Opisthocomus hoazin)、朱鹮(Nipponia Nippon)、白尾鹲(Phaethon lepturus)、褐拟鹑(Mesitornis unicolor、绵羊(Ovine)、牦牛(Bos mutus)、海龟(Chelonia mydas)、帝企鹅(Aptenodytes forsteri)、美国乌鸦(Corvus brachyrhynchos)等23个物种的血清白蛋白氨基酸序列是从NCBI网站(http://www.ncbi.nlm.nih.gov/pubmed)上下载,人血清白蛋白的晶体结构是从PDB数据库(http://www.rcsb.org/pdb/home/home.do)中下载(PDB:1N5U)的。
1.2 蛋白质序列分析多序列的比对是通过ClustalW软件进行的;蛋白质的氨基酸序列长度和组成及等电点的分析是通过Lasergene软件进行的;序列的相似性分析是通过MegAlign软件中Lipman-Pearson方法进行的;蛋白质疏水性采用ExPAsy的ProtScale程序进行分析(http://web.expasy.org/protscale/)[13]。该程序可通过输入框将序列粘贴进去,也可输入SWISS-PROT的记录号来计算蛋白质的亲疏水性图谱。基于ClustalW软件的多序列比对和Jone-Taylor-Thornton(JTT)模型,采取缺失序列删除的方式,用MEGA6.0软件[14]的Nearest-Neighbor-Interchange(NJJ)方法构建进化树(Bootstrap=1 000)。
1.3 小分子的准备在PubChem上下载相应的分子结构(米格列醇的PubChem CID: 441314;伏格列波糖的PubChem CID: 444020),通过Chem3D软件的MM2法做几何构型优化,精确度为0.001。然后用密度泛函理论DFT的B3LYP方法,采用6-31G*基组做进一步的构型全优化。分子的半柔性对接是用Autodock4.2进行的,采用Lamarckian遗传算法(LGA),能量评估次数使用最大次数25 000 000,次数是27 000,突变率设置为0.02,交叉率为0.80,最大迭代次数是300。以药物小分子为中心的格子尺寸定义为60 Å×60 Å×60 Å,间隔为0.375 Å,坐标为x=32.209; y= 6.644; z=33.149。最终得到的50个对接的构象中能量最小的作为稳定构象作进一步的分析。
2 结果与分析 2.1 蛋白质序列名称及组成23种物种的血清白蛋白序列名称及其不同类型氨基酸组成等性质见表 1。除野骆驼(Camelus ferus)和海龟(Chelonia mydas)之外,大部分物种的血清白蛋白的氨基酸序列长度在565~654,比较接近,疏水性的氨基酸和极性的氨基酸占有较大的比例,疏水性大多在200左右,等电点都在5~9。
| 表 1 血清白蛋白的序列名称及氨基酸组成 Table 1 Sequence name and amino acid composition of serum albumin |
通过对血清白蛋白的序列相似性分析表明,人类(Homo sapiens)与鼠耳蝠(Myotis davidii)、野骆驼(Camelus ferus)、家牛(Bos Taurus)、狼(Canis lupus)、小家鼠(Mus musculus)、膜壳绦虫(Hymenolepis microstoma)、多房棘球绦虫(Echinococcus multilocularis)、双胸斑沙鸟(Charadrius vociferus)、白喉共鸟(Tinamus guttatus)、金领娇鹟(Manacus vitellinus)、阿德利企鹅(Pygoscelis adeliae)、日鳽(Eurypyga helias)、仓鸮(Tyto alba)、麝雉(Opisthocomus hoazin)、朱鹮(Nipponia Nippon)、白尾鹲(Phaethon lepturus)、褐拟鹑(Mesitornis unicolor)、绵羊(Ovine)、牦牛(Bos mutus)、海龟(Chelonia mydas)、帝企鹅(Aptenodytes forsteri)、美国乌鸦(Corvus brachyrhynchos)的序列相似性分别是56.4%,79.3%,76.2%, 80.4%,72.4%,38.9%,23.1%,48.4%,47.9%,46.3%,47.9%,48.1%,48.4%,49.0%,47.2%,46.8%,46.3%,74.7%,76.0%,46.8%,48.1%,45.8%。由图 3系统发育关系表明,家牛(Bos Taurus)和牦牛(Bos mutus)的亲缘关系很近,家牛(Bos Taurus)、狼(Canis lupus)、绵羊(Ovine)和牦牛(Bos mutus)与人类的亲缘关系较近,序列的相似性均在74%以上。
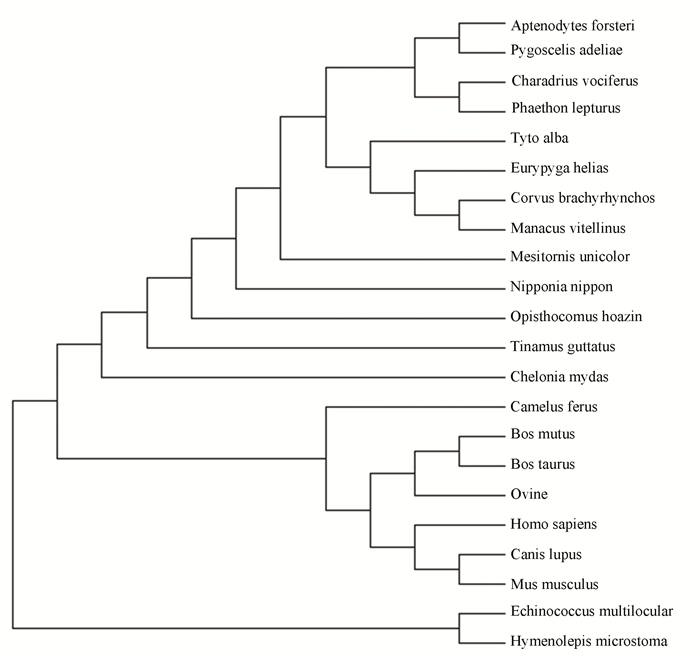
|
图 3 血清白蛋白序列的系统发育树 Figure 3 Phylogenetic tree of serum albumin sequences |
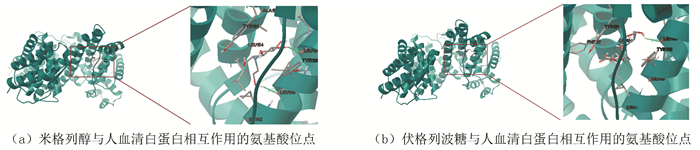
米格列醇与人血清白蛋白结合能是-3.65 Kcal/mol,其间相互作用的关键氨基酸残基都位于α-螺旋区,它们分别是亮氨酸Leu135,酪氨酸Tyr138,亮氨酸Leu139,异亮氨酸Ile142,亮氨酸Leu154,丙氨酸Ala158,酪氨酸Tyr161。伏格列波糖与人血清白蛋白结合能是-3.52 Kcal/mol,结合位点处的氨基酸残基也都位于α-螺旋区,分别是亮氨酸Leu135,酪氨酸Tyr138,亮氨酸Leu139,亮氨酸Leu154,苯丙氨酸Phe157,酪氨酸Tyr161。图 4为米格列醇、伏格列波糖与人血清白蛋白相互作用的结合区域。可以看出,米格列醇、伏格列波糖与人血清白蛋白的结合位点都位于相同的人血清白蛋白亚区IB的疏水腔中,其间的主要作用力是疏水作用力。图 5为米格列醇、伏格列波糖与人血清白蛋白相互作用的氨基酸位点。可以看出,米格列醇与人血清白蛋白的氢键分别在米格列醇①氢与亮氨酸Leu139的氧原子之间,长度为2.037 Å,以及米格列醇④氢与亮氨酸Leu135的氧原子之间,长度为2.142 Å。伏格列波糖与人血清白蛋白的氢键在其⑥氢原子与亮氨酸Leu135的氧原子之间,长为2.152 Å。
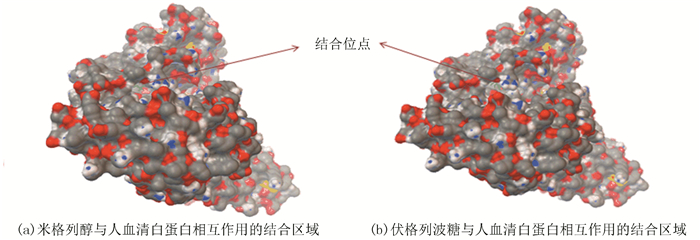
|
图 4 米格列醇、伏格列波糖与人血清白蛋白相互作用的结合区域 Figure 4 The binding region of miglitol, voglibose induced with human serum albumin |
|
图 5 米格列醇、伏格列波糖与人血清白蛋白相互作用的氨基酸位点 Figure 5 The interaction site of miglitol, voglibose with human serum albumin amino acid |
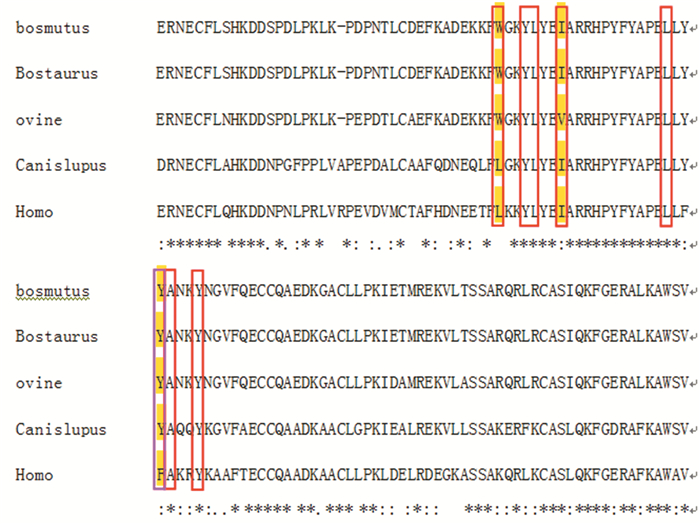
为了分析米格列醇、伏格列波糖与血清白蛋白相互作用位点的氨基酸是否在其他物种中是保守的,本文选取了与人(Homo sapiens)亲缘关系较近的狼(Canis lupus)、牦牛(Bos mutus)、家牛(Bos taurus)和绵羊(Ovine)的血清白蛋白序列进行了多序列比对,如图 6所示。其中红色*框中的氨基酸代表米格列醇与血清白蛋白相互结合点处的疏水性氨基酸,黄色*背景的氨基酸表示其他物种中与人不同的氨基酸位点。米格列醇与血清白蛋白相互作用位点中,在人血清白蛋白序列中Leu135处是疏水性的亮氨酸,在狼血清白蛋白序列中对应的也是亮氨酸,但是在绵羊、牦牛和家牛中相应的位置却是极性的色氨酸W。与人血清白蛋白序列中Ile142处的疏水性的异亮氨酸不同的只有绵羊的颉氨酸。在伏格列波糖与人血清白蛋白结合位点中,在人血清白蛋白157处的疏水性的苯丙氨酸却在其他物种中都是极性的酪氨酸,也只有Phe157处是与米格列醇不同,其他的都相同。结果表明,米格列醇和伏格列波糖与血清白蛋白结合位点处的氨基酸在其他物种中大部分都是保守的,只有少数的氨基酸不同。也说明大多数结合位点在不同物种中都是疏水性的氨基酸,不同的氨基酸往往它们的极性也不相同。值得注意的是,与米格列醇和伏格列波糖能够形成的氢键的氨基酸在其他物种中都是与人血清白蛋白保持一致的。
*注:彩图见电子版(http://swxxx.alljournals.cn/ch/index.aspx)(2017年第3期DOI:10.3969/j.issn.1672-5565.2017.03.201611002)。
|
图 6 米格列醇和伏格列波糖与血清白蛋白结合位点的同源序列比对 Figure 6 Homologous alignment of binding site for miglitol and voglibose to serum albumin |
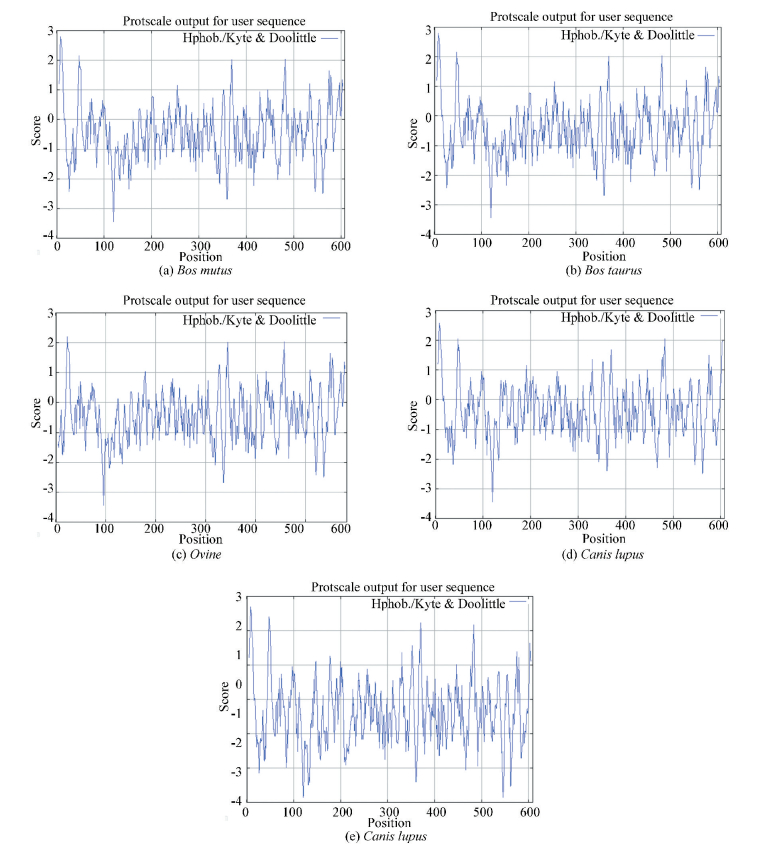
疏水性是20种氨基酸均固有的特性,是决定蛋白质最终三维空间构象的重要因素之一。用ExPASy的Protscale程序计算Homo sapiens、Canis lupus、Ovine、Bos Taurus和Bos mutus的血清白蛋白的疏水性图谱(见图 7)。纵坐标0值以上为疏水区,0值以下为亲水区。纵坐标代表疏水性的分值,分值越高,疏水性越强,横坐标代表氨基酸的位置。从图 7中可以看出,肽链的疏水性氨基酸分布在这5个物种中都比较相似,疏水性的氨基酸少于亲水性的氨基酸,可以认为该蛋白质为亲水性的蛋白。另外,用ExPASy提供的在线跨膜区预测的TMHMM和TMPRED软件[15]对这5个物种的血清白蛋白的序列跨膜区分析发现,它们都没有跨膜螺旋,位于膜外,处于膜内的、跨膜的概率均为0。由此可以说明,血清白蛋白作为血液系统的重要组分,是亲水性的蛋白,这在Canis lupus、Ovine、Bos Taurus和Bos mutus物种中类似的。它具有结合和运输内源性及外源性物质的特性,例如可逆性的结合药物小分子,并将其运输到靶点部位达到治疗疾病的目的[16]。其中米格列醇、伏格列波糖与人血清白蛋白的结合位点处的氨基酸中亲水性的氨基酸较多,疏水性的氨基酸少。在其他4个亲缘关系较近的物种中的同源序列中也具有同样的现象。
|
图 7 血清白蛋白序列的疏水性分析 Figure 7 The hydrophobieity profile of serum albumin sequences |
血清白蛋白是机体循环系统中含量最丰富的储存与运输蛋白, 有许多重要的生理学与药理学功能,能与许多内源和外源性物质如脂肪酸、氨基酸、荷尔蒙、阴阳离子和药物等结合。血清白蛋白对药物的药代动力学特别是其在人体中的分布有着重要的作用,大部分药物成分在人体中的运转首先通过与血清白蛋白的结合,然后到达靶标组织起到存储和转运作用。人血清白蛋白(HSA)与牛血清白蛋白(BSA)被相关研究人员广泛采用为模型生物大分子。大多数药物在血清白蛋白上的结合部位为亚结构域ⅡA和ⅢA,其中ⅢA的活性最高。然而,其他物种特别是一些与人类亲缘关系较近的哺乳动物上的血清白蛋白的结构、性质等的了解都还比较少。
本文基于生物信息学的方法分析不同物种的血清白蛋白的特点和进化关系,分析米格列醇与人血清白蛋白相互作用位点及其在其他亲缘关系较近的物种中相应的氨基酸变化特点,以及血清白蛋白的疏水性及其与米格列醇结合位点处的氨基酸特征。研究发现米格列醇、伏格列波糖与人血清白蛋白的结合能分别是-3.65 Kcal/mol和-3.52 Kcal/mol,结合位点都位于人血清白蛋白亚区IB的疏水腔中,其间的主要作用力是氢键和疏水作用力。米格列醇和伏格列波糖与血清白蛋白大多数结合位点在不同物种中都是疏水性的氨基酸,结合位点处的氨基酸在其他物种中大部分都是保守的,只有少数的氨基酸不同,且极性也不相同。其他物种中与米格列醇和伏格列波糖能形成氢键的氨基酸都与人血清白蛋白保持一致。血清白蛋白是亲水性的蛋白,这在Canis lupus、Ovine、Bos Taurus和Bos mutus物种中是类似的。米格列醇和伏格列波糖与人血清白蛋白的结合位点处的氨基酸中亲水性的氨基酸较多,疏水性的氨基酸少,其他4个亲缘关系较近的物种也存在同样的现象。这些基于生物信息学的分析为进一步研究降血糖药物在其他物种中的表现及相互作用等提供了重要的科学依据。
| [1] |
边平风, 马林, 王旭, 等. 荧光猝灭法和动态光散射法研究尿素-水混合溶剂中牛血清白蛋白的构象变化[J]. 化学学报, 2008, 66(18): 2037-2042. BIAN Pingfeng, MA Lin, WANG Xu, et al. Conformational study of bovine serum albumin in urea-water mixtures by fluorescence quenching technique and dynamic light scattering measurements[J]. Acta Chimica Sinica, 2008, 66(18): 2037-2042. DOI:10.3321/j.issn:0567-7351.2008.18.004 (  0) 0) |
| [2] |
CURRY S, BRICK P, FRANKS N P. Fatty acid binding to human serum albumin: new insights from crystallographic studies[J]. Biochimica et Biophysica Acta, 1999, 1441(2/3): 131-140. DOI:10.1016/S1388-1981(99)00148-1 (  0) 0) |
| [3] |
CARTER D C, HO J X. Structure of serum albumin[J]. Advances in Protein Chemistry, 1994, 45: 153-204. DOI:10.1016/S0065-3233(08)60640-3 (  0) 0) |
| [4] |
齐燕姣, 陆会宁, 金能智, 等. α-葡萄糖苷酶与米格列醇相互作用及其进化关系[J]. 生物信息学, 2015, 13(3): 141-149. QI Yanjiao, LU Huining, JIN Nengzhi, et al. Interaction and evolutional analysis of α-glucosidases and miglitol[J]. Chinese Journal of BioInformatics, 2015, 13(3): 141-149. DOI:10.3969/j.issn.1672-5565.2015.03.01 (  0) 0) |
| [5] |
张巍, 赵雨, 白雪媛, 等. 黄芩素和黄芩苷与人血清白蛋白相互作用的光谱研究[J]. 高等学校化学学报, 2010, 31(9): 1834-1840. ZHANG Wei, ZHAO Yu, BAI Xueyuan, et al. Studies on the interaction for baicalein and baicalin with human serum albumin by spectroscopic methods[J]. Chemical Journal of Chinese Universities, 2010, 31(9): 1834-1840. (  0) 0) |
| [6] |
吴秋华, 周欣, 臧晓欢, 等. 白藜芦醇与人血清白蛋白相互作用的光谱研究[J]. 光谱学与光谱分析, 2009, 29(1): 226-230. WU Qiuhua, ZHOU Xin, ZANG Xiaohuan, et al. Spectroscopic study on the interaction between resveratrol and human serum albumin[J]. Spectroscopy and Spectral Analysis, 2009, 29(1): 226-230. DOI:10.3964/j.issn.1000-0593(2009)01-0226-05 (  0) 0) |
| [7] |
MA Xiaoli, YAN Jin, WANG Qing, et al. Spectroscopy study and co-administration effect on the interaction of mycophenolic acid and human serum albumin[J]. International Journal of Biological Macromolecules, 2015, 77: 280-286. DOI:10.1016/j.ijbiomac.2015.03.052 (  0) 0) |
| [8] |
CHEN Xu, QIAN Kai, CHEN Qin. Comparison between loureirin A and cochinchinenin C on the interaction with human serum albumin[J]. European Journal of Medicinal Chemistry, 2015, 93: 492-500. DOI:10.1016/j.ejmech.2015.02.025 (  0) 0) |
| [9] |
REHMAN M T, SHAMSI H, KHAN A U. Insight into the binding mechanism of imipenem to human serum albumin by spectroscopic and computational approaches[J]. Molecular Pharmaceutics, 2014, 11(6): 1785-1797. DOI:10.1021/mp500116c (  0) 0) |
| [10] |
KAMTEKAR N, PANDEY A, AGRAWAL N, et al. Interaction of multimicrobial synthetic inhibitor 1, 2-bis(2-benzimidazolyl)-1, 2-ethanediol with serum albumin: spectroscopic and computational studies[J]. PLoS One, 2013, 8(1): e53499. DOI:10.1371/journal.pone.0053499 (  0) 0) |
| [11] |
王月荣, 刘馥婷, 章弘扬, 等. 丹酚酸B与牛血清白蛋白相互作用的电化学研究[J]. 分析测试学报, 2012, 31(3): 267-272. WANG Yuerong, LIU Futing, ZHANG Hongyang, et al. Investigation on electrochemical behavior of interaction between salvianolic acid B and bovine serum albumin at DNA modified electrode[J]. Journal of Instrumental Analysis, 2012, 31(3): 267-272. DOI:10.3969/j.issn.1004-4957.2012.03.005 (  0) 0) |
| [12] |
HAMDI O A A, FEROZ S R, SHILPI J A, et al. Spectrofluorometric and molecular docking studies on the binding of curcumenol and curcumenone to human serum albumin[J]. International Journal of Molecular Sciences, 2015, 16(3): 5180-5193. DOI:10.3390/ijms16035180 (  0) 0) |
| [13] |
GASTEIGER E, HOOGLAND C, GATTIKER A, et al. Protein identification and analysis tools on the ExPASy server[M]. WALKER J M, ed: The Proteomics Protocols Handbook. New York City:Humana Pres, 2005:571-607. DOI: 10.1385/1-59259-890-0:571.
(  0) 0) |
| [14] |
TAMURA K, STECHER G, PETERSON D, et al. MEGA6: molecular evolutionary genetics analysis version 6.0[J]. Molecular Biology and Evolution, 2013, 30(12): 2725-2729. DOI:10.1093/molbev/mst197 (  0) 0) |
| [15] |
HOFMANN K, STOFFEL W. TMbase-A database of membrane spanning proteins segments[J]. Biological Chemistry Hoppe-Seyler, 1993, 374: 166-170. DOI:10.1515/bchm3.1993,374.1-6.143 (  0) 0) |
| [16] |
郭明, 徐兴涛, 吴志武. 中药活性成分土大黄苷与人血清白蛋白的结合反应机制研究[J]. 药学学报, 2011, 46(9): 1084-1092. GUO Ming, XU Xingtao, WU Zhiwu. Binging mechanism of rhaponticin and human serum albumin[J]. Acta Pharmaceutica Sinica, 2011, 46(9): 1084-1092. (  0) 0) |
 2017, Vol. 15
2017, Vol. 15


