2. 西北民族大学 化工学院,兰州 730124
2. School of Chemical Engineering, Northwest Minzu University, Lanzhou 730124, China
天然的黄酮类化合物广泛存在于高等植物中,由于它具有广谱的药理活性和较低的毒性,对很多疾病的治疗起到非常重要的作用[1],对一些癌症也有非常强的治疗活性[2],具有很高的药用价值。黄酮类化合物具有清除自由基和减少自由基的产生、抗脂质过氧化、提升体内抗氧化水平、能显著降低动物就人体的血清甘油三脂含量、提升高密度蛋白胆固醇含量等作用[3]。在大量的生物医学实验证实氧自由基与机体损伤有着十分密切的关系[4-5]。黄酮类化合物在清除自由基方面的最主要机制是黄酮分子上的酚羟基与自由基反应之后,生成比较稳定的半醌式自由基,从而终止自由基链式反应[6]。这类化合物的清除自由基的活性,取决于环上羟基的抽氢反应时的难易程度和在抽氢以后生成自由基的稳定程度。
槲皮素是黄酮类化合物中活性最高的化合物之一,在医药方面有很强的药效功效,在芒果、苹果、梨、葡萄、樱桃、茶叶、洋葱、胡萝卜以及红酒等这些物质中的富含量很高[7-8]。槲皮素类化合物在祛痰、止咳平喘、降血压、降血脂、冠状动脉扩张、抗肿瘤、抗菌、抗病毒、镇痛等有一定的生理活性[9],具有很高的医用价值。
因此,研究槲皮素类黄酮分子的抗氧化活性,在筛选优良的抗氧化剂、合理设计和合成新抗氧化剂,拓宽其应用范围具有非常重要的意义。密度泛函理论也已大量应用于槲皮素类黄酮化合物的计算中[10-13]。本文选取两种槲皮素类黄酮化合物异鼠李素(Isorhamnetin)和异鼠李素-3-O-葡萄糖苷(Isorhamnetin-3-O-glucoside)作为目标化合物,运用Gaussian 09软件DFT(密度泛函)[14-15]的方法从分子总能量、O-H解离焓(BDE)的理论表征、前线分子轨道及其轨道能级分析、原子的净电荷布居分析等方面研究它们的抗氧化活性大小的机理,为获得高效的抗氧化剂和对抗氧化剂的结构改良提供了重要的科学依据。
1 材料与方法 1.1 异鼠李素及异鼠李素-3-O-葡萄糖苷的结构异鼠李素(Isorhamnetin)和异鼠李素-3-O-葡萄糖苷(Isorhamnetin-3-O-glucoside)的分子结构如图 1所示。
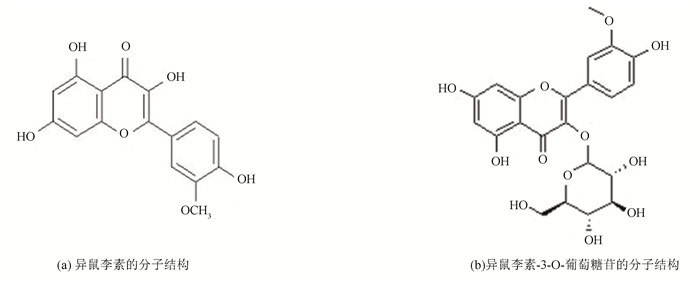
|
图 1 异鼠李素及异鼠李素-3-O-葡萄糖苷的分子式结构 Figure 1 Chemical structure of Isorhamnetin and Isorhamnetin-3-O-glucoside |
采用Gaussian 09密度泛函理论(DFT)中的B3LYP方法在6-311++G基组水平上对异鼠李素及异鼠李素-3-O-葡萄糖苷及其脱氢自由基的衍生物进行构型全优化,并得到分子总能量、O-H解离焓(bond dissociation energy, BDE)、前线分子轨道及其轨道能级、原子的净电荷布居等量化参数。H-O解离焓计算为
BDE=Ehr+Esr-Es.
式中:Ehr为氢原子的焓; Esr为母体分子失去羟基氢原子后衍生的自由基的焓; Es为母体分子的焓。
2 结果与分析 2.1 异鼠李素及异鼠李素-3-O-葡萄糖苷分子的总能量异鼠李素及异鼠李素-3-O-葡萄糖苷的分子总能量见表 1。表 1中,体系能量的大小与π电子的离域程度有着密切关系,当共轭大π键越大时,化合物体系的能量就会越低,其中异鼠李素的共轭键是较短的,异鼠李素-3-O-葡萄糖苷的共轭键是较长的。结果表明分子能量大小为:异鼠李素>异鼠李素-3-O-葡萄糖苷。当分子中羟基的数量越多的时候,所对应分子的能量就越低。
| 表 1 异鼠李素及异鼠李素-3-O-葡萄糖苷分子的总能量 Table 1 The total energy of Isorhamnetin and Isorhamnetin-3-O-glucoside |
O-H解离焓(BDE)是在生成自由基或者原子时用来表现反应焓变的理论表征,是用于对自由基稳定性判断的重要依据,可以用来对消除自由基的活性大小的衡量。所选化合物O-H键的强度与抗氧化剂清除自由基的活性有着非常密切的关系,可以看作是判断化学键强弱的判据,O-H键的强度越低,键越弱,反应时就越容易使旧键断裂,抗氧化剂活性越高;相反的,分子O-H键的强度越高,它的抗氧化剂活性就越低[16-19]。表 2列出了异鼠李素和异鼠李素-3-O-葡萄糖苷分子中不同位置的羟基脱氢后的O-H解离焓。异鼠李素失去了C3、C4'、C5、C7位,异鼠李素-3-O-葡萄糖苷失去了C4'、C5、C7位的酚羟基氢原子后生成7个自由基,计算得到相对应的酚羟基O-H解离焓。
| 表 2 异鼠李素及异鼠李素-3-O-葡萄糖苷各羟基的H-O解离焓(a.u.) Table 2 The dissociation enthalpy of H-O bond of Isorhamnetin and Isorhamnetin-3-O-glucoside |
表 2表明,H-O解离焓活性大小为:Isorhamnetin_4'OH > Isorhamnetin_3OH > Isorhamnetin_7OH>Isorhamnetin_5OH>Isorhamnetin-3-O-glucoside_4'OH>Isorhamnetin-3-O-glucoside_7OH>Isorhamnetin-3-O-glucoside_5OH。异鼠李素的H-O解离焓整体明显小于异鼠李素-3-O-葡萄糖苷,说明异鼠李素的抗氧化活性大于异鼠李素-3-O-葡萄糖苷。异鼠李素中Isorhamnetin_5OH的H-O解离焓是最大的,Isorhamnetin_4'OH的H-O解离焓是最小的。异鼠李素-3-O-葡萄糖苷中Isorhamnetin-3-0-glucoside_5OH的H-O解离焓是最大的,Isorhamnetin-3-0-glucoside_4'OH的H-O解离焓是最小的。两个分子的自由基都是5位失去酚羟基上的氢原子后所得的H-O解离焓最大,4'位失去氢原子后所得的H-O解离焓最小。这表明4'位的酚羟基失去氢之后对抗氧化活性的整体影响是最大的,酚羟基在这个位置上就具有较明显的高活性特征。
2.3 前线分子轨道及其轨道能级分析根据前线分子轨道理论[20],分子稳定性与能级差ΔE (LUMO-HOMO)的大小关系较为密切,它反映了电子从最高占据轨道(HOMO)向最低空轨道(LUMO)跃迁时需要的能量大小,当能级差越小时,电子就越容易被激发出去,化学反应也就越容易进行。对异鼠李素和异鼠李素-3-O-葡萄糖苷所得出的9个分子的前线轨道能级的相关数据见表 3。
| 表 3 9个分子的最高占据轨道能和最低占据空轨道能及能级差(a.u.) Table 3 The values of EHOMO, ELUMO and ΔE(LUMO-HOMO) of the nine molecules |
表 3显示,异鼠李素的ΔE (LUMO-HOMO)要明显小于异鼠李素-3-O-葡萄糖苷,表明异鼠李素的活性比异鼠李素-3-O-葡萄糖苷的活性大,分子当引入糖苷时,分子活性降低。异鼠李素和异鼠李素-3-O-葡萄糖苷失去酚羟基上的氢后能级差明显变小,这说明当化合物中失去酚羟基上的氢时,使化合物的能级变小,活性增大,对分子的整体活性有很大影响。
图 2为异鼠李素和异鼠李素-3-O-葡萄糖苷以及衍生的自由基分子所对应的最高占据分子轨道(HOMO)和最低空轨道(LUMO)图。其中,图 2(a)、图 2(b)分别为异鼠李素的最高占据分子轨道和最低空轨道图,图 2(c)、图 2(d)分别为异鼠李素Isorhamnetin_3OH的最高占据分子轨道和最低空轨道图,图 2(e)、图 2(f)分别为异鼠李素Isorhamnetin_4'OH的最高占据分子轨道和最低空轨道图,图 2(g)、图 2(h)分别为异鼠李素Isorhamnetin_5OH的最高占据分子轨道和最低空轨道图,图 2(i)、图 2(j)分别为异鼠李素Isorhamnetin_7OH的最高占据分子轨道和最低空轨道图,图 2(k)、图 2(l)分别为异鼠李素-3-O-葡萄糖苷的最高占据分子轨道和最低空轨道图,图 2(m)、图 2(n)分别为异鼠李素-3-O-葡萄糖苷Isorhamnetin-3-O-glucoside_4'OH的最高占据分子轨道和最低空轨道图,图 2(o)、图 2(p)分别为异鼠李素-3-O-葡萄糖苷Isorhamnetin-3-O-glucoside_5OH的最高占据分子轨道和最低空轨道图,图 2(q)、图 2(r)分别为异鼠李素-3-O-葡萄糖苷Isorhamnetin-3-O-glucoside_7OH的最高占据分子轨道和最低空轨道图。图 2结果显示,轨道图结构的位置主要集中在苯环、C=O双键、C=C双键、C-O单键及对应的酚羟基上,是离域的共轭π轨道。对异鼠李素和异鼠李素-3-O-葡萄糖苷的轨道图进行对比后发现在异鼠李素的结构基础上加入糖环后,它的共轭环上的轨道结构几乎没有发生变化,只是轨道图的能级差稍微发生一些变化,这表明在形成前线分子轨道时,糖苷上的羟基并没有参与前线分子轨道的形成。但是,糖苷的增加对于化合物的极性发生了改变,对于异鼠李素-3-O-葡萄糖苷的溶解度和吸收度有了很大的改善。
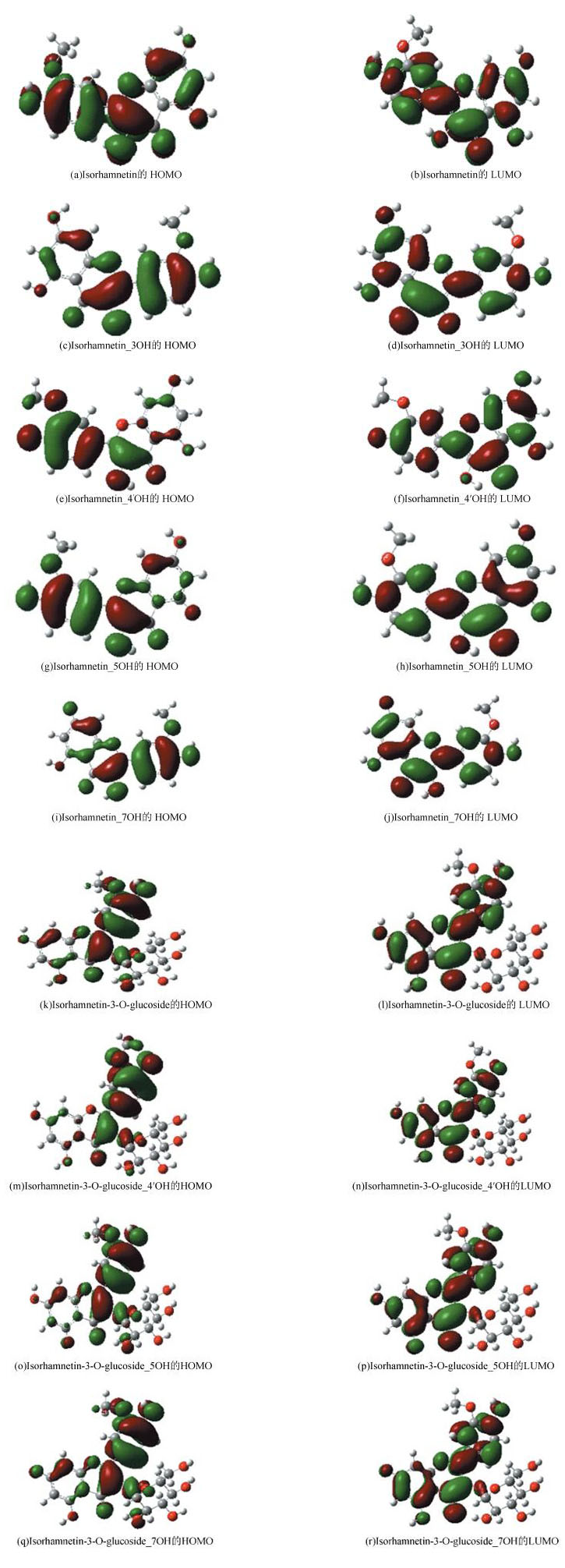
|
图 2 异鼠李素和异鼠李素-3-O-葡萄糖苷及衍生自由基的前线轨道结构 Figure 2 The frontier molecular orbital structure of Isorhamnetin and Isorhamnetin-3-O-glucoside and its free radicals |
在电荷反应中,当原子中带的负电荷数越多时,与亲电试剂反应的程度越大,当正电荷越多时,亲核试剂的进攻机会越多,且正电荷越大时,与带负电的化合物反应越容易。通过对Mulliken的布局分析[21],可以得到原子净电荷的分布。表 4中列出了异鼠李素及异鼠李素-3-O-葡萄糖苷分子的原子净电荷。结果显示,两种化合物的O原子电荷都是负的,H原子电荷都为正的,异鼠李素的C原子所带正电荷大于异鼠李素-3-O-葡萄糖苷,当正电荷越大时,反应越活泼。因此,异鼠李素的抗氧化活性大于异鼠李素异鼠李素-3-O-葡萄糖苷。
| 表 4 异鼠李素及异鼠李素-3-O-葡萄糖苷分子的电荷布局 Table 4 Atomic net charge of Isorhamnetin and Isorhamnetin-3-O-glucoside and its free radicals |
运用Gaussian软件的密度泛函(DFT)的方法,对两种槲皮素类黄酮化合物异鼠李素和异鼠李素-3-O-葡萄糖苷及其自由基进行了结构优化和量化计算,从分子的总能量、O-H解离焓(BDE)的理论表征、前线分子轨道及其轨道能级分析、原子的净电荷布局分析等方面对两种化合物的活性进行了研究。
结果显示,异鼠李素分子能量大于异鼠李素-3-O-葡萄糖苷。异鼠李素类的O-H解离焓(BDE)比异鼠李素异鼠李素-3-O-葡萄糖类明显小,两类分子自由基的5位失去酚羟基的氢原子后O-H解离焓(BDE)是最大的,4'位失去酚羟基氢原子后O-H解离焓(BDE)是最小的,当分子衍生自由基的O-H解离焓(BDE)越小时,它的抗氧化活性越大,这表明它们4'位的酚羟基失去氢之后对抗氧化活性的整体影响是最大的,酚羟基在这个位置上就具有较明显的高活性特征,在异鼠李素的抗氧化活性上是增效的。异鼠李素的能级差ΔE (LUMO-HOMO)要明显小于异鼠李素-3-O-葡萄糖苷,异鼠李素和异鼠李素-3-O-葡萄糖苷失去酚羟基上的氢后能级差明显变小,表明异鼠李素的活性比异鼠李素-3-O-葡萄糖苷的活性大,当分子中引入糖苷时,分子活性降低,而且当化合物中失去酚羟基上的氢时,使化合物的能级变小,活性增大,对分子的整体活性有很大影响。对异鼠李素和异鼠李素-3-O-葡萄糖苷的轨道图进行对比后发现在异鼠李素的结构基础上加入糖环后,它的共轭环上的轨道结构几乎没有发生变化,只是轨道图的能级差稍微发生一些变化,这表明在形成前线分子轨道时,糖苷上的羟基并没有参与前线分子轨道的形成。但是,糖苷的增加对于化合物的极性发生了改变,对于异鼠李素-3-O-葡萄糖苷的溶解度和吸收度有了很大的改善。净电荷布局分析发现异鼠李素的C原子所带正电荷大于异鼠李素-3-O-葡萄糖苷,当正电荷越大时,反应越活泼,说明异鼠李素的抗氧化活性大于异鼠李素异鼠李素-3-O-葡萄糖苷。
综合上述计算结果,这两种槲皮素类黄酮化合物的抗氧化活性大小为:异鼠李素>异鼠李素异鼠李素-3-O-葡萄糖苷,不同位点不同基团显示出了不同的活性。在以后的研究工作中,在槲皮素类黄酮化合物母体结构不同位点设计不同基团,通过结构改良来设计高效的抗氧化剂,这为获得高效的抗氧化剂和对抗氧化剂的结构改良提供了重要的科学依据,具有非常好的参考价值。
| [1] |
BORS W, HELLER W, MICHEL C, et al. Flavonoids as antioxidants: Determination of radical-scavenging efficiencies[J]. Methods in Enzymology, 1990, 186: 343–355.
DOI:10.1016/0076-6879(90)86128-I( 0) 0)
|
| [2] |
王宪楷. 天然药物化学[M]. 北京: 人民卫生出版社, 1988: 272-275.
WANG Xiankai. Natural medicinal chemistry[M]. Beijing: People's Medical Publishing House, 1988: 272-275. (  0) 0)
|
| [3] |
吕庆章, 李小娟, 牛静, 等. 黄酮类化合物抗氧化活性理论研究[J]. 河南师范大学学报:自然科学版, 2009, 37(3): 80–84.
LV Qingzhang, LI Xiaojuan, NIU Jing, et al. Theoretical studies on antioxidation activity of six flavonoid antioxidants[J]. Journal of Henan Normal University(Natural Science), 2009, 37(3): 80–84. (  0) 0)
|
| [4] |
CROSS C E, HALLIWELL B, BORISH E T, et al. Oxygen radicals and human disease[J]. Annals of Internal Medicine, 1987, 107(4): 526–545.
DOI:10.7326/0003-4819-107-4-526( 0) 0)
|
| [5] |
NYSTRÖM T. The free-radical hypothesis of aging goes prokaryotic[J]. Cellular and Molecular Life Sciences CMLS, 2003, 60(7): 1333–1341.
DOI:10.1007/s00018-003-2310-X( 0) 0)
|
| [6] |
YOKOZAWA T, DONG E, LIU Zhongwa, et al. Antioxidative activity of flavones and flavonols in vitro[J]. Phytotherapy Research, 1997, 11(6): 446–449.
DOI:10.1002/(SICI)1099-1573(199709)11:6<446::AID-PTR128>3.0.CO;2-8( 0) 0)
|
| [7] |
MONTORO P, BRACA A, PIZZA C, et al. Structure-antioxidant activity relationships of flavonoids isolated from different plant species[J]. Food Chemistry, 2005, 92(2): 349–355.
DOI:10.1016/j.foodchem.2004.07.028( 0) 0)
|
| [8] |
LEOPOLDINI M, RUSSO N, CHIODO S, et al. Iron chelation by the powerful antioxidant flavonoid quercetin[J]. Journal of Agricultural and Food Chemistry, 2006, 54(17): 6343–6351.
DOI:10.1021/jf060986h( 0) 0)
|
| [9] |
徐建东. 槲皮素衍生物的合成及其抗氧化活性的研究[D]. 济南: 山东师范大学, 2013.
XU Jiandong. The studied on synthesis and antioxidant activities of quercetin derivatives[D].Jinan:Shandong Normal University, 2013.
( 0) 0)
|
| [10] |
ROGINSKY V A, BARSUKOVA T K, REMOROVA A A, et al. Moderate antioxidative efficiencies of flavonoids during peroxidation of methyl linoleate in homogeneous and micellar solutions[J]. Journal of the American Oil Chemists' Society, 1996, 73(6): 777–786.
DOI:10.1007/BF02517955( 0) 0)
|
| [11] |
吴莉. 花青素类化合物抗氧化活性的密度泛函理论研究[D]. 新乡: 河南师范大学, 2015.
WU Li. Density functional theory calculations on the antioxidant activity of anthocyanins[D]. Xinxiang:Henan Normal University, 2015.
( 0) 0)
|
| [12] |
谢湖均, 雷群芳, 方文军. 槲皮素抗氧化活性的密度泛函理论研究[J]. 化学学报, 2010, 68(15): 1467–1472.
XIE Hujun, LEI Qunfang, FANG Wenjun. Density functional theory study on the antioxidation activity of quercetin[J]. Acta Chimica Sinica, 2010, 68(15): 1467–1472. (  0) 0)
|
| [13] |
胡栋宝, 赵剑雄. 中药满山红中4个黄酮类化合物结构及其抗氧化活性的理论研究[J]. 中国中药杂志, 2016, 41(14): 2675–2679.
HU Dongbao, ZHAO Jianxiong. Density functional theory investigation on antioxidation activity of four flavonoids from Rhododendri Daurici Folium[J]. China Journal of Chinese Materia Medica, 2016, 41(14): 2675–2679. DOI:10.4268/cjcmm20161418(  0) 0)
|
| [14] |
BECKE A D. Density-functional thermochemistry. Ⅲ. The role of exact exchange[J]. Journal of Chemical Physics, 1993, 98(7): 5648–5653.
DOI:10.1063/1.464913( 0) 0)
|
| [15] |
LEE C, YANG W, PARR R G. Development of the Colle-Salvetti correlation-energy formula into a functional of the electron density[J]. Physical Review B Condensed Matter, 1988, 37(2): 785–789.
DOI:10.1103/PhysRevB.37.785( 0) 0)
|
| [16] |
张红雨, 陈德展. 酚类抗氧化剂清除自由基活性的理论表征与应用[J]. 生物物理学报, 2000, 16(1): 1–9.
ZHANG Hongyu, CHEN Dezhan. Theoretical characterization and its application of free[J]. Acta Biophysica Sinica, 2000, 16(1): 1–9. DOI:10.3321/j.issn:1000-6737.2000.01.001(  0) 0)
|
| [17] |
张红雨. 黄酮类抗氧化剂结构活性关系的理论解释[J]. 中国科学:B辑, 1999, 29(1): 91–96.
ZHANG Hongyu. Theoretical explanation of the structure activity relationship of flavonoids[J]. Science in China (Series B), 1999, 29(1): 91–96. DOI:10.3321/j.issn:1006-9240.1999.01.013(  0) 0)
|
| [18] |
徐顺. 穿心莲内酯衍生物抑制糖苷酶的3D-QSAR及多羟基酚类化合物的抗氧化理论研究[D]. 郑州: 郑州大学, 2006. DOI: 10.7666/d.y948321.
XU Shun. Study on antioxidant theory of andrographolide derivatives inhibit glycosidases, 3D-QSAR and phenolic compounds[D]. Zhengzhou:Zhengzhou University, 2006. DOI:10.7666/d.y948321.
( 0) 0)
|
| [19] |
SUN Youmin, ZHANG Hongyu, CHEN Dezhan, et al. Theoretical elucidation on the antioxidant mechanism of curcumin: a DFT study[J]. Organic Letters, 2002, 4(17): 2909–2911.
DOI:10.1021/ol0262789( 0) 0)
|
| [20] |
周公度, 段连运. 结构化学基础[M]. 4版. 北京: 北京大学出版社, 2014.
ZHOU Gongdu, DUAN Lianyun. Foundation of structural chemistry[M]. 4th ed. Beijing: Peking University press, 2014. (  0) 0)
|
| [21] |
蒋柳云, 刘玉明. 两种槲皮素-Zn配合物的抗氧化活性及其结构的量子化学研究[J]. 有机化学, 2005, 25(6): 684–689.
JIANG Liuyun, LIU Yuming. Study on antioxidative activities and quantum chemistry calculation of two quercetin-zinc complexes[J]. Chinese Journal of Organic Chemistry, 2005, 25(6): 684–689. DOI:10.3321/j.issn:0253-2786.2005.06.012(  0) 0)
|
 2017, Vol. 15
2017, Vol. 15


