2. 中国药科大学 药学院,南京 211198
2. Department of Pharmaceutics, China Pharmaceutical University, Nanjing 211198, China
由禾谷镰刀菌(Fusarium graminearum)引起的赤霉病是一种影响小麦产量和品质的世界性小麦病害[1]。小麦赤霉病在中国长江中下游冬麦区及东北春麦区东部一直发生严重,近年来受气候变暖的影响,小麦赤霉病流行区域不断扩大,已经向黄淮麦区、北方麦区以及西南和西北麦区扩展[2]。赤霉病一般流行年份可引起5%~10%的产量损失,大流行年份可导致绝收。2012年的赤霉病大流行中,江苏省苏中地区赤霉病重发区产量损失就达301.5~1877.3 kg/hm2[3]。相对于产量和品质的损失,禾谷镰刀菌产生毒素对人畜健康的影响更大,感病麦粒中主要包含两类毒素,一类为单端孢霉烯化合物(Trichothecenes),另一类为玉米赤霉病烯酮(Zearalenone,ZEN)[4]。含有DON的饲料影响动物肠道对营养的吸收[5],并且损伤人和动物的免疫系统[6],引起急性和慢性中毒[7]。另外,DON毒素还与禾谷镰刀菌在寄主中的扩展有关,DON及其衍生物可以破坏寄主的防卫反应,是病原菌在小麦穗中定殖和扩展的必需产物[8]。ZEN为雌性激素类似物,对人畜健康的危害更大[9]。中国、欧盟和美国、加拿大均要求面粉、面包或饼干等食品中DON毒素的限量标准为1 000 μg/kg(GB 2761-2011)。甄阳光等[10]调查了2008~2009年度中国11个省的1 018个饲料样品的毒素污染情况发现,DON毒素的检出率达95.8%,超标率达17.7%,其中西北地区的超标率达38.1%,华北和华中地区的超标率分别为21.0%和20.1%。随着小麦赤霉病发病区域不断扩大,赤霉病菌产生的毒素污染问题不断加重,严重威胁食品安全。
病原真菌生长、分化、繁殖、致病以及真菌毒素合成是受一系列信号转导途径调控的,其中异三聚体G蛋白介导的信号转导在病原菌侵染致病及真菌毒素合成中扮演着重要角色[11]。G蛋白偶联系统由G蛋白偶联受体(G protein coupled receptors,GPCRs)接受胞外信号,并传递到胞内激活G蛋白,从而引起下游信号分子的连续激活,导致细胞内部基因的表达发生变化[12]。GPCR介导多种生物学功能,因而可作为药物靶标。目前大约30%药物是以GPCR为靶标的[13]。
禾谷镰刀菌分子互作及基因表达的系统生物学网络解析表明,G蛋白偶联受体是禾谷镰刀菌致病的重要的信号传导系统之一[14],Yu等[15]发现敲除禾谷镰刀菌中的Gα亚基或Gβ亚基,能促进DON和ZEA毒素的产生。在G蛋白偶联受体介导信号传导中,cAMP信号通路参与调控了多种真菌致病过程[11]。禾谷镰刀菌同属的藤仓赤霉(Fusarium fujikuroi)中的G蛋白偶联cAMP途径参与了镰红菌素的合成[16],尖孢镰刀菌(Fusarium oxysporum)的Fga1和Fga3的Gα亚基已经被鉴定,与cAMP-PKA途径相关联[17]。这些结果表明,G蛋白偶联受体介导的cAMP信号通路可能参与了赤霉病病原菌的致病和毒素合成。
综上所述,cAMP的蛋白激酶途径可能是禾谷镰刀菌调控小麦赤霉病致病及毒素产生过程的重要信号通路之一,但其上游的G蛋白偶联受体尚缺乏研究。本文拟基于生物信息学方法,对该菌的cAMP受体类型的G蛋白偶联受体(GPCRs)基因结构及其理化性质等进行分析,为深入了解禾谷镰刀菌侵染导致小麦赤霉病的作用机制及以GPCRs为靶标的新型杀菌剂研发提供参考依据。
1 材料与方法 1.1 蛋白序列的获得根据禾谷镰刀菌F. graminearum基因组数据库(http://www.ncbi.nlm.nih.gov/genome/?term=Fusarium+graminearum)中获得相应的GPCRs蛋白序列及相关信息。
1.2 蛋白跨膜结构分析利用TMHMM Serverv.2.0(http://www.cbs.dtu.dk/services/TMHMM-2.0/)在线对F. graminearum中所含cAMP类型GPCRs的跨膜结构进行分析,并根据每个跨膜结构的相对位置绘制出各蛋白的结构示意图。
1.3 亚细胞定位分析对F. graminearum中所含cAMP类型GPCRs进行亚细胞定位分析,利用ProtComp v9.0 (http://linux1.softberry.com/berry.phtml?topic=protcompan&group=programs&subgroup=proloc)实现,以期获得蛋白质的定位情况。
1.4 蛋白质理化性质分析用ProtParam软件推测F. graminearum中所含的cAMP类型GPCRs的理化性质,并利用Protscale程序(http://web.expasy.org/protscale)对F. graminearum中所有cAR蛋白进行疏水性测定。
1.5 蛋白质二级结构分析采用PHD在线分析对F. graminearum中所含的cAMP类型GPCRs蛋白进行蛋白质二级结构预测(http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index)。
1.6 磷酸化位点分析以NetPhos2.0 Server程序(http://www.cbs.dtu.dk/services/NetPhos/)对F. graminearum中所有cAR (cAMP receptor)蛋白磷酸化位点进行分析。
1.7 系统进化树构建在NCBI中,进行BLASTp同源搜索,获得来自于不同物种的同源蛋白质序列。对所获得的同源序列,利用ClustalX进行多重比对分析,随后利用MEGA5.2.2软件构建系统进化树:采用邻近法(neighbor-joining)构建系统发育树,各分支之间的距离计算采用p-Distance模型,系统可信度检测采用自举法重复1 000次进行。
2 结果与分析 2.1 cAMP类GPCR蛋白序列的获得及其跨膜结构基因组测序和基因注释结果表明,禾谷镰刀菌中有5个cAMP受体类型的GPCR基因,NCBI中登录号分别为:FG01861.1、FG07716.1、FG03023.1、FG09693.1和FG5239.1。按基因登录号搜索禾谷镰刀菌数据库获得它们的蛋白序列,将其分别命名为FgcAR1、FgcAR2、FgcAR3、FgcAR4、FgcAR5。利用TMHMM在线软件对它们进行跨膜结构的分析,结果表明这5个蛋白都具有7个跨膜结构域, 如图 1所示。
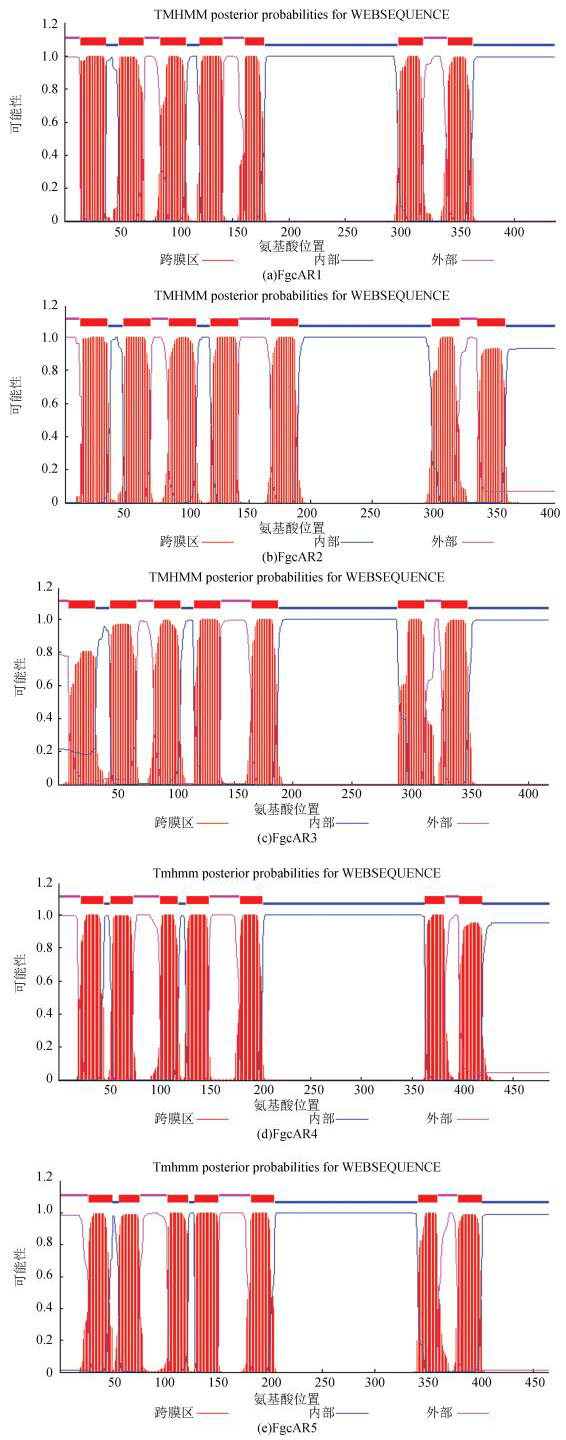
|
图 1 禾谷镰刀菌cAR蛋白结构 Figure 1 The structure of cAR proteins in F. graminearum |
运用TMHMM分析对禾谷镰刀菌5个cAR(cAMP receptor)蛋白进行亚细胞定位(见表 1),结果表明FgcAR1、FgcAR2、FgcAR3、FgcAR4和FgcAR5蛋白定位在细胞膜上的可能性分别为74.9%、70.7%、63.5%、69.4%、58.8%,而定位于核、细胞质、线粒体、内质网等细胞器或胞外的可能性较小。
| 表 1 禾谷镰刀菌cAR亚细胞定位 Table 1 The subcellular localization of cARs in Fusarium graminearum |
用ProtParam软件推测禾谷镰刀菌中所有cAR蛋白的理化性质(见表 2),结果表明5个cAR蛋白在氨基酸数目、分子量和理论等电点上存在差异,其中FgcAR1为亲水性蛋白,而其余4个为疏水性蛋白,不稳定性指数分析表明这些蛋白属于不稳定蛋白。
| 表 2 禾谷镰刀菌cAR蛋白的性质 Table 2 The physical and chemical character of cAR proteins in Fusarium graminearum |
进一步以Protscale程序,根据疏水性值对禾谷镰刀菌的5个cAR蛋白进行疏水性和亲水性分析(见表 3),结果显示,FgcAR1中位于286位的苏氨酸(T)亲水性最强,而位于22位的缬氨酸(V)亲水性最弱;FgcAR2中位于386位的天冬氨酸(D)亲水性最强,而位于22位的缬氨酸(V)亲水性最弱;FgcAR3中位于279位的谷氨酸(E)亲水性最强,而位于179位的苯丙氨酸(F)亲水性最弱;FgcAR5中位于422位的蛋氨酸(M)亲水性最强,而位于141位的脯氨酸(P)亲水性最弱。对上述5个cAR的疏水性值进行统计,FgcAR1、FgcAR2、FgcAR3、FgcAR4和FgcAR5的亲水性氨基酸残基总和分别为-193.097、-121.576、-164.478、-170.587、-170.964,而疏水性氨基酸残基总和分别为142.775、200.159、216.76、201.296、198.165。上述数据进一步表明,除FgcAR1为亲水性蛋白,而其余4个为疏水性蛋白。
| 表 3 禾谷镰刀菌cAR蛋白亲水性与疏水性氨基酸残基位置 Table 3 The hydrophobic and hydrophilic amino acid residue position of cARs in Fusarium graminearum |
以PHD预测禾谷镰刀菌5个cAR蛋白的二级结构,禾谷镰刀菌的5个cAR蛋白均含有大量α螺旋,约占60%左右,而FgcAR4和FgcAR5没有β转角,而FgcAR1、FgcAR2和FgcAR3蛋白二级结构中的β转角比例也较低,所占比例在3%以下。

|
图 2 禾谷镰刀菌cAR蛋白二级结构特征 Figure 2 The secondary structure character of cAR proteins in F. graminearum |
根据磷酸化位点分析,FgcAR1含28个Ser、13个Thr、3个Tyr;FgcAR2含15个Ser、11个Thr、2个Tyr;FgcAR3含29个Ser、15个Thr、7个Tyr;FgcAR4含37个Ser、22个Thr、4个Tyr;FgcAR5含49个Ser、13个Thr、3个Tyr。这些可能为蛋白激酶磷酸化位点。
| 表 4 禾谷镰刀菌cAR蛋白的磷酸化位点 Table 4 The locus of phosphorylation of cAR protein in Fusarium graminearum |
利用NCBI中的BLAST对F graminearum 5个cAR蛋白序列进行BLASTp搜索,获得与FgcAR1、FgcAR2、FgcAR3、FgcAR4和FgcAR5同源的64个蛋白的氨基酸序列,对这些序列进行聚类分析。如图 3结果显示,在F graminearum 5个cAR间,FgcAR1和FgcAR2亲缘关系较近,最先聚为一类,然后与FgcAR4聚为一类,再与FgcAR3聚在一起,它们与FgcAR5亲缘关系最远。但来源于不同种的同源序列之间,FgcAR1与假禾谷镰刀菌(F. pseudograminearum)中的XP_0092252433.1及F. langsethiae中的KPA42588.1亲缘关系最近,FgcAR2与假禾谷镰刀菌中的XP_009261946.1亲缘关系最近,FgcAR3与假禾谷镰刀菌中的XP_00953605.1亲缘关系最近,FgcAR4与假禾谷镰刀菌中的XP_009255690.1及F. langsethiae中的KPA40448.1亲缘关系最近,FgcAR5与F. langsethiae中的KPA43997.1亲缘关系最近。
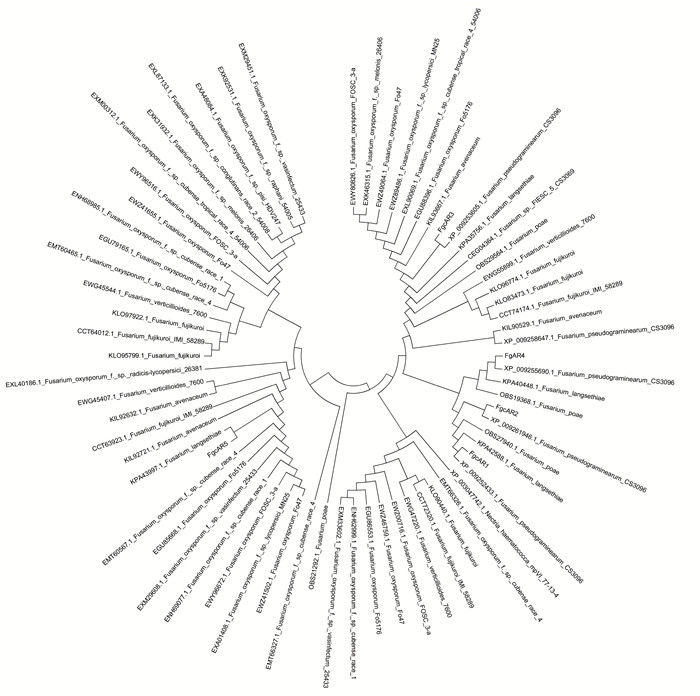
|
图 3 禾谷镰刀菌cAR蛋白与其他物种同源序列的遗传关系 Figure 3 The genetic relationship of cAR proteins in F. graminearum compared with the homologous sequences from other species |
禾谷镰刀菌(F. graminearum)为害小麦穗部引起的小麦赤霉病,不仅造成产量损失和品质下降,而且病原菌侵染后产生的毒素严重威胁着人畜健康,因此研究病原菌致病的遗传因素和分子机制对于防控小麦赤霉病具有重要意义。cAMP反应通路介导的G蛋白信号在许多病原菌的发育与致病中起重要作用[11]。在禾谷镰刀菌中,腺苷酸环化酶和环腺苷酸依赖蛋白激酶信号途径在调节G蛋白信号传导中的功能已经得到证实,依据转录组和表型数据已经初步建立了禾谷镰刀菌cAMP信号传导通路[14, 18-19],利用缺失或抑制表达突变体研究已经明确了与该通路相关的部分基因功能,但有关上游的受体研究尚未见报道[20-21]。本文对禾谷镰刀菌基因组中cAMP受体类型的GPCR蛋白的5个成员进行了跨膜结构和亚细胞定位,结果表明,5个cAR蛋白都具有7个的跨膜结构域,并且极大可能定位于细胞膜上,具有典型的GPCR结构特征。
磷酸化和去磷酸化是细胞内信号传导的重要方式[22]。GPCRs被外部信号刺激后与相应配体结合,在激发G蛋白下游信号转导通路的同时,GPCRs本身在cAMP依赖的蛋白激酶PKA或蛋白激酶C(PKC)等可作用于受体Ser/Thr位点的蛋白激酶的作用下发生快速磷酸化,从而促使受体与G蛋白解偶联[23]。磷酸化位点分析发现,引起小麦赤霉病的禾谷镰刀菌5个cAMP受体类型的GPCR蛋白都具有Ser、Thr和Tyr这3种磷酸化位点,而Ser和Thr位点比Tyr位点数目多,因此推测Ser/Thr蛋白激酶和Tyr蛋白激酶均有可能参与5个蛋白的磷酸化,而其中Ser/Thr蛋白激酶参与磷酸化的可能性较Tyr蛋白激酶高。
同源序列的进化关系表明,禾谷镰刀菌的5个cAR蛋白分布在不同类群中,可以与镰刀菌属的其他种cAR蛋白聚为一类。禾谷镰刀菌cAR蛋白与假禾谷镰刀菌及F. langsethiae亲缘关系最近,但在基于交配型位点及7个核基因序列比对研究表明,假禾谷镰刀菌与禾谷镰刀菌间的亲缘较远[24],而F. langsethiae是欧洲2004年报道的一个镰刀菌新种,具有梨孢镰刀菌(F. poae)形态和拟枝孢镰刀菌(F. sporotrichioides)产毒特性[25],这两个菌种与禾谷镰刀菌一样同样产生单端孢霉烯类毒素。本研究中,不同物种来源的cAMP受体类GPCR基因间未分化出种属特异性,推测这些真菌的cAR蛋白之间的分化,可能早于它们种类的分化。
4 结论禾谷镰刀菌全基因组序列中存在5个典型的cAMP受体类型,每个受体均含有7个跨膜结构域定位于细胞膜上。除FgcAR1外,其余为疏水性蛋白。蛋白质二级结构分析表明,均含有大量α螺旋比例在60%左右,FgcAR4和FgcAR5没有β转角。这些GPCRs中含有较多的ser和Thr磷酸化位点。禾谷镰刀菌cAMP受体类型的GPCR蛋白与假禾谷镰刀菌及F.langsethiae同源性最高,亲缘关系最近。
| [1] |
BAI Guihua, SHANER G. Management and resistance in wheat and barley to Fusarium head blight[J]. Annual Review of Phytopathology, 2004, 42: 135–161.
DOI:10.1146/annurev.phyto.42.040803.140340( 0) 0)
|
| [2] |
马鸿翔, 陆维忠. 小麦赤霉病抗性改良研究进展[J]. 江苏农业学报, 2010, 26(1): 197–203.
MA Hongxiang, LU Weizhong. Progress on genetic improvement for resistance to Fusarium head blight in wheat[J]. Jiangsu Journal of Agricultural Sciences, 2010, 26(1): 197–203. DOI:10.3969/j.issn.1000-4440.2010.01.037(  0) 0)
|
| [3] |
程顺和, 张勇, 别同德, 等. 中国小麦赤霉病的危害及抗性遗传改良[J]. 江苏农业学报, 2012, 28(5): 938–942.
CHENG Shunhe, ZHANG Yong, BIE Tongde, et al. Damage of wheat Fusarium head blight epidemics and genetic improvement of wheat for scab resistance in China[J]. Jiangsu Journal of Agricultural Sciences, 2012, 28(5): 938–942. (  0) 0)
|
| [4] |
GLENN A E. Mycotyoxigenic Fusarium species in animal feed[J]. Animal Feed and Science and Technology, 2007, 137(3): 213–240.
DOI:10.1016/j.anifeedsci.2007.06.003( 0) 0)
|
| [5] |
PINTON P, BRAICU C, NOUGAYREDE J P, et al. Deoxynivalenol impairs porcine intestinal barrier function and decreases the protein expression of claudin-4 through a mitogen activated protein kinase dependent mechanism[J]. The Journal of Nutrition, 2010, 140(11): 1956–1962.
DOI:10.3915/jn.110.123919( 0) 0)
|
| [6] |
DUAN Jielin, YIN Jie, WU Miaomiao, et al. Dietary glutamate supplementation ameliorates mycotoxin induced abnormalities in the intestinal structure and expression of amino acid transporters in young pigs[J]. PLoS One, 2014, 9(11): e112357.
DOI:10.1037/journal.pone.0112357( 0) 0)
|
| [7] |
尹杰, 伍力, 彭智兴, 等. 脱氧雪腐镰刀菌烯醇的毒性作用及其机理[J]. 动物营养学报, 2012, 24(1): 48–54.
YIN Jie, WU Li, PENG Zhixing, et al. Deoxynicalenal: to-xicity and mechanisms of action[J]. Chinese Journal of Animal Nutrition, 2012, 24(1): 48–54. DOI:10.3969/j.issn.1006-267x.2012.01.008(  0) 0)
|
| [8] |
ALEXANDER N J, MCCORMICK S P, WAALWIJK C, et al. The genetic basis for 3-ADON and 15-ADON trichothecene chemotypes in Fusarium[J]. Fungal Genetics Biology, 2011, 48(5): 485–495.
DOI:10.1016/j.fgb.2011.01.003( 0) 0)
|
| [9] |
JO H, KONG C, SONG M, et al. Effects of dietary deoxynivalenol and zearalenone on apparent ileal digestibility of amino acids in growing pigs[J]. Animal Feed Science and Technology, 2016, 219: 77–82.
DOI:10.1016/j.anifeedsci.2016.06.006( 0) 0)
|
| [10] |
甄阳光, 柏凡, 张克英, 等. 我国主要饲料原料及产品中呕吐毒素污染分布规律研究[J]. 中国畜牧杂志, 2009, 45(8): 21–24.
ZHEN Yangguang, BO Fan, ZHANG Keying, et al. Stu-dies on the pollution distribution of vomiting toxin in main feed ingredients and products in China[J]. Chinese Journal of Animal Science, 2009, 45(8): 21–24. (  0) 0)
|
| [11] |
韩长志. 植物病原丝状真菌G蛋白偶联受体的研究进展[J]. 微生物学通报, 2015, 42(2): 374–383.
Han Changzhi. Advance in functional research of G protein-coupled receptors in phytopathogenic filamentous fungi[J]. Microbiology China, 2015, 42(2): 374–383. DOI:10.13344/j.microbiol.china.140473(  0) 0)
|
| [12] |
赵勇, 王云川, 蒋德伟, 等. 真菌G蛋白信号调控蛋白的功能研究进展[J]. 微生物学通报, 2014, 41(4): 712–718.
ZHAO Yong, WANG Yunchuan, JIANG Dewei, et al. Advances in functional research of RGS proteins in fungi[J]. Microbiology China, 2014, 41(4): 712–718. DOI:10.13344/j.microbiol.china.130317(  0) 0)
|
| [13] |
许伟明, 王晓峰, 林娟, 等. G蛋白偶联受体计算研究的进展和前瞻[J]. 生物信息学, 2016, 14(1): 31–38.
XU Weiming, WANG Xiaofeng, LIN Juan, et al. Progresses and prospects of computational study on G protein-coupled receptors[J]. Chinese Journal of Bioinformatics, 2016, 14(1): 31–38. DOI:10.3969/j.issn.1672-5565.2016.01.06(  0) 0)
|
| [14] |
LIU Xiaoping, TANG Weihua, ZHAO Xingming, et al. A network approach to predict pathogenic genes for Fusarium graminearum[J]. PLoS one, 2010, 5(10): e13021.
DOI:10.1371/journal.pone.0013021( 0) 0)
|
| [15] |
YU H Y, SEO J A, KIM J E, et al. Functional analyses of heterotrimeric G protein Gα and Gβ subunits in Gibberella zeae[J]. Microbiology, 2008, 154(2): 392–401.
DOI:10.1099/mic.0.2007/012260-0( 0) 0)
|
| [16] |
STUDT L, HUMPF H U, TUDZYNSKI B. Signaling governed by g proteins and camp is crucial for growth, secondary metabolism and sexual development in Fusarium fujikuroi[J]. Plos One, 2013, 8(2): e58185.
DOI:10.1371/journal.pone.0058185( 0) 0)
|
| [17] |
GUO Lijia, YANG Yuhua, YANG Laying, et al. Functional analysis of the G-protein α subunits FGA1 and FGA3 in the banana pathogen Fusarium oxysporum f. sp. Cubense[J]. Physiological and Molecular Plant Pathology, 2016, 94: 75–82.
DOI:10.1016/j.pmpp.2016.04.003( 0) 0)
|
| [18] |
PARK A R, CHO A R, SEO J A, et al. Functional analyses of regulators of G protein signaling in Gibberella zeae[J]. Fungal Genetic and Biology, 2012, 49(7): 511–520.
DOI:10.1016/j.fgb.2012.05.006( 0) 0)
|
| [19] |
GU Qin, CHEN Yun, LIU Ye, et al. The transmembrane protein FgSho1 regulates fungal development and pathogenicity via the MAPK module Ste50-Ste11-Ste7 in Fusarium graminearum[J]. New Phytology, 2015, 206: 315–328.
DOI:10.1111/nph.13158( 0) 0)
|
| [20] |
HOU Rui, JIANG Cong, ZHENG Qian, et al. The AreA transcription factor mediates the regulation of deoxynivalenol (DON) synthesis by ammonium and cyclic adenosine monophosphate (cAMP) signalling in Fusarium graminearum[J]. Molecular Plant Pathology, 2015, 16(9): 987–999.
DOI:10.1111/mpp.12254( 0) 0)
|
| [21] |
WU Jinjin, LIU Yuting, LV Wuyun, et al. FgRIC8 is involved in regulating vegetative growth, conidiation, deoxynivalenol production and virulence in Fusarium graminearum[J]. Fungal Genetics and Biology, 2015, 83: 92–102.
DOI:10.1016/j.fgb.2015.08.012( 0) 0)
|
| [22] |
KOBIR A, SHI Lei, BOSKOVIC A, et al. Protein phosphorylatoin in bacterial signal transduction[J]. Biochimica et Biophysica Acta-General Subjects, 2011, 1810(10): 989–994.
DOI:10.1016/j.bbagen.2011.01.006( 0) 0)
|
| [23] |
HAUSDORFF W P, CARON M G, LEFKNOWITZ R J. Turning off the signal: desensitization of bata-adrenergic receptor function[J]. The FASEB Journal, 1990, 4(11): 2881–2889.
( 0) 0)
|
| [24] |
O'DONNELL K, WARD T J, GEISER D M, et al. Genealogical concordance between the mating type locus and seven other nuclear genes supports formal recognition of nine phylogenetically distinct species within the Fusarium grminearum clade[J]. Fungal Genetics and Biology, 2014, 41(6): 600–623.
DOI:10.1016/j.fgb.2004.03.003( 0) 0)
|
| [25] |
TORP M, NIREWBERG H I. Fusarium langaethiae sp. nov. on cereals in Europe[J]. International Journal of Food Micrology, 2004, 95(3): 247–256.
DOI:10.1016/j.ijfoodmicro.2003.12.014( 0) 0)
|
 2017, Vol. 15
2017, Vol. 15


