2. 西北民族大学榆中校区生命科学与工程学院,兰州 730124;
3. 甘肃省计算中心,兰州 730000
2. Department of Life Sciences and Biological Engineering, Northwest University for Nationalities, Lanzhou 730124, China;
3. Gansu Province Computing Center, Lanzhou 730000, China
血清白蛋白 (Serum albumin,SA) 是一种球状蛋白质,是机体循环系统中含量最丰富的储存与运输蛋白, 有许多重要的生理学与药理学功能,能与许多内源和外源性物质如脂肪酸、氨基酸、荷尔蒙,阴阳离子和药物等结合[1]。血清白蛋白对药物的药代动力学特别是其在人体中的分布有着重要的作用,大部分药物成分在生物体中的运转首先通过与血清白蛋白的结合,然后到达靶标组织起到存储和转运作用。因此血清白蛋白已成为研究最广泛的目标蛋白之一。血清白蛋白来源广泛,其中由于人血清白蛋白 (HSA) 与牛血清白蛋白 (BSA) 分子被相关研究人员广泛采用为模型生物大分子。
HSA的三维晶体结构显示,人血清蛋白球状高级结构可分为三个结构域,从N端开始依次为区域Ⅰ (残基1-195),区域Ⅱ (残基196-383) 和区域Ⅲ (残基394-585),它们均是由α-螺旋体反向平行而成,每个结构域有槽口相对的两个疏水性空腔。亚域 (Sub domain A和Sub domain B) 形成圆筒状结构,几乎所有的疏水性氨基酸都包埋在此圆筒腔内部,构成疏水性腔。大多数药物在血清白蛋白上的结合部位为亚结构域ⅡA和ⅢA,其中IIIA的活性最高[2]。除此之外,HSA分子内还有诸如β-折叠、回转以及无规卷曲等二级结构类型。晶体衍射实验表明血清白蛋白呈心脏形构象[3]。然而,到目前为止,其他物种特别是一些与人类亲缘关系较近的哺乳动物上的血清白蛋白的结构、性质等的了解都还比较少。
随着人们对人工合成药物的毒副作用认识水平越来越深入,人们更倾向于使用天然药物。近年来关于天然植物的药用成分[4-6],特别是传统中药的有效成分与SA的相互作用已经初步引起了国内外学术界的普遍关注[7-12]。而基于中药小分子与生物大分子的相互作用也是中药现代化研究中药药理机制的主要内容之一。莪术醇 (Curcumol) 又名姜黄环奥醇,为具有半缩酮的氢化奥类化合物,由五元环和六元环并合而成 (见图 1)。其中的七元环通过半缩酮的氧桥,又形成了一个五元环和六元环,使得三个环的张力变小,形成了具有刚性结构的较稳定的化合物。莪术醇主要有抗肿瘤、抗菌、抗病毒、抗炎,抗血栓等药理作用,是新的抗肿瘤中药单体之一。与许多传统药物相比,它还具有无致突变性、低毒、安全可靠,对多种疾病有效的优点。莪术醇能明显抑制CASKI细胞的体外增殖,且可阻滞CASKI细胞周期于G2M期并诱导细胞凋亡[13],同时对胃癌[14]、卵巢癌[15]、肺癌[16]、肝癌[17]等细胞的增殖有明显的抑制作用。近年来,药物与血清白蛋白的相互作用的研究越来越多。但是到目前为止,天然产物和人工合成类药物与血清白蛋白的相互作用大部分都基于人和牛[18-24]的,由于各种限制条件,例如晶体结构还未获得、物种资源稀缺等,所以在其他物种上研究较少。通过用生物信息学的方法分析不同物种的血清白蛋白的特点和进化关系,分析莪术醇与人血清白蛋白相互作用位点及其在其他亲缘关系较近的物种中相应的氨基酸变化特点,通过分析血清白蛋白的疏水性及其与莪术醇结合位点处的氨基酸特征,进一步了解其他物种的血清白蛋白的结构特点,以及为分析莪术醇在其他物种中的相互作用等提供理论依据。
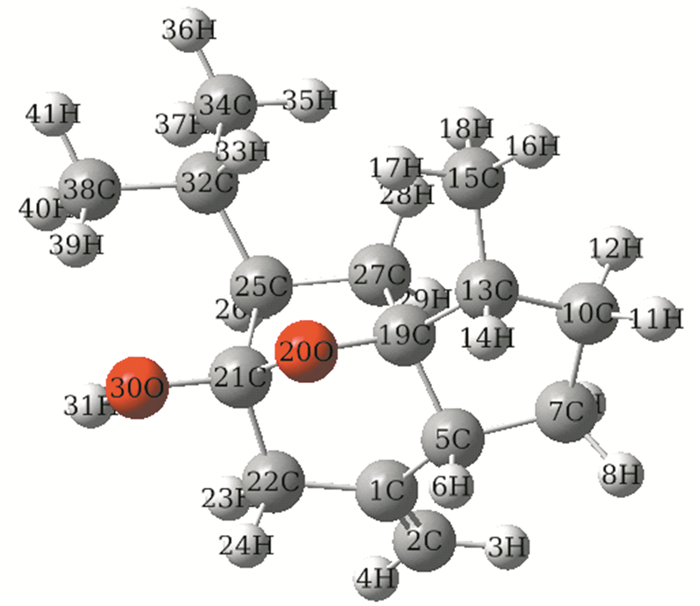
|
图 1 莪术醇的化学结构 Figure 1 Chemical structure of curcumol |
蛋白质的氨基酸序列从NCBI网站 (http://www.ncbi.nlm.nih.gov/pubmed) 上下载,人血清白蛋白与莪术醇的复合物的晶体结构是从PDB数据库 (http://www.rcsb.org/pdb/home/home.do) 中下载 (PDB:1BM0)。
1.2 蛋白质序列分析通过ClustalX软件[25]进行了多序列比对的分析;利用Lasergene软件[26]来执行蛋白质的氨基酸序列长度和组成以及等电点的分析;利用MegAlign软件中Lipman-Pearson方法[27]进行了序列的相似性分析;采用DNAMAN (version 4.0, Lynnon Biosoft, Quebec, Canada) 和ExPAsy的ProtScale程序分析蛋白质的疏水性 (http://web.expasy.org/protscale/)[28]。基于Jones-Taylor-Thornton (JTT) 模型,采取缺失序列删除的方式,用MEGA的Neighbor-Joining (NJ) 方法构建进化树[29],Bootstrap Replications设置为1 000。
1.3 小分子的准备在Pubchem上下载小分子米格列醇的结构,然后通过软件Chem3D的MM2法做构型优化[30],精确度为0.001。通过Gaussian软件的密度泛函理论B3LYP的方法和6-31G (D) 的基组做进一步的几何优化。通过AutoDock4.2来进行分子的半柔性对接,采用Lamarckian遗传算法 (LGA),能量评估次数使用最大次数25 000 000,突变率设置为0.02,交叉率为0.80,最大迭代次数是300。以药物小分子为中心的格子尺寸定义为6 nm× 6 nm× 6 nm,间隔为0.037 5 nm,最终得到的50个对接的构象中能量最小的作为稳定构象作进一步的分析。
2 结果与分析 2.1 蛋白质序列基本情况分析不同物种的血清白蛋白序列名称及其不同类型氨基酸组成等性质如表 1所示。其中大部分物种的血清白蛋白的氨基酸序列长度比较接近,其中疏水性的氨基酸和极性的氨基酸占有较大的比例。蛋白质等电点是指由于蛋白质表面离子化侧链的存在,使其带有净电荷。由于这些侧链都是可以滴定的,对于每个蛋白都存在一个pH使它的表面净电荷为零,即等电点。蛋白质在等电点时,其溶解度最小,最易形成沉淀物,表 1中的不同物种血清白蛋白的等电点都在5~9之间,但是不同的蛋白质其等电点的值也不相同,说明了不同的性质,如黏度、膨胀性、渗透压等[31-32]。
| 表 1 血清白蛋白的序列名称及氨基酸组成 Table 1 Name and composition of serum albumin amino acid sequences from different sources |
莪术醇与人血清白蛋白相互作用研究表明,莪术醇与人血清白蛋白相互作用的结合位点Ⅱ深深位于蛋白质结构中的一个疏水性口袋中,其最低结合能是-7.22 Kcal/mol,周围的氨基酸残基有:Leu-219, Phe223, Arg-222, Leu234, Leu238, Val-241, His-242, Arg-257, Leu-260, Ala-261, Ile264, Ser-287, Ala-291, 如图 2(a)所示。
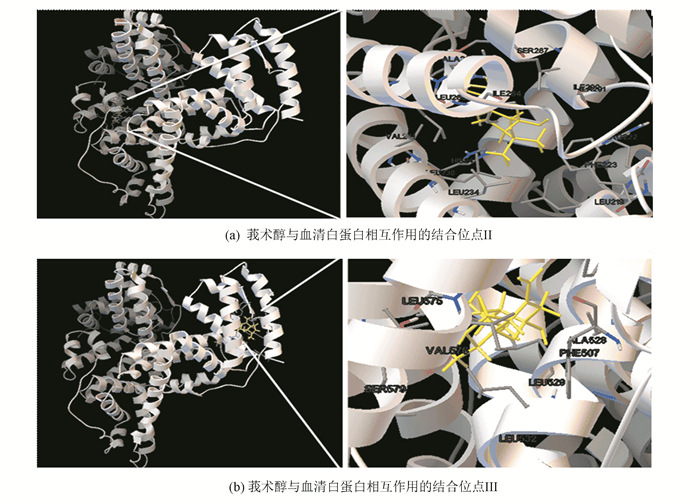
|
图 2 莪术醇与人血清白蛋白相互作用位点 Figure 2 Active sites between the curcumol and homo sapiens serum albumin |
为了分析莪术醇与血清白蛋白相互作用的周围氨基酸是否在其他物种中是保守的,本文选取了与人 (Homo sapiens) 亲缘关系较近的狼 (Canis lupus)、牦牛 (Bos mutus)、家牛 (Bos taurus) 和绵羊 (Ovine)的血清白蛋白序列进行了多序列比对。其中人与亲缘关系较近的家牛、狼、绵羊和牦牛的序列相似性分别是79.3%、76.2%、74.7%和76.0%,系统发育关系 (见图 3) 表明,家牛、狼、绵羊和牦牛与人类的亲缘关系较近,序列的相似性均在74%以上。
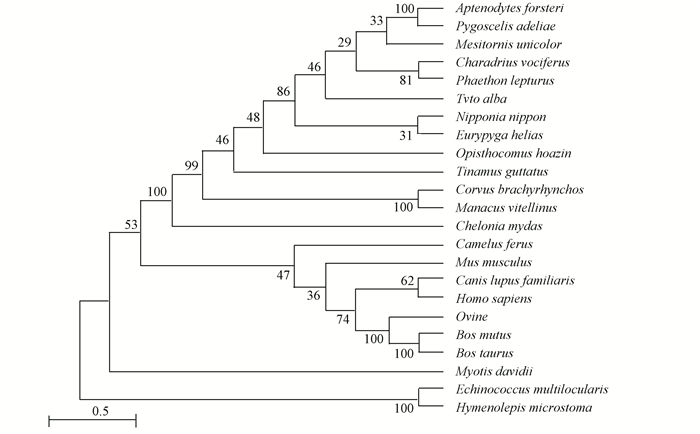
|
图 3 血清白蛋白序列的系统发育树 Figure 3 Phylogenetic tree of serum albumin sequences |
从多序列比对图 4中可以看到,其中红色框中的氨基酸代表莪术醇与人血清白蛋白相互结合点处的氨基酸,黄色背景的氨基酸表示其他物种中与人不同的氨基酸位点。结果表明人血清白蛋白与莪术醇相互作用关键位点Ⅱ(见图 4(a)) 在其他亲缘关系较近的物种中来说比较保守,只有3处位置是不同的。例如在人血清白蛋白的Arg222处是亲水性氨基酸,而在牦牛、家牛和绵羊中对应是赖氨酸,不过也是亲水性氨基酸。Ile264处的疏水性氨基酸对应在狼血清白蛋白上的是疏水性蛋氨酸,其他物种上仍然是与人血清白蛋白是相同的。

|
图 4 莪术醇与人血清白蛋白结合位点的同源序列比对 Figure 4 Mutiple-alignment of homo sapiens serum albumin sequences at the active sites *注:彩图见电子版 (http://swxxx.alljournals.cn/ch/index.aspx)(2007年第1期DOI:10.3969/j.issn.1672-5565.2017.01.201608002) |
莪术醇与人血清白蛋白结合的位点Ⅲ处包含有12个氨基酸残基,它们是Phe507, Phe509, Ala528, Leu529, Leu532, Val547, Phe551, Phe554, Leu575, Val576, Ser579,它们之间的最低结合能是-8.34 Kcal/mol。分析莪术醇与人血清白蛋白结合位点周围的氨基酸残基的同源序列发现,这些结合位点处的氨基酸大部分都是保守的,只有1个是不同的 (见图 4(b))。其中人血清白蛋白上的亲水性氨基酸Ser579所对应的牦牛和家牛的是亲水性的Thr 577,狼对应的是疏水性的Ala578,绵羊的是亲水性的Thr556,由上可知,莪术醇与其他四个物种的相互作用与人血清白蛋白的非常相似。
2.3 作用前后的分子构象从莪术醇分子与人血清白蛋白作用前后的构象来看 (见图 5),分子的结构并没有发生明显的变化。从结构参数 (见表 2) 来看,变化较为明显的是羟基。其中在结合位点Ⅱ处二面角C22-C21-O30-H31是139.8°,而在结合位点Ⅲ处却是102.9°。当莪术醇分子位于结合位点Ⅱ时,羟基位于一个由Ile290,Ala291,Arg222和Phe223构成的一个疏水空腔中,羟基氢原子与对接前相比发生了较为明显的旋转。当此分子位于对接位点Ⅲ时,羟基周围的氨基酸是疏水性的Phe507,Phe509,Ala528,Leu529和Leu532。羟基氢原子与对接前相比较也发生了与结合位点Ⅱ相同方向的旋转。正是由于该化合物具有五元环、六元环和七元环的刚性结构,使得它具有较为稳定的结构[33]。
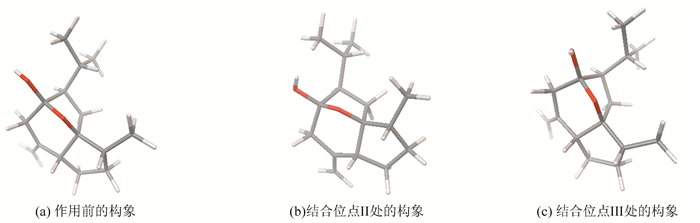
|
图 5 与人血清白蛋白作用前后莪术醇的分子构象 Figure 5 The molecular conformations of thecurcumol before (a) and after interacting with the homo sapiens serum albumin |
| 表 2 莪术醇与人血清白蛋白作用前后的分子结构主要参数 Table 2 The main structural parameters of the optimal curcumol and the ones in active sites of the homo sapiens serum albumin. |
疏水作用及疏水和亲水的平衡在蛋白质结构与功能的各个方面都起着重要的作用。疏水性是20种氨基酸均固有的特性,是决定蛋白质最终三维空间构象的重要因素之一。用ExPASy的Protscale程序计算Homo sapiens、Canis lupus、Ovine、Bos Taurus和Bos mutus的血清白蛋白的疏水性图谱 (见图 6)。纵坐标0值以上为疏水区,0值以下为亲水区。纵坐标代表疏水性的分值,分值越高,疏水性越强,横坐标代表氨基酸的位置。从图中可以看出,肽链的疏水性氨基酸分布在这五个物种中都比较相似,疏水性的氨基酸少于亲水性的氨基酸,可以认为该蛋白质为亲水性的蛋白。另外,用ExPASy提供的在线跨膜区预测的TMHMM和TMPRED软件[35]对这五个物种的血清白蛋白的序列跨膜区分析发现,它们都没有跨膜螺旋,位于膜外,处于膜内的、跨膜的概率均为0。由此可以说明,血清白蛋白作为血液系统的重要组分,是亲水性的蛋白,这在Canis lupus、Ovine、Bos Taurus和Bos mutus物种中类似的。它具有结合和运输内源性及外源性物质的特性,例如可逆性的结合药物小分子,并将其运输到靶点部位达到治疗疾病的目的等[34]。其中莪术醇与人血清白蛋白的结合位点处的氨基酸中亲水性的氨基酸较多,疏水性的氨基酸少。在其他四个亲缘关系较近的物种中的同源序列中也具有同样的现象。
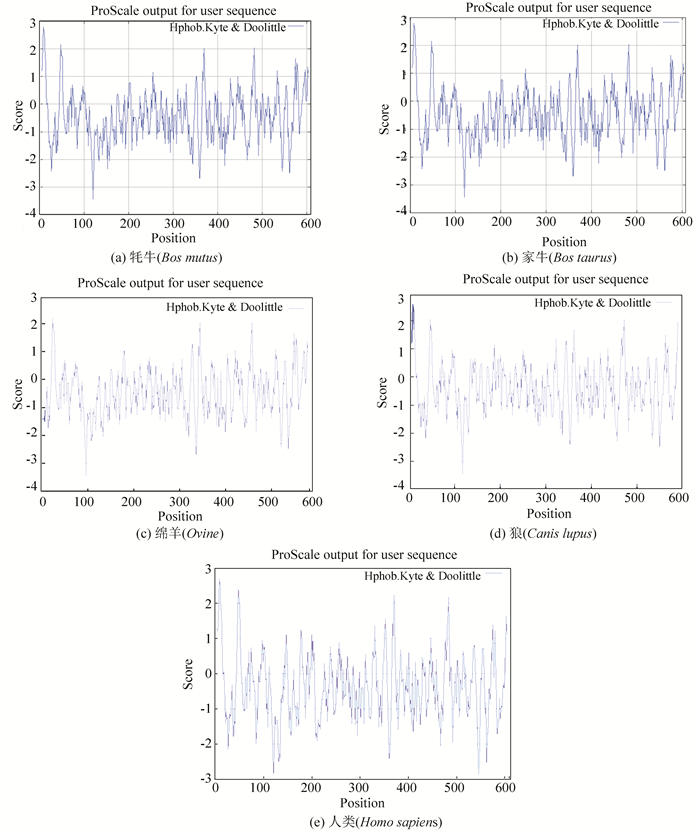
|
图 6 血清白蛋白序列的疏水性分析 Figure 6 The hydrophobieity profile of serum albumin sequences |
莪术醇作为抗肿瘤、抗菌、抗病毒、抗炎、抗血栓等的药物,与许多传统药物相比,具有无致突变性、低毒、安全可靠、对多种疾病有效的优点。本文详细分析了莪术醇与人血清白蛋白之间的相互作用特点。然而由于各种限制条件,所以在其他物种上研究的还比较少。本文通过系统发育关系分析表明,家牛、狼、绵羊和牦牛与人类的血清白蛋白亲缘关系较近,序列的相似性均在74%以上。通过多序列比对分析表明人血清白蛋白与莪术醇相互作用关键位点Ⅱ和Ⅲ在其他亲缘关系较近的物种中来说都非常保守。可以推测莪术醇与其他物种的血清白蛋白相互作用模式与人类的非常相似。从莪术醇分子与人血清白蛋白作用前后的构象来看,分子的结构并没有发生明显的变化。虽然与对接前的结构相比,羟基的位置发生了明显的变化,但是在两个结合位点处的构象还是非常相似的。正是由于该化合物具有五元环、六元环和七元环的刚性结构,使得它具有较为稳定的结构[35-36]。
人血清白蛋白作为血液系统的重要组分,是亲水性的蛋白,这在狼、绵羊、家牛和牦牛中是类似的,在药物的储存、运输等方面起着重要的作用。亲水性的蛋白对水有大的亲和能力,可以吸引水分子,或溶解于水。莪术醇虽然具有非常好的生物活性,但是它却几乎不溶于水,在水中溶解度仅为0.3%。莪术醇与人及亲缘关系较近的物种中的血清白蛋白结合的位点周围几乎都是疏水性的氨基酸,分子间的疏水作用起着很重要的作用。这就要求有一种既能够与血清白蛋白结合的亲水性的物质,同时也能够与莪术醇结合的疏水性的物质作为载体,以此来提高药物的利用率,如脂质体[37-38]。
4 结论通过分析莪术醇与人血清白蛋白相互作用发现其结合位点Ⅱ和Ⅲ处周围几乎都是疏水性的氨基酸,分子间的疏水作用起着很重要的作用。莪术醇与人血清白蛋白之间的作用位点在其他亲缘关系较近的物种中都较为保守,少数有变化的氨基酸基本是在极性相同的氨基酸之间发生的。与分子相互作用前的结构相比,只有莪术醇中羟基的结构在活性位点处发生了明显的变化,其他的五元环、六元环和七元环都具有较为稳定的刚性结构。
| [1] |
谢郢, 李永成, 杨立云, 等. 替加氟与牛血清白蛋白相互作用的研究[J]. 化学与生物工程, 2010, 9(27): 48–52.
XIE Ying, LI Yongcheng, YANG Liyun, et al. Investigation on interaction of tegafur with bovine serum albumin[J]. Chemistry and Bioengineering, 2010, 9(27): 48–52.
DOI:10.3969/j.issn.1672-5425.2010.09.015 ( 0) 0)
|
| [2] |
俞天智, 杨汝栋. 芦丁与血清白蛋白的作用研究[J]. 光谱学与光谱分析, 2003, 23(4): 763–765.
YU Tianzhi, YANG Rudong. Study on the interaction of rutin and serum albumin[J]. Spectroscopy and Spectral Analysis, 2003, 23(4): 763–765.
DOI:10.3321/j.issn:1000-0593.2003.04.037 ( 0) 0)
|
| [3] |
LIEN C H, KUO W S, CHO K C, et al. Fabrication of gold nanorods-doped, bovine serum albumin microstructures via multiphoton excited photochemistry[J]. Optics Express, 2011, 19(7): 6260–6268.
DOI:10.1364/OE.19.006260 ( 0) 0)
|
| [4] |
SHI J H, PAN D Q, JIANG M, et al. Binding interaction of ramipril with bovine serum albumin (BSA): Insights from multi-spectroscopy and molecular docking methods[J]. Journal of Photochemistry and Photobiology. B, Biology, 2016(164): 103–111.
DOI:10.1016/j.jphotobiol.2016.09.025 ( 0) 0)
|
| [5] |
MISKOVSKY P, HRITZ J, SANCHEZ-CORTES S, et al. Interaction of hypericin with serum albumins: surface-enhanced rainan spectroscopy, resonance raman spectroscopy and molecular modeling study[J]. Photochemistry and Photobiology, 2001, 74(2): 172–183.
DOI:10.1562/0031-8655(2001)0740172IOHWSA2.0.CO2 ( 0) 0)
|
| [6] |
HETTICK J M, SIEGEL P D. Determination of the toluene diisocyanate binding sites on human serum albumin by tandem mass spectrometry[J]. Analytical Biochemistry, 2011, 414(2): 232–238.
DOI:10.1016/j.ab.2011.03.035 ( 0) 0)
|
| [7] |
TIAN J, LIU J, TIAN X, et al. Study of the interaction of kaempferoi with bovine serum albumin[J]. Journal of Molecular Structure, 2004, 691(1): 197–202.
DOI:10.1016/S0308-8146(02)00155-3 ( 0) 0)
|
| [8] |
LIU J, TIAN J, HE W, et al. Spectrofluorimetric study of the binding of daphnetin to bovine serum albumin[J]. Journal of Pharmaceutical and Biomedical Analysis, 2004, 35(3): 671–677.
DOI:10.1016/j.jpba.2004.02.010 ( 0) 0)
|
| [9] |
颜承农, 上官云凤, 刘义, 等. 荧光光谱法研究盐酸罂粟碱与牛血清白蛋白作用的热力学特征[J]. 理化检验:化学分册, 2004, 40(3): 132–134.
YAN Chengnong, SHANGGUAN Yunfeng, LIU Yi, et al. Thermodynamic study of characteristics of the binding reaction of papaverine with bovine serum albumin (BSA)[J]. Physical Testing and Chemical Analysis Part B Chemical Analysis, 2004, 40(3): 132–134.
( 0) 0)
|
| [10] |
连春霞, 甘婷婷, 陈华, 等. 鱼腥草素钠与血清白蛋白结合常数的电泳法测定[J]. 重庆大学学报:自然科学版, 2004, 27(2): 59–62.
LIAN Chunxia, GAN Tingting, CHEN Hua, et al. Determination of the binding constant between sodium houttuyfonate and human serum albumin by capillary electrophoresis[J]. Journal of Chongqing University (Natural Science Edition), 2004, 27(2): 59–62.
( 0) 0)
|
| [11] |
赵长春, 郑维发, 李梦秋. 小檗碱与人血清白蛋白的相互作用[J]. 光谱学与光谱分析, 2004, 24(1): 111–113.
ZHAO Changchun, ZHENG Weifa, LI Mengqiu. The interaction of berberine and human serum albumin[J]. Spectroscopy and Spectral Analysis, 2004, 24(1): 111–113.
( 0) 0)
|
| [12] |
刘嫒, 谢孟峡, 康娟. 三七总皂甙对牛血清白蛋白溶液构象的影响[J]. 化学学报, 2003, 61(8): 1305–1310.
LIU Yuan, XIE Mengxia, KANG Juan. Influence of total saponins of panax notoginseng on the conformation of BSA[J]. Acta Chimica Sinica, 2003, 61(8): 1305–1310.
DOI:10.3321/j.issn:0567-7351 ( 0) 0)
|
| [13] |
高艳娥, 郭金珠, 惠慧, 等. 莪术醇对人宫颈癌CASKI细胞增殖抑制及促凋亡作用的研究[J]. 现代肿瘤医学, 2009, 17(10): 1836–1839.
GAO Yane, GUO Jinzhu, HUI Hui, et al. Effects of curcumol on proliferation and apoptosis in human cervical cancer CASKI cell line[J]. Journal of Modern Oncology, 2009, 17(10): 1836–1839.
DOI:10.3969/j.issn.1672-4992.2009.10.004 ( 0) 0)
|
| [14] |
徐立春, 刘丽娟, 王耀霞, 等. 莪术醇诱导人胃癌BGC-823细胞凋亡与细胞内活性氧增加的实验研究[J]. 现代肿瘤医学, 2010, 18(10): 1892–1895.
XU Lichun, LIU Lijuan, WANG Yaoxia, et al. Relationship between reactive oxygen species and apoptosis in human gastic cancer BGC-823 cells induced by curcumol[J]. Journal of Modern Oncology, 2010, 18(10): 1892–1895.
DOI:10.3969/j.issn.1672-4992.2010.10.04 ( 0) 0)
|
| [15] |
汤欣, 韩凤娟, 李威, 等. 莪术醇对人卵巢癌SKOV3细胞株JAK2/STAT3信号通路影响的研究[J]. 中国妇产科临床杂志, 2013, 14(1): 43–46.
TANG Xin, HAN Fengjuan, LI Wei, et al. Research on the effect of curcumol in JAK2/STAT3 signaling pathway in human ovarian cancer cell line SKOV3[J]. Chinese Journal of Clinical Obstetrics and Gynecology, 2013, 14(1): 43–46.
DOI:10.3969/j.issn.1672-1861.2013.014 ( 0) 0)
|
| [16] |
ZHANG W, WANG Z, CHEN T. Curcumol induces apoptosis via caspases-independent mitochondrial pathway in human lung adenocarcinoma ASTC-a-1 cells[J]. Medical Oncology, 2011, 28(1): 307–314.
DOI:10.1007/s12032-101-9431-5 ( 0) 0)
|
| [17] |
黄岚珍, 王娟, 卢菲婷, 等. 莪术醇抑制人肝癌细胞HepG2增殖的机制[J]. 中国中药杂志, 2013, 8(11): 1812–1815.
HUANG L Z, WANG J, LU F T, et al. Mechanism study on anti-proliferative effects of curcumol in human hepatocarcinoma HepG2 cells[J]. China Journal of Chinese Materia Medica, 2013, 8(11): 1812–1815.
DOI:10.4268/cjcmm20131132 ( 0) 0)
|
| [18] |
尚永辉, 孙家娟, 刘静, 等. 荧光光谱法研究黄芩苷与牛血清白蛋白的相互作用[J]. 光谱实验室, 2011, 28(5): 2367–2369.
SHANG Yonghui, SUN Jiajuan, LIU Jing, et al. Interaction between baicalin and bovine serum albumin by fluorescence spectrometry[J]. Chinese Journal of Spectroscopy Laboratory, 2011, 28(5): 2367–2369.
DOI:10.3969/j.issn.1004-8138.2011.05.051 ( 0) 0)
|
| [19] |
吴秋华, 周欣, 臧晓欢, 等. 白藜芦醇与人血清白蛋白相互作用的光谱研究[J]. 光谱学与光谱分析, 2009, 29(1): 226–230.
WU Qiuhua, ZHOU Xin, ZANG Xiaohuan, et al. Spectroscopic Study on the Interaction between Resveratrol and Human Serum Albumin[J]. Spectroscopy and Spectral Analysis, 2009, 29(1): 226–230.
DOI:10.3964/j.issn.1000-0593(2009)01-0226-05 ( 0) 0)
|
| [20] |
MA X, YAN J, WANG Q, et al. Spectroscopy study and co-administration effect on the interaction of mycophenolic acid and human serum albumin[J]. International Journal of Biological Macromolecules, 2015(77): 280–286.
DOI:10.1016/j.ijbiomac.2015.03.052 ( 0) 0)
|
| [21] |
CHEN X, QIAN K, CHEN Q. Comparison between loureirin A and cochinchinenin C on the interaction with human serum albumin[J]. European Journal of Medicinal Chemistry, 2015(93): 492–500.
DOI:10.1016/j.ejmech.2015.02.025 ( 0) 0)
|
| [22] |
REHMAN M T, SHAMSI H, KHAN A U. Insight into the binding mechanism of imipenem to human serum albumin by spectroscopic and computational approaches[J]. Molecular Pharmaceutics, 2014, 11(6): 1785–1797.
DOI:10.1021/mp500116c ( 0) 0)
|
| [23] |
KAMTEKAR N, PANDEY A, AGRAWAL N, et al. Interaction of multimicrobial synthetic inhibitor 1, 2-Bis (2-Benzimidazolyl)-1, 2-Ethanediol with serum albumin :spectroscopic and computational studies[J]. PLoS One, 2013, 8(1): e53499.
DOI:10.1371/journal.pone.0053499 ( 0) 0)
|
| [24] |
王月荣, 刘馥婷, 章弘扬, 等. 丹酚酸B与牛血清白蛋白相互作用的电化学研究[J]. 分析测试学报, 2012, 31(3): 267–272.
WANG Yuerong, LIU Futing, ZHANG Hongyang, et al. Investigation on electrochemical behavior of interaction between salvianolic acid B and bovine serum albumin at DNA modified electrode[J]. Journal of Instrumental Analysis, 2012, 31(3): 267–272.
DOI:10.3969/j.issn.1004-4957.2012.03.005 ( 0) 0)
|
| [25] |
THOMPSON J D, GIBSON T J, HIGGINS D G. Multiple sequence alignment using ClustalW and ClustalX[J]. Current Protocols in Bioinformatics, 2002(Chapter 2): Unit 2–3.
DOI:10.1002/0471250953.bi0203s00 ( 0) 0)
|
| [26] |
BURLAND T G. Dnastar's Lasergene sequence analysis software[J]. Methods in Molecular Biology, 2000(132): 71–91.
DOI:10.1385/1-59259-192-2:71 ( 0) 0)
|
| [27] |
CLEWLEY J P, ARNOLD C. The multiple alignment module of LASERGENE[J]. Methods in Molecular Biology, 1997(70): 119–129.
DOI:10.1385/0-89603-358-9:119 ( 0) 0)
|
| [28] |
ARTIMO P, JONNALAGEDDA M, ARNOLD K, et al. ExPASy: SIB bioinformatics resource portal[J]. Nucleic Acids Research, 2012, 40(Web Server issue): W597–603.
DOI:10.1093/nar/gks400 ( 0) 0)
|
| [29] |
KUMAR S, NEI M, DUDLEY J, et al. MEGA: A biologist-centric software for evolutionary analysis of DNA and protein sequences[J]. Briefings in Bioinformatics, 2008, 9(4): 299–306.
DOI:10.1093/bib/bbn017 ( 0) 0)
|
| [30] |
BUNTROCK R E. ChemOffice Ultra 7.0[J]. Journal of Chemical Information and Computer Sciences, 2002, 42(6): 1505–1506.
DOI:10.1021/ci025575p ( 0) 0)
|
| [31] |
CHEN H, ZHU Z, YU H, et al. Simple means for fractionating protein based on isoelectric point without ampholyte[J]. Analytical Chemistry, 2016, 88(18): 9293–9299.
DOI:10.1021/acs.analchem.6b02856 ( 0) 0)
|
| [32] |
刘永创, 杨晓泉, 郭健, 等. 等电点附近大豆分离蛋白乳化稳定性的研究[J]. 现代食品科技, 2015(5): 84–89.
LIU Yongchuang, YANG Xiaoquan, GUO Jian, et al. Emulsifying properties of soy protein isolate at p H near the isoelectric point[J]. Modern Food Science and Technology, 2015(5): 84–89.
DOI:10.13982/j.mfst.1673-9078.2015.5.014 ( 0) 0)
|
| [33] |
HAMDI O A, FEROZ S R, SHILPI J A, et al. Spectrofluorometric and molecular docking studies on the binding of curcumenol and curcumenone to human serum albumin[J]. International Journal of Molecular Sciences, 2015, 16(3): 5180–5193.
DOI:10.3390/ijms16035180 ( 0) 0)
|
| [34] |
HOFMANN K, STOFFEL W. TMbase-A database of membrane spanning proteins segments[J]. Biological Chemistry Hoppe-Seyler, 1993, 374(1): 1–3.
( 0) 0)
|
| [35] |
郭明, 徐兴涛, 吴志武. 中药活性成分土大黄苷与人血清白蛋白的结合反应机制研究[J]. 药学学报, 2011(9): 1084–1092.
GUO Ming, XU Xingtao, WU Zhiwu, et al. Binding mechanism of rhaponticin and human serum albumin[J]. Acta Pharmaceutica Sinica, 2011(9): 1084–1092.
DOI:10.16438/j.0513-4870.2011.09.009 ( 0) 0)
|
| [36] |
WANG H, WANG Y, JIANG X, et al. The molecular mechanism of curcumol on inducing cell growth arrest and apoptosis in Jurkat cells, a model of CD4+ T cells[J]. Int Immunopharmacol, 2014, 21(2): 375–382.
DOI:10.1016/j.intimp.2014.05.021 ( 0) 0)
|
| [37] |
张晓丽, 吴品昌, 刘宇, 等. 乙醇注入法制备莪术醇脂质体[J]. 中国实验方剂学杂志, 2012(4): 10–18.
ZHANG Xiaoli, WU Pinchang, LIU Yu, et al. Preparation technology of curcumol liposome by ethanol injection method[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2012(4): 10–18.
DOI:10.13422/j.cnki.syfjx.2012.04.018 ( 0) 0)
|
| [38] |
YEH C C, SU Y H, LIN Y J, et al. Evaluation of the protective effects of curcuminoid (curcumin and bisdemethoxycurcumin)-loaded liposomes against bone turnover in a cell-based model of osteoarthritis[J]. Drug Design, Development and Therapy, 2015(9): 2285–2300.
DOI:10.2147/DDDT.S78277 ( 0) 0)
|
 2017, Vol. 15
2017, Vol. 15


