2. 青海省畜牧兽医科学院, 西宁 810016
2. Qinghai Academy of Animal Sciences and Veterinary Medicine, Xining 810016, China
隐孢子虫(Cryptosporidium spp.)是一种呈世界性分布的人兽共患寄生性原虫,已成为世界范围内水源性传播疾病中的重要病原体,它们能感染人、家畜和野生动物,严重威胁着人类和动物的健康及畜牧业的发展[1]。因为隐孢子虫是机会性致病病原体,在免疫功能低下的个体中常常出现暴发性或慢性、长期性感染,严重时可引发死亡,且目前尚无有效的预防治疗方法[2]。随着三株隐孢子虫(C.parvum Iowa Ⅱ,C.hominis TU502和C.muris RN66)全基因组测序工作的完成[3-4],这将更有利于对其基因结构和功能的研究。
钙依赖蛋白激酶(Calcium-dependent protein kinases, CDPKs)是一种丝氨酸/苏氨酸蛋白激酶,此激酶接收并传导Ca2+信号且其活性受Ca2+的调控而不依赖钙调素和磷脂。典型的CDPK分子是由四个结构域组成的多肽链,包括N末端的可变结构域(N-terminal variable domain)、激酶活性结构域(Kinases domain)、连接结构域(Junction domain,JD)和C末端钙调素类似结构域(CaM-like domain,CLD)[5],其参与多种生命活动的调控。
由于哺乳动物中不存在CDPKs的同源蛋白,所以CDPKs是理想的抗隐孢子虫的候选药靶。为了更好地分析这类蛋白激酶的功能及对隐孢子虫的重要意义,本文对隐孢子虫CDPKs蛋白的结构和特征进行全面的生物信息学分析,为进一步研究其生物学功能及其在疫苗和药靶研究中的应用提供线索。
1 材料与方法 1.1 数据收集在隐孢子虫基因组数据库(http://cryptodb.org/cryptodb/)中“Gene Text Search”信息栏输入并搜索CDPK,收集C.parvum Iowa Ⅱ,C.hominis TU502和C.muris RN66基因组中的CDPKs,获取各蛋白相对应的核苷酸序列及蛋白序列。
1.2 结构域分析与验证将搜索获得的蛋白序列输入到NCBI结构域数据库(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)中进行各蛋白的结构域搜索,以进一步确定分析CDPKs结构域;而后用在线搜索工具Pfam(http://pfam.xfam.org/)验证结构域搜索结果。
1.3 蛋白质特性预测将各个蛋白序列输入到ExPASy(http://www.expasy.org/)数据分析系统中,进行蛋白特性预测。采用ProtParam(http://web.expasy.org/protparam/)程序计算蛋白质的分子量、等电点和氨基酸组成等理化性质;采用TargetP(http://www.cbs.dtu.dk/services/TargetP/)和SignalP( http://www.cbs.dtu.dk/services/SignalP/)程序分析亚细胞定位序列等特征序列:分泌信号肽、质体、线粒体和过氧化物酶体等;采用Motif Scan(http://myhits.isb-sib.ch/cgi-bin/motif_scan)程序预测糖基化、磷酸化、脂酰化、cAMP和cGMP依赖蛋白激酶磷酸化位点及EF-hand钙结合域等修饰位点和模序。
1.4 蛋白质的二级结构和抗原表位分析利用DAS-TMfilter server(http://mendel.imp.ac.at/sat/DAS/DAS.html)、HMMTOP(http://www.enzim.hu/hmmtop/index.php)和TMHMM-2.0(http://www.cbs.dtu.dk/services/TMHMM-2.0/)分析蛋白的跨膜区域,应用ProtScale(http://web.expasy.org/protscale/)分析蛋白质的亲/疏水性。采用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)软件进行蛋白二级结构预测;利用Predicted Antigenic Peptides(http://imed.med.ucm.es/Tools/antigenic.pl)进行抗原表位分析。
1.5 序列比对与构建系统发育树通过NCBI提供的BLAST在线搜索服务软件获取顶复门寄生原虫弓形虫(Toxoplasma gondii ME49)、疟原虫(Plasmodium reichenowi)、巴贝斯虫(Babesia bovis)、球虫(Eimeria tenella)及隐孢子虫(C.parvum Iowa Ⅱ,C.hominis TU502和C.muris RN66)CDPKs的氨基酸序列。使用MEGA5.05软件的系统发育树构建功能对这些氨基酸序列进行分析,选择邻近法(Neighbor-Joining method, NJ)构建系系统发育树,并使用自展值(Bootstrap)检验其可靠性,重复次数为2 000,分析不同顶复门寄生原虫CDPKs基因间的进化关系。
2 结果分析 2.1 含CDPK结构域蛋白的初筛和确定在隐孢子虫基因组数据库的全基因组中搜索获得15个含有CDPK的结构域蛋白,根据注释描述分析发现5个假设蛋白(Hypothetical/putative protein),除去这些假设蛋白,将剩余的10个蛋白序列输入到NCBI结构域网站中搜索CDPK结构域后,只有6个蛋白是真正的CDPK蛋白,为进一步确认淘汰的是否是CDPK蛋白,将其输入到pfam结构域搜索,结果仍不是CDPK蛋白。因此,对这6个真正的CDPK蛋白进行深入分析。
2.2 蛋白基本性质分析经过ExpASy在线系统分析,如表 1所示这些蛋白的基本性质:其在氨基酸长度、分子量大小和等电点上差异不大,其氨基酸长度在523~677 aa,分子量从59.76 kDa到76.63 kDa,pI值从5.33~6.09,呈现着明显的区别。带正(12.35%~14.91%)、负(14.03%~16.25%)电荷氨基酸残基数占氨基酸总数比例基本一致,且带正电荷氨基酸残基比带负电荷氨基酸残基多。假定所有的半胱氨酸都形成二硫键,CDPKs在280 nm处的摩尔消光系数:46 215~87 500 L/mol·cm及0.1%浓度(1 g/L)的Abs值:0.773~1.128;假定所有的二硫键打开时,蛋白在280 nm处的摩尔消光系数:45 840~86 750 L/mol·cm及0.1%浓度(1 g/L)的Abs值为:0.767~1.119,可见其吸光性质有所差别。CDPKs在溶液中的不稳定指数为:37.46~45.06,除Cgd5_820外均高于阈值40,推测CDPKs为不稳定蛋白。CDPKs的脂肪族指数为:84.38~87.58,亲水性平均系数:-0.397~-0.486,蛋白总体亲水性较低。
| 表 1 CDPKs基本性质分析 Table 1 Analysis of basic properties of CDPKs |
模序分析潜在的翻译后修饰位点显示(如表 2),CDPKs蛋白含有糖基化位点:1~3个,糖基化位点保证CDPKs能够正确折叠且可以传导信号。蛋白激酶C磷酸化位点:6~9个;酪氨酸激酶Ⅱ磷酸化位点:11~14个;酪氨酸激酶磷酸化位点:1~2个;cAMP和cGMP依赖蛋白激酶磷酸化位点:1~3个;这可以促进其和其他蛋白质相互作用而形成多蛋白复合体,再进一步促进蛋白质的磷酸化。N端肉豆蔻酰化位点:2~5个;EF-hand钙结合域:7~8个;EF-hand结构域能与Ca+2离子结合而改变构象,进而暴露靶结合位点而发挥生物学功能。这些结构特征性序列如表 2所示,表明CDPKs具有重要的生物学功能。
| 表 2 翻译后修饰和结构特征性序列分析 Table 2 Analysis of posttranslational modification and structure characteristic sequence |
对CDPKs的信号肽和信号肽酶剪切位点的预测显示(如表 3), 它们的序列信号肽预测分值为:0.043~0.280,cutoff预测值均为0( < 0.9),表明CDPKs序列无信号肽和信号肽酶剪切位点。CDPKs的亚细胞定位分析发现,CDPKs序列定位于线粒体的部分得分为:0.063~0.274( < 0.9),而定位于其他部分的得分为:0.678~0.954(> 0.95),说明CDPKs序列没有线粒体等定位序列,且该预测具有较高可信度。CDPKs的二级结构预测分析发现α螺旋比例为:34.62%~49.33%,β折叠比例为:7.53%~11.66%,无规则卷曲比例为:23.14%~34.17%,延伸链比例为:13.86%~21.30%,可见CDPKs的二级结构以无规则卷曲为主。对CDPKs蛋白的氨基酸序列中潜在的抗原表位做进一步分析, 显示有20~29个潜在的抗原表位,且平均抗原倾向性均大于1.000,CDPKs蛋白含有较多的优势抗原表位结构,可作为一种免疫原性蛋白。
| 表 3 亚细胞定位和抗原表位分析及二级结构预测与分析 Table 3 Analysis and prediction of subcellular localization, antigenic epitope and secondary structure of CDPKs |
通过MAGE5.05软件构建的NJ树如图 1所示,其中用于构建系统发育树的3种隐孢子虫分析序列分为3个类群,有意思的是它们均与Toxoplasma gondii ME49聚为一支,可见在系统发育树上发现它们之间的进化距离最近。并且Chro.20142、cgd2_1300和Chro.70214、cgd7_1840一致性最高,可见C.parvum Iowa Ⅱ和C.hominis TU502的亲缘关系较近。这为后续从分子遗传学角度探索CDPKs的功能及其作为候选药靶和疫苗提供了新的思路。
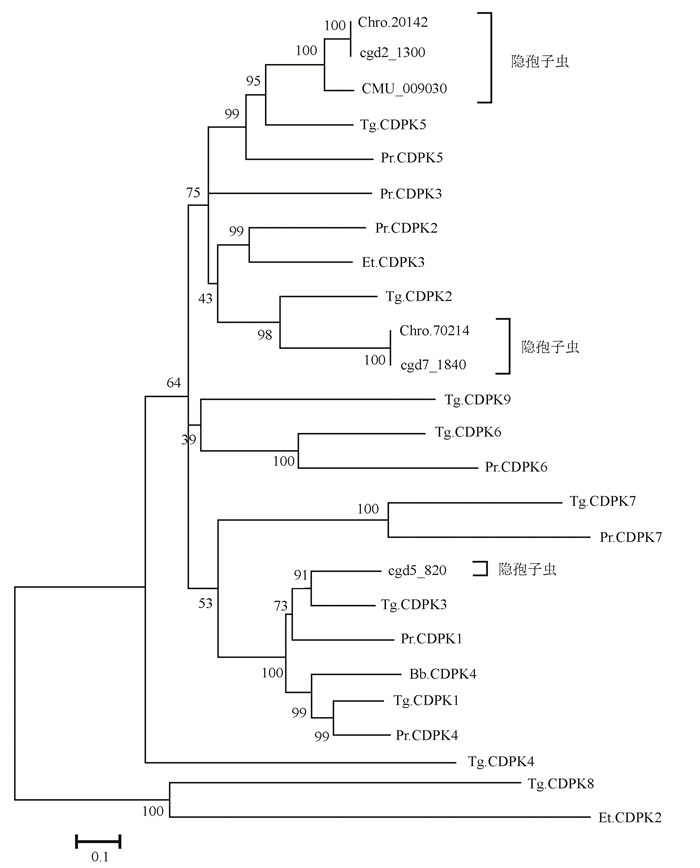
|
图 1 隐孢子虫与其他顶复门寄生原虫CDPKs的系统发育分析 Figure 1 Phylogenetic relationship analysis beteen cryptosporidium and other apicomplexan parasites based on CDPKs |
CDPKs是一类属于丝氨酸/苏氨酸蛋白激酶,在各种植物和原生动物中广泛存在并参与多种生命活动的调控。如在植物中,CDPKs参与离子泵/离子通道的开合、基因转录、细胞骨架构建、基因转录和新陈代谢等过程的调控[6]。随着原生生物基因组测序工作的开展,在弓形虫、疟原虫等顶复门原虫中发现了多个CDPKs同源蛋白[5]。在弓形虫和疟原虫研究中发现,CDPKs参与调控弓形虫虫体入侵细胞、运动、分化和蛋白分泌等生理过程;疟原虫的CDPKs可调控其入侵按蚊小肠上皮细胞和在宿主体内发育等过程。Manja Etzold等实验研究表明,隐孢子虫的CDPKs具有阶段性表达特征,CDPKs在隐孢子虫的生长发育以及进化过程中均发挥了重要作用[7]。同时,研究表明在哺乳动物中不存在CDPKs,所以CDPKs可以作为有效的疫苗和药靶研究候选分子[8-9]。
通过分析发现隐孢子虫的CDPKs是不具备分泌信号肽的疏水性蛋白,推测其在细胞内合成后可以直接发挥生物学功能。蛋白的多肽链合成后,不具有生物学活性,翻译完成后需要经过一系列的加工形成相对稳定的空间结构,从而发挥生物学功能;通过预测蛋白的二级结构发现,CDPKs由α螺旋和无规则卷曲构成。多项研究表明,蛋白质的去磷酸化和磷酸化对于细胞内信号传导十分重要,可以调控多种细胞过程活动[10];对隐孢子虫的CDPKs分析发现,CDPKs具有多个磷酸化位点,如蛋白激酶C磷酸化位点、酪氨酸激酶Ⅱ磷酸化位点、酪氨酸激酶磷酸化位点和cAMP和cGMP依赖蛋白激酶磷酸化位点。同时,N-端糖基化位点与物质转运和蛋白定位粘附密切相关[11],N-端肉豆蔻酰化位点也参与蛋白的定位过程[12];对隐孢子虫的CDPKs研究发现,其具有N-端糖基化位点和N-端肉豆蔻酰化位点。同时CDPKs均具有EF-hand结构域,其能与Ca2+结合从而促使CDPKs的构象改变,从而发挥Ca2+依赖蛋白激酶蛋白的各种功能[13]。本研究对CDPKs的抗原表位预测发现,均具有20多个,可能成为抗隐孢子虫感染疫苗的有效成分之一。因此,对CDPKs的理化性质、二级结构和功能位点的预测和分析,在该蛋白功能的进一步研究具有重要意义。
4 结论本研究通过生物信息学方法分析了三种隐孢子虫的CDPKs的基本性质,蛋白翻译后的修饰和结构特征性序列,及其亚细胞定位、抗原表位和二级结构等特征;此外,通过遗传关系比较分析,三种隐孢子虫的CDPKs均与弓形虫的聚在一起,可借鉴弓形虫的相关成果来研究隐孢子虫的CDPKs。研究发现,在疟原虫(Plasmodium reichenowi)、巴贝斯虫(Babesia bovis)、球虫(Eimeria tenella)等顶复门原虫中都存在CDPKs蛋白,同时,该蛋白与虫体对宿主细胞的粘附和入侵及其生长发育密切相关。因此,CDPKs基因有望成为研制隐孢子虫基因工程疫苗的候选基因以及抗隐孢子虫的潜在药物靶点。
| [1] |
O'DONOGHUE P J. Cryptosporidium and cryptosporidiosis in man and animals[J]. International Journal for Parasitology, 1995, 25(2): 139–195.
DOI:10.1016/0020-7519(94)E0059-V ( 0) 0)
|
| [2] |
COLFORD J M J R, TAGER I B, HIROZAWA A M, et al. Cryptosporidiosis among patients infected with human immunodeficiency virus. factors related to symptomatic infection and survival[J]. The American Journal of Epidemiology, 1996, 144(9): 807–816.
DOI:10.1093/oxfordjournals.aje.a009015 ( 0) 0)
|
| [3] |
ABRAHAMSEN M S, TEMPLETON T J, ENOMOTO S, et al. Complete genome sequence of the apicomplexan, Cryptosporidium parvum[J]. Science, 2004, 304(5669): 441–445.
DOI:10.1126/science.1094786 ( 0) 0)
|
| [4] |
XU P, WIDMER G, WANG Y, et al. The genome of Cryptosporidium hominis[J]. Nature, 2004, 431(7012): 1107–1112.
DOI:10.1038/nature02977 ( 0) 0)
|
| [5] |
BILLKER O, LOURIDO S, SIBLEY L D. Calcium-dependent signaling and kinases in apicomplexan parasites[J]. Cell Host Microbe, 2009, 5(6): 612–622.
DOI:10.1016/j.chom.2009.05.017 ( 0) 0)
|
| [6] |
HARMON A C, GRIBSKOV M, HARPER J F. CDPKs-a kinase for every Ca2+ signal?[J]. Trends in Plant Science, 2000, 5(4): 154–159.
DOI:10.1016/S1360-1385(00)01577-6 ( 0) 0)
|
| [7] |
ETZOLD M, LENDNER M, DAUGSCHIES A, et al. CDPKs of Cryptosporidium parvum-stage-specific expression in vitro[J]. Parasitology Research, 2014, 113(7): 2525–2533.
DOI:10.1007/s00436-014-3902-0 ( 0) 0)
|
| [8] |
CASTELLANOS-GONZALEZ A, WHITE A C J R, OJO K K, et al. A novel calcium-dependent protein kinase inhibitor as a lead compound for treating cryptosporidiosis[J]. The Journal of Infectious Diseases, 2013, 208(8): 1342–1348.
DOI:10.1093/infdis/jit327 ( 0) 0)
|
| [9] |
KEYLOUN K R, REID M C, CHOI R, et al. The gatekeeper residue and beyond: homologous calcium-dependent protein kinases as drug development targets for veterinarian Apicomplexa parasites[J]. Parasitology, 2014, 141(11): 1499–1509.
DOI:10.1017/S0031182014000857 ( 0) 0)
|
| [10] |
JOHNSON L N. The regulation of protein phosphorylation[J]. Biochemical Society Transactions, 2009, 37(4): 627–641.
DOI:10.1042/BST0370627 ( 0) 0)
|
| [11] |
BUTEAU H, PEZET A, FERRAG F, et al. N-glycosylation of the prolactin receptor is not required for activation of gene transcription but is crucial for its cell surface targeting[J]. Journal of Molecular Endocrinology, 1998, 12(4): 544–555.
DOI:10.1210/mend.12.4.0085 ( 0) 0)
|
| [12] |
LI L B, CHEN N, RAMAMOORTHY S, et al. The role of N-glycosylation in function and surface trafficking of the human dopamine transporter[J]. The Journal of Biological Chemistry, 2004, 279(20): 21012–21020.
DOI:10.1074/jbc.M311972200 ( 0) 0)
|
| [13] |
MORENO S N, DOCAMPO R. Calcium regulation in protozoan parasites[J]. Current Opinion in Microbiology, 2003, 6(4): 359–364.
DOI:10.1016/S1369-5274(03)00091-2 ( 0) 0)
|
 2016, Vol. 14
2016, Vol. 14


