2. 绵阳市人民医院, 四川 绵阳 621000
2. People's Hospital of Mianyang City, Mianyang 621000, Sichuan, China
卵巢癌是女性最常见的恶性肿瘤疾病之一,死亡率长期居女性恶性肿瘤之首。据2021年美国癌症协会统计显示[1],2021年美国新增卵巢癌患者约21 410人,占新发癌症人数的1.12%,估计死亡人数约13 770人(约2.26%)。此外,一项对对2004年至2015年SEER数据库中11 773例患者的研究发现[2],卵巢癌5年生存率从37.5%上升到了43.9%,但晚期卵巢癌的总体生存率仍然较低,仅26%。浆液性卵巢癌是卵巢癌最主要的病理类型之一[3],其发生发展机制复杂。新近发现细胞的一种新的死亡方式--铁死亡[4],其本质是铁离子依赖的脂质过氧化产物超量蓄积引起的以线粒体改变为主的氧化损伤,铁离子代谢失衡, 诱发机体大量活性氧类与脂质过氧化物的产生, 导致细胞铁死亡,铁死亡与肿瘤的发生发展密切相关[5],已有研究发现[6-9]铁死亡可作为分子生物标志物在胃癌、喉癌、胰腺癌等多种肿瘤的发生发展、治疗、预后起重要作用,但在浆液性卵巢癌中的报道较少。本文通过生物信息学的方法筛选与浆液性卵巢癌相关的铁死亡关键基因,并进行预测分析,以期为浆液性卵巢癌的治疗及预后提供有参考价值的分子生物标志物。
1 资料来源与方法 1.1 资料来源根据美国国立生物技术信息中心GEO数据库(https://www.ncbi.nlm.nih.gov.geo) 中收录的浆液性卵巢癌相关研究数据,得到GSE54388,GSE12470两个数据集。GSE54388数据集基于GPL570 Affymetrix Human Genome U133 Plus 2.0 Array平台进行分析,包括16例浆液性卵巢癌上皮细胞样本和6例正常人卵巢表皮细胞样本。GSE12470数据集基于GPL887 Human 1A Microarray (V2) 平台进行分析,包含35例晚期浆液性卵巢癌组织和10例正常人腹膜组织样本。下载TCGA数据库中426例浆液性卵巢癌组织样本及GTEx数据库中88例正常组织样本对筛选基因进行验证。铁死亡相关基因数据来源于FerrDb数据库(http://www.zhounan.org.ferrdb) 中提供的259个铁死亡相关基因。本研究涉及数据资料来源于公开数据库,无需医学伦理学再审查。
1.2 差异基因筛选使用R 4.0软件“limma”包分析挑选浆液性卵巢癌上皮细胞于正常卵巢上皮细胞中差异表达基因(Differentially expressed genes,DEGs)。基因表达的差异用P值和差异倍数(Fold change,FC) 的对数(logFC) 表示。定义命令包中的参数P<0.05且| logFC |>1的差异基因具有统计学意义。并使用“ggplot 2 ”绘制各数据集差异基因的火山图,使用“pheatmap”包绘制热图。通过Venn软件(http://bioinformatics.pbs.ugent.be.webtools.Venn)对GSE54388,GSE12470,FerrDb三个数据集取交集,作韦恩图。
1.3 GO和KEGG功能富集分析将1.2所得到的差异基因采用Metascape(http://metascape.org)在线工具进行GO(Gene ontology)功能注释和KEGG(Kyoto encyclopedia of genesand geonmes)信号通路富集分析,选取标准为P<0.05。
1.4 蛋白互作网络(Protein-protein interaction, PPI)构建采用String11.0数据库(https://cn.string-db.org)构建差异基因的PPI网络。利用Cytoscape3.9.1软件(http://www.cytoscape.org)中的MCODE插件对差异基因构建网络调控模块。
1.5 关键基因在浆液性卵巢癌中的预后表达应用Kaplan Meier plotter(http://kmplot.com.analysis)网站进一步对关键基因在浆液性卵巢癌样本的总生存情况进行分析,筛选出在浆液性卵巢癌组织中表达与总生存率有关的关键基因(P<0.05)。
1.6 关键基因的诊断价值分析使用R (4.2.1)中pROC包进行对数据进行ROC分析,结果用ggplot2进行可视化。
1.7 关键基因的验证在GEPIA2数据库(http://gepia.cancer-pku.cn)中验证核心基因在浆液性卵巢癌组和正常组中差异表达,参数设定为|log2FC|=1.0和P= 0.01。同时,在GEPIA2数据库中分析了浆液性卵巢癌不同阶段中的核心基因表达情况。
1.8 关键基因的免疫浸润分析免疫浸润算法选择基于R包GSVA中提供的ssGSEA算法, 利用24种免疫细胞的markers来计算免疫浸润情况,后采用ggplot2对数据中主变量和免疫浸润矩阵数据之间进行spearman相关性分析,分析结果用ggplot2包进行棒棒糖图可视化。
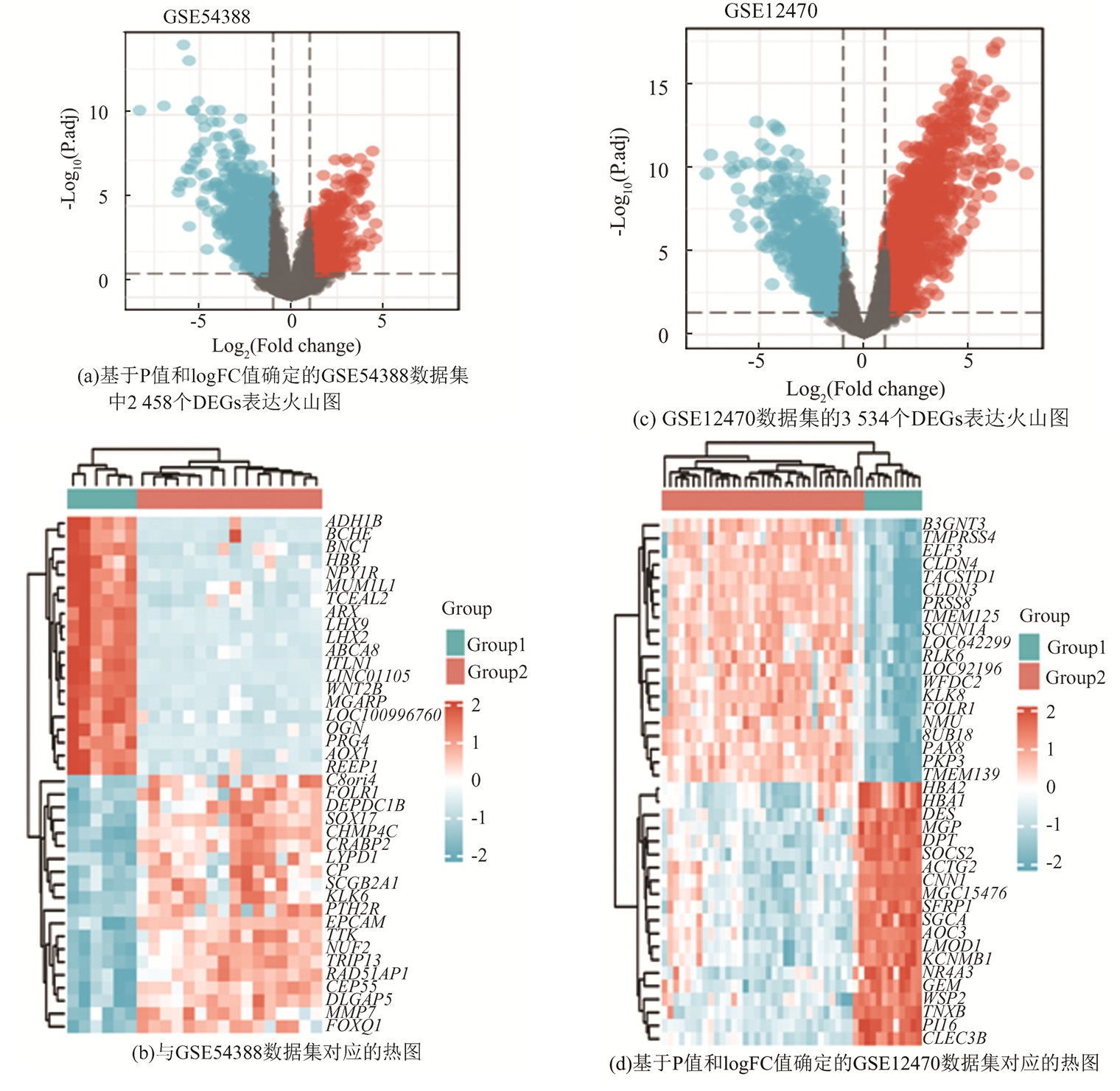
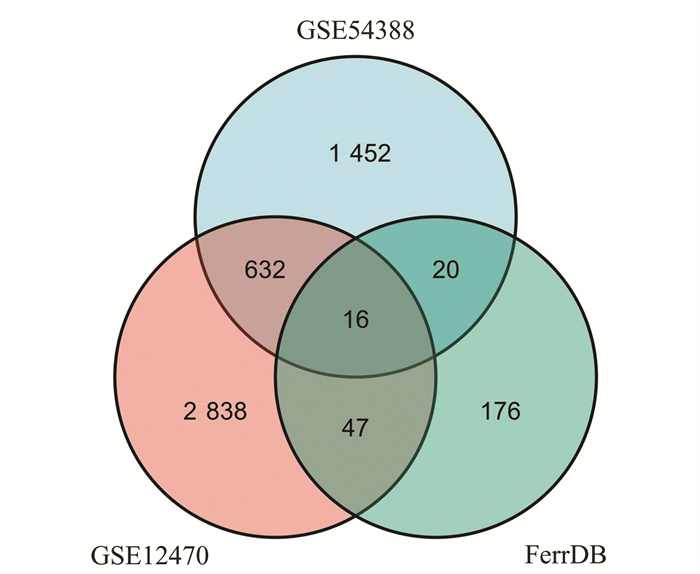
2 结果 2.1 DEGs的筛选从GSE54388中筛选出2 458个差异基因,其中上调1 309个,下调1 149个,从GSE12 470中筛选出3 534个差异基因,其中上调1 837个,下调1 697个,见图 1。与铁死亡基因数据集取交集,共得到16个共同差异表达基因(图 2)。
|
图 1 GSE54388和GSE12470数据集中差异表达基因(DEGs)的检测 Figure 1 Detection of differentially expressed genes (DEGs) in the GSE54388 and GSE12470 datasets |
|
图 2 GSE54388,GSE12470和FerrB数据集韦恩图 Figure 2 Venn plots of GSE54388, GSE12470 and FerrB datasets |
共筛选出与浆液性卵巢癌铁死亡相关的16个基因如下:MUC1, NRAS, CDKN2A, KRSA, CAV1, KEAP1, KLHL24, PGE, GOT1, GPT2, PSAT1, ASNS, GDF15, TRIB3, IREB2, RPL8P(表 1)。
| 表 1 浆液性卵巢癌铁死亡相关基因的表达情况 Table 1 Expression of genes related to iron death in serous ovarian cancer |
GO功能富集分析包括分子功能(Molecular function, MF)、生物过程(Biological process, BP),和细胞组成(Cellular component, CC)三个部分,结果显示16个相关基因中,BP的生物学过程包括蛋氨基酸代谢过程,α-氨基酸生物合成,细胞氨基酸生物合成,蛋白酶体泛素依赖蛋白分解代谢过程的正向调控,细胞氨基酸代谢过程等,CC的生物过程包括Cul3-RING泛素连接酶复合物,MF的生物学过程包括转氨酶活性,转移酶活性,转移含氮基团吡哆醛磷酸盐结合,维生素B6结合,维生素D结合蛋白结合等(表 2)。KEGG通路分析显示,16个浆液性卵巢癌铁死亡相关基因主要富集在氨基酸的生物合成,丙氨酸、天门冬氨酸和谷氨酸代谢,2-氧羧酸代谢碳代谢,精氨酸生物合成等5条通路(表 2)。
| 表 2 浆液性卵巢癌铁死亡关键基因GO/KEGG富集分析结果 Table 2 Results of GO/KEGG enrichment analysis of key genes for iron death in plasmacytotic ovarian cancer |
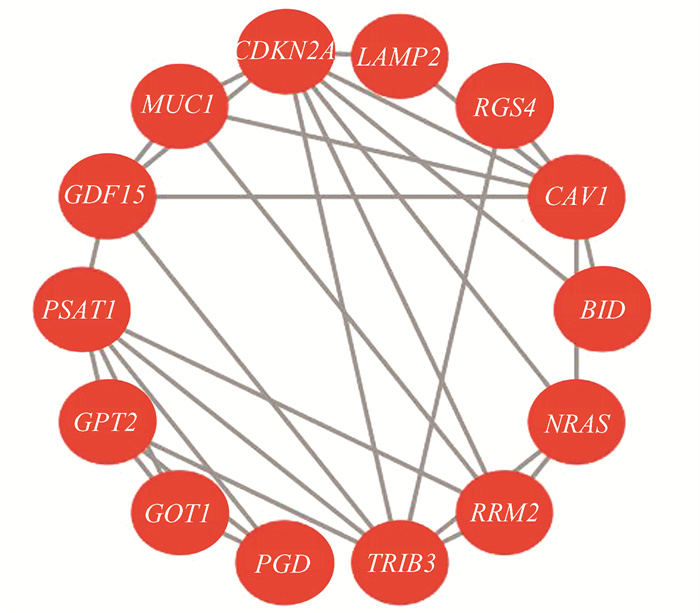
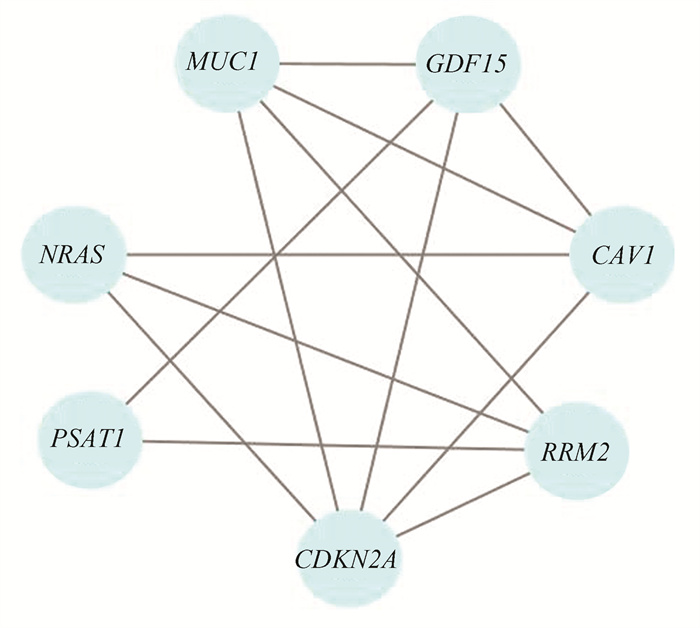
对16个DEG进行分析后,采用String 11.0数据库制作PPI网络图(图 3)。利用Cytoscape3.9.1软件中的MCODE模块对筛选的关键基因进行网络模块构建,最终筛选出7个与浆液性卵巢癌相关的铁死亡基因,其中6个基因MUC1, NRAS, PSAT1, CDKN2A, RRM2, GDF15表达上调,1个基因CAV1表达下调(图 4)。
|
图 3 DEGs表达的PPI网络图 Figure 3 PPI network diagram expressed by DEGs |
|
图 4 关键基因模块 Figure 4 Key gene module |
Kaplan Meier plotte对7个关键基因绘制生存曲线(图 5),进行生存分析,最终发现浆液性卵巢癌中NRAS, PSAT1, CDKN2A, GDF15这4个基因高表达,以及CAV1基因的低表达与患者总生存率不良相关(P<0.05)。
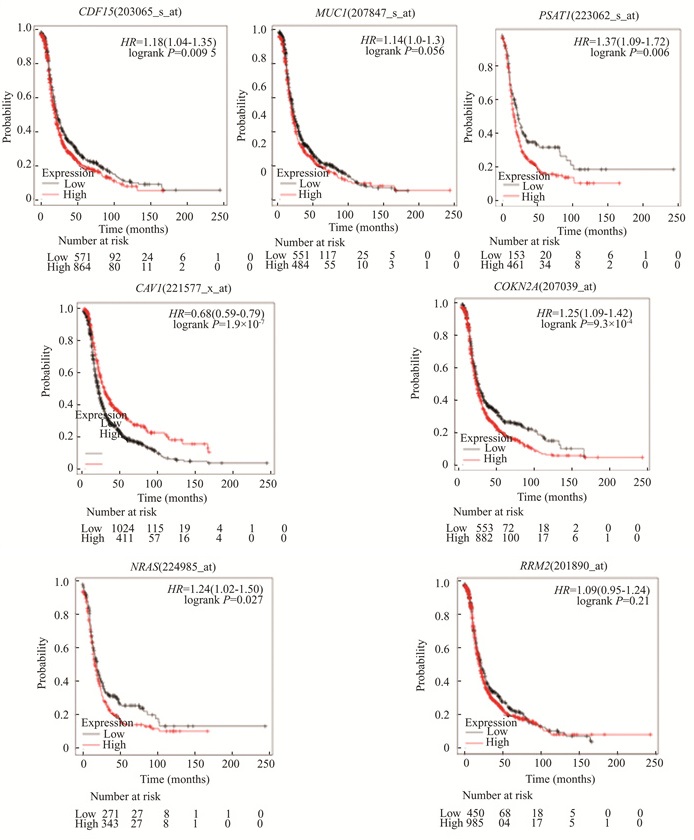
|
图 5 GDF15, MUC1, PSAT1, RRM2, CAV1, CDKN2A, NRAS与浆液性卵巢癌患者的预后关系 Figure 5 Prognosis of GDF15, MUC1, PSAT1, RRM2, CAV1, CDKN2A, NRAS and patients with plasmacytotic ovarian cancer |
使用pROC包进行对上述筛选基因绘制ROC曲线,数据采用TCGA中的427例浆液性卵巢癌组织样本及GTEx数据库中88例正常组织样本。ROC曲线分析显示:CAV1, CDKN2A, GDF15, NRAS, PSAT1这5个基因AUC曲线下面积均大于0.7,其中CAV1,NRAS,PSAT1的诊断面积大于0.95,有较高的诊断价值(图 6)。
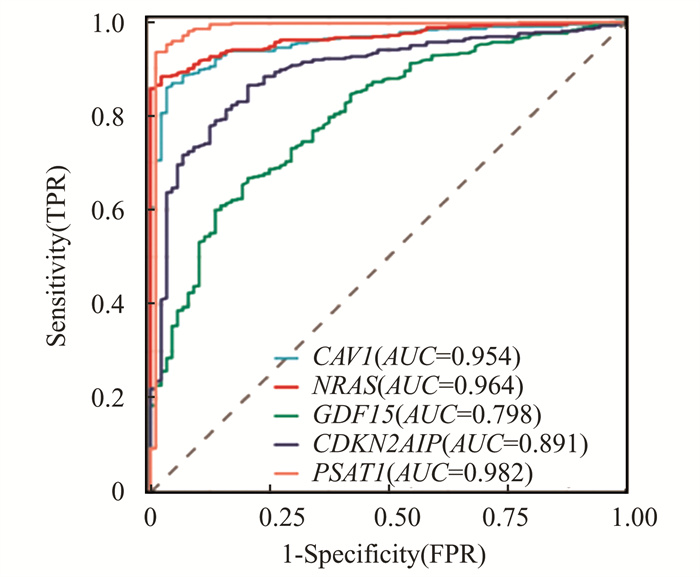
|
图 6 CAV1, CDKN2A, GDF15, NRAS, PSAT1的ROC曲线 Figure 6 ROC curves of CAV1, CDKN2A, GDF15, NRAS, PSAT1 |
在GEPIA2数据库(http://gepia.cancer-pku.cn)中验证核心基因在浆液性卵巢癌组和正常组中差异表达,参数设定为| log2FC | = 1.0和P<0.01。结果发现GDF15, PSAT1, CDKN2A, NRAS这4个基因在426例浆液性卵巢癌患者中高表达,与88例正常人群存在明显差异(P<0.05), CAV1基因在426例浆液性卵巢癌患者中表达低于88例正常样本,差异有统计学意义(P<0.05)见图 7。CAV1, CDKN2A, GDF15, NRAS, PSAT1在浆液性卵巢癌患者临床Ⅱ期、Ⅲ期、Ⅳ期的表达情况显示,仅NRAS基因表达在浆液性卵巢癌患者Ⅱ期、Ⅲ期、Ⅳ期有显著差异(P<0.05)见图 8。
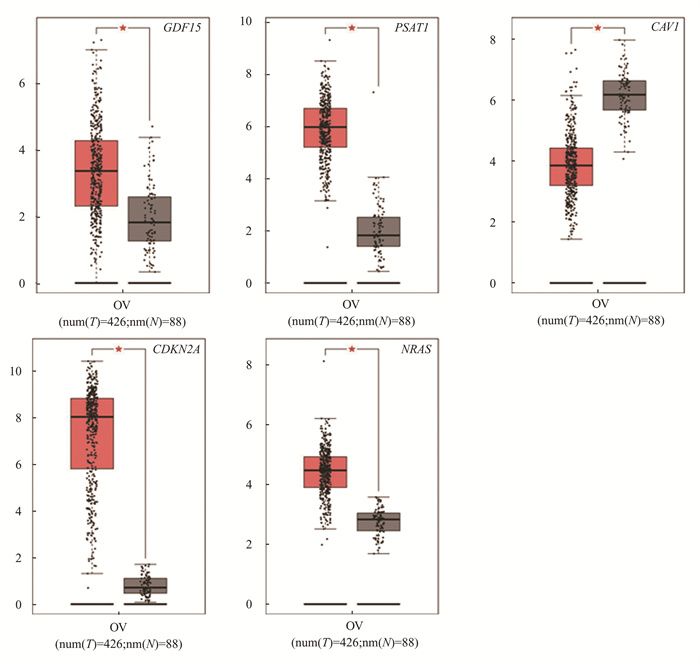
|
图 7 GDF15, PSAT1, CAV1, CDKN2A, NRAS在卵巢癌组织和正常组织基因表达图 Figure 7 Gene expression of GDF15, PSAT1, CAV1, CDKN2A, NRAS in ovarian cancer and normal tissues |
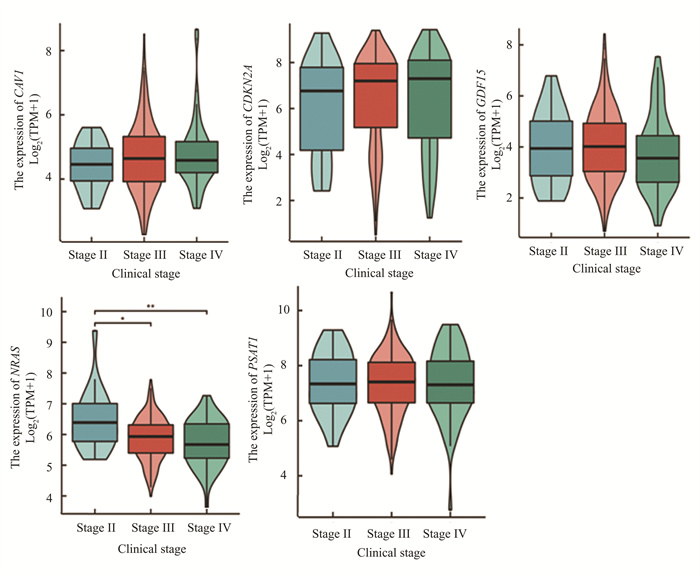
|
图 8 CAV1, CDKN2A, GDF15, NRAS, PSAT1在浆液性卵巢癌患者不同临床阶段的表达 Figure 8 Expression of CAV1, CDKN2A, GDF15, NRAS, PSAT1 in patients with plasmacytotic ovarian cancer at different clinical stages |
CAV1,CDKN2A,GDF15, NRAS和PSAT1与24中免疫细胞浸润分析显示,CDKN2A表达与aDC细胞浸润水平呈正相关(P<0.05,spearman相关系数0.353)。CAV1表达与Mast细胞浸润正向关(P<0.05,spearman相关系数0.327),NRAS与T helper细胞浸呈正向关(P<0.05,spearman相关系数0.362)(图 9)。
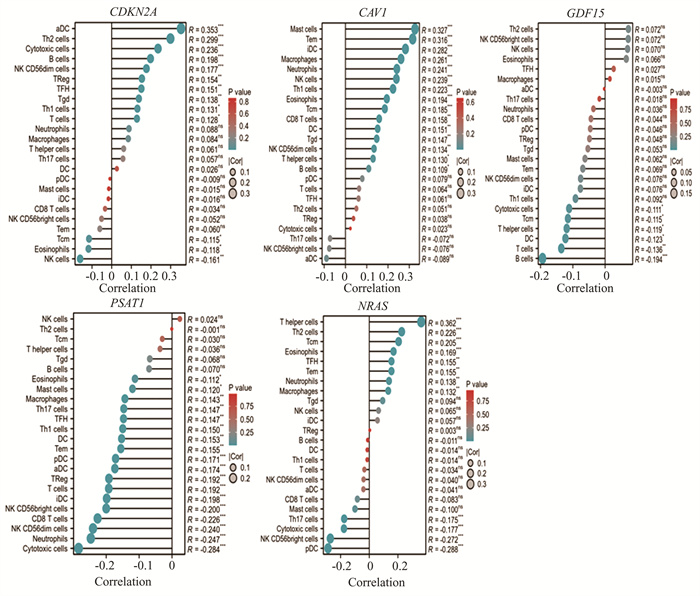
|
图 9 五个关键基因的免疫浸润分析 Figure 9 Immune infiltration analysis of 5 key genes |
卵巢癌是全球女性七大常见癌症之一,同时也是导致死亡人数最多的女性恶性肿瘤[10]。浆液性卵巢癌是其主要的病理分型之一,患者早期大多无明显症状,70%以上确诊已到晚期,预后极差[11]。筛选与浆液性卵巢癌发生发展密切相关的生物标志物,对阐明其发生发展、复发及耐药的分子机制有重要意义,同时对临床治疗提供新靶点有重要价值。最新研究发现铁死亡在肿瘤发生发展过程中起重要作用[4-5, 12],但能否作为浆液性卵巢癌早期诊断,治疗及预后观察的分子生物标志物,相关报道较少。本研究通过提取GEO数据库中有关浆液性卵巢癌研究的GSE54388,GSE12470两个数据集共51例浆液性卵巢癌上皮细胞mRNA数据和16例正常卵巢表面上皮细胞mRNA数据,结合FerrDb数据库铁死亡相关基因数据集,采用生物信息学的方法,获取16个与浆液性卵巢癌相关的铁死亡基因,进一步进行功能富集分析,蛋白互作网络分析,得到MUC1,NRAS,PSAT1,CDKN2A,RRM2, GDF15和CAV1 7个关键基因,并进行预后生存分析及基因表达分析。发现NRAS,PSAT1, CDKN2A和GDF15这4个基因高表达以及CAV1的低表达与患者总生存率不良相关(P<0.05)。
铁死亡是一种全新的细胞死亡方式[13], 具有独特的形态结构、生物化学及遗传学表现, 其本质是铁离子依赖的脂质过氧化产物超量蓄积引起的以线粒体改变为主的氧化损伤。铁离子代谢失衡, 诱发机体大量活性氧类与脂质过氧化物的产生, 导致细胞铁死亡。铁死亡与肿瘤、神经退行性疾病、缺血再灌注损伤等多种疾病有关[14],Caveolin-1 (CAV1)位于第7号染色体上[15],该基因编码的支架蛋白是在大多数细胞类型中发现的细胞膜穴样内陷的主要组成部分,该蛋白将整合素亚基连接到酪氨酸激酶FYN,这是将整合素偶联到Ras-ERK通路并促进细胞周期进程的起始步骤。作为细胞铁死亡抑制基因,CAV1已证明在保护肝细胞免受自身免疫介导的肝炎(AIH) 铁死亡中起着重要作用[16]。在肺癌中,CAV1表达与病理分期相关,且肺癌CAV1磷酸化表达水平显著相关,与癌症相关的成纤维细胞、内皮细胞和中性粒细胞的免疫浸润与CAV1表达呈统计学正相关[17]。Yang liuyuan等[18]对155例卵巢癌患者血浆分离的外泌体研究发现,卵巢癌患者外泌体中CAV1的低水平与卵巢癌FIGO Ⅰ, Ⅱ期、低分级、淋巴结转移及预后密切相关,血浆外泌体CAV1可能是卵巢癌患者预后的潜在生物标志物。本文也发现在浆液性卵巢癌患者上皮细胞中CAV1基因表达低于正常细胞。CDKN2A即细胞周期素依赖性蛋白激酶抑制因子2A[19],在细胞周期G1期-S期转变中起到参与调节作用, 参与细胞增殖、凋亡过程,研究发现[20]CDKN2A的基因多态性会增加妊娠期女性HPV感染风险,此外,CDKN2A基因甲基化水平与年龄以及多种蛋白指标密切相关[21],Koss等[22]也研究发现肿瘤浸润淋巴细胞(Tumor-infiltrating lymphocytes,TIL)和癌细胞作为代谢资源往往使T细胞功能失调。环境胁迫会导致组蛋白甲基转移酶EZH2缺失导致TIL中表观基因组重构事件,而CDKN2A基因起至关重要作用。NRAS是一个N-ras致癌基因,编码在高尔基体和质膜之间穿梭的膜蛋白。这种穿梭膜蛋白是通过ZDHHC9-GOLGA7复合物的棕榈酰化和去棕榈酰化调节的。编码的蛋白质具有固有的GTPase活性,被鸟嘌呤核苷酸交换因子激活,被GTPase激活蛋白灭活。该基因的突变与体细胞直肠癌、滤泡性甲状腺癌、自身免疫性淋巴增生性综合征、青少年髓单核细胞白血病相关[23-25]。磷酸丝氨酸转氨酶1 (PSAT1)是催化丝氨酸-甘氨酸生物合成途径的关键酶,Yiqun zhang等[26]研究发现PSAT1水平高的卵巢癌细胞具有较高的还原性谷胱甘肽/氧化性谷胱甘肽比值和较低的活性氧(ROS)含量,PSAT1通过调节氧化还原平衡参与肿瘤生长,可作为晚期卵巢癌病人的潜在治疗靶点。GDF15即生长分化因子15,已被证实[27]其在衰老过程中扮演着关键角色,是随着年龄上调最多的蛋白质,与各种年龄相关疾病有关。张博等[28]发现上皮性卵巢癌患者血清GDF15显著升高, 检测血清GDF15水平有助于卵巢癌的临床诊断。
总之,本文通过生物信息学的方法筛选出5个与浆液性卵巢癌铁死亡相关基因CAV1, NRAS, PSAT1, CDKN2A和GDF15,部分基因已证实在卵巢癌发生发展过程中起重要作用,作为新的分子生物标志物在浆液性卵巢癌的诊断、治疗、预后预测等方面有巨大的潜力,有重要的意义。本文不足之处在于这5个基因缺乏实验验证,它们在浆液性卵巢癌发生发展过程的具体机制有待进一步研究。
| [1] |
SIEGELl R L, MILLER K D, FUCHS H E, et al. Cancer statistics, 2021[J]. CA: A Cancer Journal for Clinicians, 2021, 71(1): 7-33. DOI:10.3322/caac.21654 (  0) 0) |
| [2] |
ZHENG Peng, ZHENG Ping, CHEN Guilin. Conditional survival of advanced epithelial ovarian cancer: A real-world data retrospective cohort study from the seer database[J]. Frontiers Medicine (Lausanne), 2021, 8: 756401. DOI:10.3389/fmed.2021.756401 (  0) 0) |
| [3] |
郭丽, 王忱, 张萍, 等. 高级别浆液性卵巢癌的分子遗传学研究进展[J]. 中国实用妇科与产科杂志, 2021, 5(9): 982-984. GUO Li, WANG Chen, ZHANG Ping, et al. Molecular genetics research progress of high grade serous ovarian cancer[J]. Chinese Journal of Practical Gynecology and Obstetrics, 2021, 5(9): 982-984. DOI:10.19538/j.fk2021090123.k2021090123 (  0) 0) |
| [4] |
程洁, 陆军, 王章桂. 铁死亡在肿瘤治疗中的研究进展[J]. 中华肿瘤防治杂志, 2020, 27(19): 1598-1604. CHENG Jie, LU Jun, WANG Zhanggui. Iron death research progress in the treatment of tumor[J]. Chinese Journal of Cancer Prevention and Control, 2020, 27(19): 1598-1604. DOI:10.16073/j.cnki.cjcpt.2020.19.11.carrollnkiCJCPT.2020.19.11 (  0) 0) |
| [5] |
向亮, 何东, 曹科, 等. 铁死亡在恶性肿瘤治疗中的研究进展[J]. 中国肿瘤, 2021, 30(4): 300-308. XIANG Liang, HE Dong, CAO Ke, et al. Research progress of iron death in the treatment of malignant tumor[J]. China Cancer, 2021, 30(4): 300-308. DOI:10.11735/j.issn.1004-0242.2021.04.A009 (  0) 0) |
| [6] |
徐丽程, 曹晶, 李文静, 等. 喉鳞癌铁死亡的验证及M2巨噬细胞源性外泌体的调控研究[J]. 中华耳鼻咽喉头颈外科杂志, 2022, 57(3): 324-332. XU Licheng, CAO Jing, LI Wenjing, et al. Identification of iron death and regulation of M2 macrophage-derived exosomes in Laryngeal squamous cell carcinoma[J]. The Chinese Journal of Otolaryngology Head and Neck Surgery, 2022, 57(3): 324-332. DOI:10.3760/cma.j.cn115330-20210621-00361.J.c.n115330-20210621-00361 (  0) 0) |
| [7] |
CHEN Xinming, ZHU Zheng, LI Xiaoling, et al. The ferroptosis-related noncoding RNA signature as a novel prognostic biomarker in the tumor microenvironment, immunotherapy, and drug screening of gastric adenocarcinoma[J]. Frontiers in Oncology, 2021, 11: 778557. DOI:10.3389/fonc.2021.778557 (  0) 0) |
| [8] |
SHAO Yanfei, JIA Hongtao, LI Shuchun, et al. Comprehensive analysis of ferroptosis-related markers for the clinical and biological value in gastric cancer[J]. Oxidative Medicine and Cellular Longevity, 2021, 2021: 7007933. DOI:10.1155/2021/7007933 (  0) 0) |
| [9] |
周文博, 孔晨飞, 秦高伟, 等. 铁死亡发生机制的研究进展[J]. 生物化学与生物物理进展, 2018, 45(1): 16-22. ZHOU Wenbo, KONG Chenfei, QIN Gaowei, et al. Iron deaths occur mechanism research progress[J]. Progress in Biochemistry and Biophysics, 2018, 45(1): 16-22. DOI:10.16476/j.pibb.2017.0136.ibb.2017.0136 (  0) 0) |
| [10] |
WEBB P M, JORDAN S J. Epidemiology of epithelial ovarian cancer[J]. Best Practice & Research Clinical Obstetrics & Gynaecology, 2017, 41: 3-14. DOI:10.1016/j.bpobgyn.2016.08.006 (  0) 0) |
| [11] |
GAILLARD S L, SECORD A A, MONK B. The role of immune checkpoint inhibition in the treatment of ovarian cancer[J]. Gynecologic Oncology Research and Practice, 2016, 3: 11. DOI:10.1186/s40661-016-0033-6 (  0) 0) |
| [12] |
史梦琳, 张会禄, 罗忠光, 等. 诱导铁死亡--肿瘤治疗的新途径[J]. 上海医药, 2021, 42(23): 16-20. SHI Menglin, ZHANG Huilu, LUO Zhongguang, et al. Iron induced death - a new way of tumor therapy[J]. Journal of Medicine, Shanghai, 2021, 42(23): 16-20. DOI:10.3977/j.issn.1005-8478.2021.12.09.SSN.1005-8478.2021.12.09 (  0) 0) |
| [13] |
梅胜兰, 夏中元, 孟庆涛, 等. 细胞铁死亡发生机制的研究进展[J]. 医学综述, 2020, 26(21): 4207-4211. MEI Shenglan, XIA Zhongyuan, MENG Qingtao, et al. Research progress in the mechanism of cell iron death[J]. Journal of Medical Review, 2020, 26(21): 4207-4211. DOI:10.3969/j.issn.1006-2084.2020.21.010 (  0) 0) |
| [14] |
陈璐瑶, 饶小珍. 铁死亡的发生机制及相关疾病研究进展[J]. 生物学教学, 2022, 47(2): 2-5. CHEN Luyao, RAO Xiaozhen. Progress in the pathogenesis of iron death and related diseases[J]. Biology Teaching, 2022, 47(2): 2-5. DOI:10.3969/j.issn.1004-7549.2022.02.001 (  0) 0) |
| [15] |
KAYA S, WIESMANN N, GOLDSCHMITT J, et al. Differences in the expression of caveolin-1 isoforms in cancer-associated and normal fibroblasts of patients with oral squamous cell carcinoma[J]. Clinical Oral Investigations, 2021, 25(10): 5823-5831. DOI:10.1007/s00784-021-03887-8 (  0) 0) |
| [16] |
DENG Guanghui, LI Yunjia, MA Shuoyi, et al. Caveolin-1 dictates ferroptosis in the execution of acute immune-mediated hepatic damage by attenuating nitrogen stress[J]. Free Radical Biology and Medicine, 2020, 148: 151-161. DOI:10.1016/j.freeradbiomed.2019.12.026 (  0) 0) |
| [17] |
YIN Dongdong, QIU Jiayang, HU Suxia, et al. CAV1 is a prognostic predictor for patients with idiopathic pulmonary fibrosis and lung cancer[J]. Journal of Biosciences, 2022, 47: 13. DOI:10.1007/s12038-021-00245-4 (  0) 0) |
| [18] |
YANG Lijuan, WU Haohao, ZHU Yan, et al. Plasma exosomal caveolin-1 predicts poor prognosis in ovarian cancer[J]. Journal of Cancer, 2021, 12(16): 5005-5012. DOI:10.7150/jca.58762 (  0) 0) |
| [19] |
贺小威, 徐玲. 细胞周期相关基因CDKN2A、TP53、RB1和BRCA2在恶性肿瘤中的研究进展[J]. 现代肿瘤医学, 2018, 26(1): 153-157. HE Xiaowei, XU Ling. Research progress of cell cycle related genes CDKN2A, TP53, RB1 and BRCA2 in malignant tumors[J]. Modern Oncology Medicine, 2018, 26(1): 153-157. DOI:10.3969/j.issn.1672-4992.2018.01.040 (  0) 0) |
| [20] |
付红艺, 马智, 王薇, 等. CDKN2A基因多态性与妊娠期人乳头状瘤病毒感染的关联性[J]. 中华医院感染学杂志, 2022, 32(4): 574-577. FU Hongyi, MA Zhi, WANG Wei, et al. Association between CDKN2A gene polymorphism and human papilloma virus infection in pregnancy[J]. Chinese Journal of Nosocomiology, 2022, 32(4): 574-577. DOI:10.11816/cn.ni.2022-21074.Ni.2022-21074 (  0) 0) |
| [21] |
郑中华, 季慧慧, 陈楚嘉, 等. 健康人群CDKN2A和CDKN2B基因甲基化水平与衰老的相关性[J]. 南方医科大学学报, 2019, 39(6): 724-730. ZHENG Zhonghua, JI Huihui, CHEN Chujia, et al. Relationship between methylation levels of CDKN2A and CDKN2B genes and aging in healthy population[J]. Journal of Southern Medical University, 2019, 39(6): 724-730. (  0) 0) |
| [22] |
KOSS B, SHIELDS B D, TAYLOR E M, et al. Epigenetic control of Cdkn2a.Arf protects tumor-infiltrating lymphocytes from metabolic exhaustion[J]. Cancer Research, 2020, 80(21): 4707-4719. DOI:10.1158/0008-5472.CAN-20-0524 (  0) 0) |
| [23] |
郑湧智, 郑浩, 陈再生, 等. 二代测序技术检测儿童急性淋巴细胞白血病的基因突变谱及其预后意义[J]. 中华血液学杂志, 2022, 43(1): 19-25. ZHENG Yongzhi, ZHENG Hao, CHEN Zaisheng, et al. Detection of gene mutation spectrum and its prognostic significance in children with acute lymphoblastic leukemia by second-generation sequencing[J]. Chinese Journal of Hematology, 2022, 43(1): 19-25. DOI:10.3760/cma.j.issn.0253-2727.2022.01.005 (  0) 0) |
| [24] |
PINHEIRO M, PEXIXOTO A, ROCHA P, et al. KRAS and NRAS mutational analysis in plasma ctDNA from patients with metastatic colorectal cancer by real-time PCR and digital PCR[J]. International Journal of Colorectal Disease, 2022, 37(4): 895-905. DOI:10.1007/s00384-022-04126-6 (  0) 0) |
| [25] |
SCHULER M, ZIMMER L, KIM K B, et al. Phase Ib/Ⅱ Trial of ribociclib in combination with binimetinib in patients with NRAS-mutant melanoma[J]. Clinical Cancer Research, 2022, 28(14): 3002-3010. DOI:10.1158/1078-0432.CCR-21-3872 (  0) 0) |
| [26] |
ZHANG Yiqun, LI Jiajia, DONG Xuhui, et al. PSAT1 regulated oxidation-reduction balance affects the growth and prognosis of epithelial ovarian cancer[J]. OncoTargets and Therapy, 2020, 13: 5443-5453. DOI:10.2147/OTT.S250066 (  0) 0) |
| [27] |
CONTE M, GIULIANI C, CHIARIELLO A, et al. GDF15, an emerging key player in human aging[J]. Ageing Research Reviews, 2022, 75: 101569. DOI:10.1016/j.arr.2022.101569 (  0) 0) |
| [28] |
张博, 张颖, 牛力春, 等. 血清GDF15和CA125水平检测对上皮性卵巢癌患者的诊断价值[J]. 陕西医学杂志, 2016, 45(2): 225-227. ZHANG Bo, ZHANG Ying, NIU Lichun, et al. Diagnostic value of serum GDF15 and CA125 levels in patients with epithelial ovarian cancer[J]. Shaanxi Medical Journal, 2016, 45(2): 225-227. DOI:10.3969/j.issn.1000-7377.2016.02.041 (  0) 0) |
 2024, Vol. 22
2024, Vol. 22


