2. 贵州医科大学附属医院 心内科,贵阳 550004
2. Department of Cardiology, Affiliated Hospital of Guizhou Medical University, Guiyang 550004, China
库欣综合征(Cushing's syndrome, CS)是由于长期暴露于升高的内源性皮质醇所致的一种临床综合征[1],且长期的糖皮质激素过量会导致许多合并症,损害生活质量并增加死亡率[2]。CS主要分为促肾上腺皮质激素(Adrenocorticotrophic hormone,ACTH)依赖性和非依赖性两大类,前者发生的主要原因是由垂体腺瘤(库欣病)或异位ACTH依赖性综合征,如小细胞肺癌、胸腺类癌等分泌过量的ACTH,刺激双侧肾上腺增生并分泌过量的皮质醇所致;后者是由于肾上腺皮质腺瘤、腺癌或结节性增生自主性地分泌过量皮质醇所致[3]。双侧大结节性肾上腺皮质增生症(Bilateral macronodular adrenal hyperplasia,BMAH)或ACTH非依赖性大结节性肾上腺皮质增生症(ACTH-independent macronodular adrenal hyperplasia,AIMAH)由Kirschner等于1964年首次描述[4],是一种罕见的临床疾病,其特征是双侧肾上腺皮质中存在多个良性结节[5]。据报道,BMAH约占中国库欣综合征患者所有内源性病因的6.2% [6],其病因仍不明确, 既往认为其是由ACTH依赖性逐渐转变为ACTH非依赖性,但近年的研究表明其可由ACTH以外因素, 如精氨酸加压素(Arginine vasopressin,AVP)、抑胃肽(Gastric inhibitory peptide,GIP)、儿茶酚胺(Catecholamines,CA)等受体的异常表达引起,最终使得肾上腺细胞增生[7]。由于BMAH发展缓慢,皮质醇增多症和临床CS隐匿发展,导致亚临床库欣综合征的比例很高[8],CS本身的隐匿发作也可能导致诊断延迟。此外,BMAH与遗传有着密切的联系[9],对家族性形式和疾病双侧特征的描述表明,这些疾病是遗传决定的,这已在近70%的原发性色素微结节性肾上腺和25%的原发性双侧大结节性肾上腺皮质增生症病例中得到证实[10],受影响患者的相关家庭成员有发生BMAH的风险。BMAH患者在诊断前有长期暴露于皮质醇过量的有害组织分解代谢作用的风险,临床上迫切需要早期的诊断和治疗,然而目前该疾病缺乏可靠的诊断和治疗生物标志物。因此本研究结合生物信息学分析,探索家族性双侧大结节性肾上腺皮质增生症的潜在生物标志物,为该疾病的临床诊断和治疗提供参考。
1 资料与方法 1.1 数据获取与处理从GEO数据库(https://www.ncbi.nlm.nih.gov/geo/)中下载了Gagliardi L等上传的关于家族性的BMAH的微阵列表达谱数据集GSE171558和Almeida MQ等上传的关于AIMAH的表达数据集GSE25031。GSE171558数据集基于GPL6244 Affymetrix Human Gene 1.0 ST Array平台进行分析,作为训练数据集。它包含8个样本,包括三个受家族影响的6个样本和2个正常对照。GSE25031数据集基于GPL6255 Illumina humanRef-8 v2.0 expression beadchip平台进行分析,作为验证数据集。它包括7个样本和3个正常组织。两个数据集在上传时已对数据进行归一化处理。除此之外,本研究去除了不匹配基因符号和重复基因符号的探针。本研究的数据可从GEO数据库免费下载,因此不需要患者的伦理批准和知情同意。
1.2 差异表达基因(DEGs)的鉴定基于DEGs的纳入标准P < 0.05和log2|FC|>1,通过R软件中的“limma”[11]包来识别数据集GSE171558的差异表达基因。本研究提供了DEGs的火山图和热图。火山图和热图通过微生信(http://www.bioinformatics.com.cn)绘制,这是一个免费的在线数据分析和可视化平台。
1.3 DEGs的功能富集分析使用DAVID 6.8(https://david.ncifcrf.gov/tools.jsp)对DEGs进行富集分析。该分析包括基因本体论(Gene ontology,GO)术语,即生物过程(Biological process,BP)、细胞成分(Cellular component,CC)和分子功能(Molecular function,MF),主要用于预测蛋白质功能[12]和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)途径,主要用于构建分子相互作用、反应和关系网络[13]。选择P < 0.05和富集基因计数≥ 5作为统计显著性的标准,并进行可视化。如果词条超过十个,则选择前十个富集基因计数较多的词条可视化。
1.4 蛋白质-蛋白质相互作用(PPI)网络分析使用在线数据库STRING(https://string-db.org/)进行了蛋白质-蛋白质相互作用(Protein-protein interaction,PPI)网络分析,以评估DEGs的蛋白质-蛋白质相互作用。将DEGs映射到PPI网络上,并设置交互得分>0.9作为阈值。此外,使用Cytoscape v3.9.1软件中的插件cytoHubba分别通过三种算法(MCC、MNC和Degree)筛选出高度值最高的前10个基因,并通过维恩图可视化三种算法共同的关键基因。维恩图是使用Venny 2.1 (Venny (csic.es)) 绘制的。
1.5 数据集验证hub基因数据集GSE25031包含7个样本和3个健康样本,作为验证集以验证hub基因的表达。P < 0.05被认为具有统计学意义,具有统计学意义的基因作为关键的生物标志物,对BMAH的诊断和治疗具有重要价值。
1.6 基因集富集分析(GSEA)根据hub基因表达的中位数,将BMAH样本分为高表达组和低表达组,将处理后的差异倍数值进行从大到小排序, 用来表示基因在两组间的表达量变化趋势,以更准确地确定每个关键生物标志物的功能。
1.7 TF-miRNA共调控网络和蛋白质-化合物相互作用NetworkAnalyst[14](https://www.networkanalyst.ca/)用于构建关键生物标志物的TF-miRNA共调控网络,调控相互作用信息是从RegNetwork存储库中收集的,并识别与关键生物标志物相互作用的化合物。
2 结果 2.1 DEGs的识别基于DEGs∣log2FC|>1,P < 0.05的纳入标准,数据集GSE171558共鉴定出336个DEGs,其中上调基因147个,下调基因189个。火山图和热图展示了DEGs的结果(见图 1)。
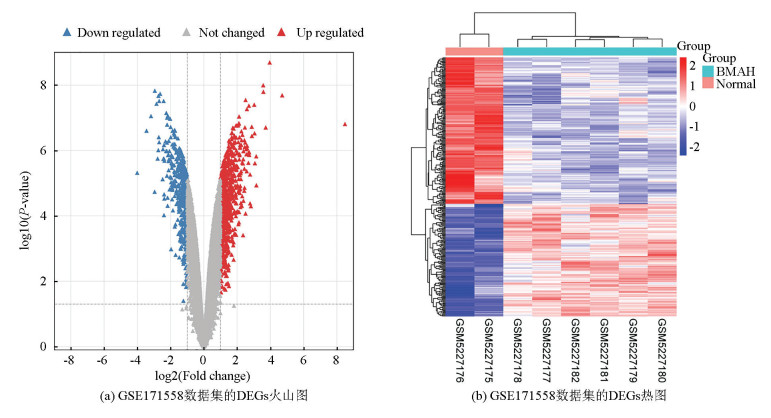
|
图 1 差异表达基因结果 Figure 1 Results of differentially expressed genes |
使用在线工具DAVID 6.8对选取的336个基因基于P < 0.05和富集基因计数≥5的纳入标准进行GO和KEGG富集分析,研究与BMAH相关的生物学功能。富集分析结果如图 2所示。GO富集分析(见图 2a)结果中,生物过程(BP)分析表明,这些基因与细胞粘附过程、细胞增殖的正调节过程、RNA加工过程、多细胞生物发育过程、细胞迁移的正向调节过程、轴突引导等过程有关。细胞成分(CC)与质膜、膜的组成部分、细胞外区、细胞外外泌体、细胞表面、神经元细胞体、轴突等密切相关,而分子功能(MF)分析则展示了与钙离子结合、肌动蛋白丝结合、钙调素结合、ATP结合、碳水化合物结合、跨膜受体蛋白酪氨酸激酶活性的相关性。KEGG富集分析(见图 2b)显示钙信号通路、PI3K-Akt信号通路、心肌细胞中的肾上腺素能信号传导、扩张型心肌病、cAMP信号通路、肥厚型心肌病、醛固酮合成和分泌、cGMP-PKG信号通路、ECM-受体相互作用、胰腺分泌物等富集明显。
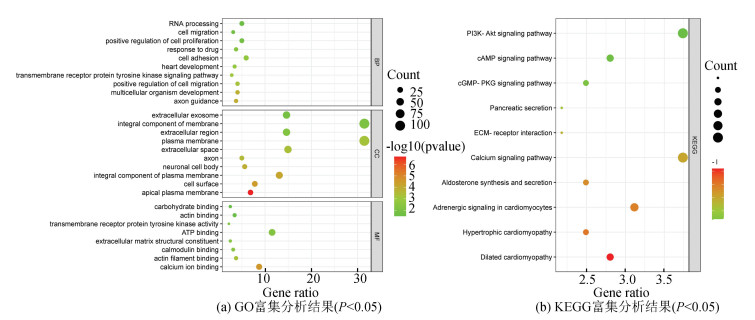
|
图 2 GO和KEGG富集分析结果(p < 0.05) Figure 2 Results of GO and KEGG enrichment analysis (p < 0.05) |
根据STRING在线数据库,基于网络的交互得分> 0.9,得到一个有297个节点和73条边的PPI网络(见图 3)。通过Cytoscape中的Cytohubba插件,采用MCC(见图 4a)、MNC(见图 4b)和Degree(见图 4c)三种算法分别筛选出前10个基因,并取交集(见图 4d),得到五个共同的关键基因,即三个上调基因多功能蛋白聚糖(Versican,VCAN)、小核糖核蛋白多肽E(Small nuclear ribonucleoprotein polypeptide E,SNRPE)、LSM3(LSM3同源物,U6小核RNA和mRNA降解相关)和两个下调基因双糖链蛋白聚糖(Biglycan,BGN)、蛋白磷酸酶2支架亚基Aalpha(Protein phosphatase 2 scaffold subunit Aalpha,PPP2R1A),视为BMAH的关键基因。
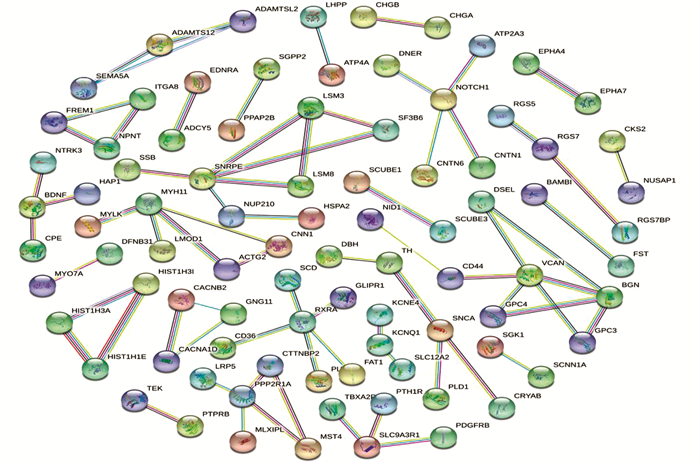
|
图 3 STRING在线数据库构建DEGs的PPI Figure 3 PPI of DEGs constructed from STRING online database 注: 节点即基因, 边为两个基因之间的连线. |
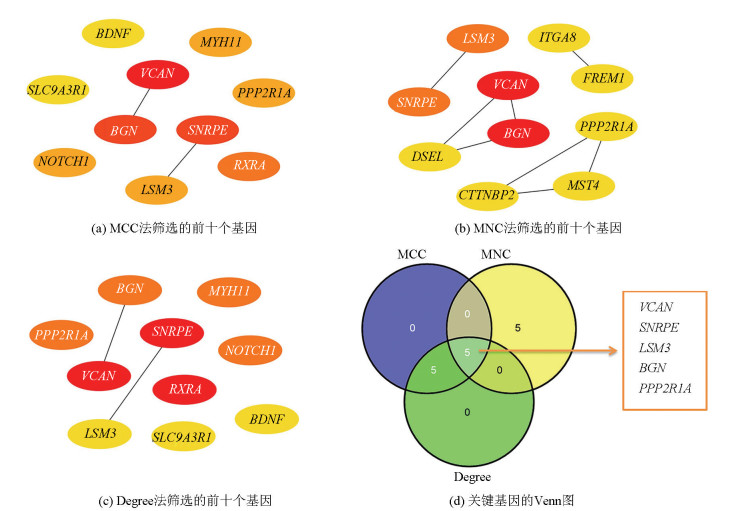
|
图 4 cytoHubba插件中三种拓扑分析方法筛选出的关键基因 Figure 4 Key genes screened by three topological analysis methods in the cytoHubba plugin |
在GSE25031数据集中获得关键基因在肾上腺结节与正常肾上腺组织中的表达量,并进行统计分析,结果显示SNRPE、PPP2R1A和LSM3在疾病与正常组中的表达量均无显著差异(p>0.05)。而VCAN和BGN在BMAH和对照组中表达量的差异有统计学意义(p < 0.05),可以认为与正常组相比,VCAN在BMAH中表达显著升高,BGN在BMAH中表达显著降低,故以VCAN和BGN作为BMAH的关键生物标志物(见图 5)。
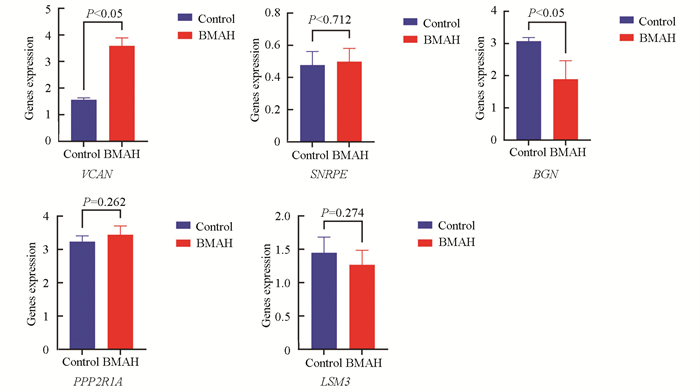
|
图 5 关键基因的验证 Figure 5 Validation of key genes |
对VCAN和BGN做进一步分析以更准确的了解其功能。GSEA结果显示,VCAN主要参与丁酸代谢、ECM-受体相互作用、半乳糖代谢、蛋白质消化吸收、类固醇生物合成、异体移植排斥、哮喘、移植物抗宿主病、系统性红斑狼疮、I型糖尿病(见图 6a)。BGN与ABC转运蛋白、蛋白质消化吸收、核糖体、剪接体、各种类型的N-聚糖生物合成、集合管酸分泌、皮质醇的合成和分泌、幽门螺杆菌感染中的上皮细胞信号传导、类固醇生物合成、血管内皮生长因子信号通路密切相关(见图 6b)。
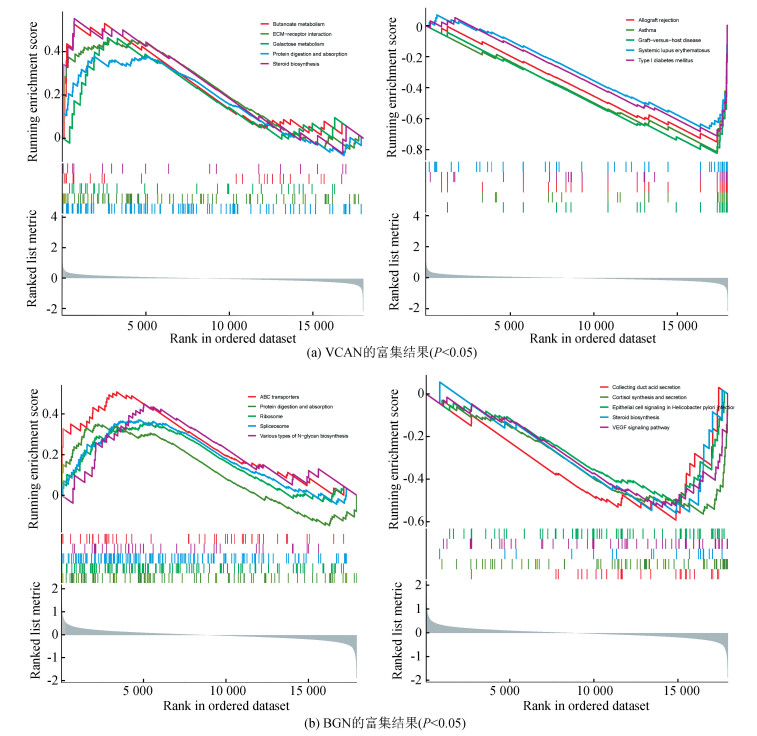
|
图 6 基因集富集分析 Figure 6 Gene set enrichment analysis |
TF-miRNA共调控网络显示了VCAN和BGN与TF基因和miRNA的相互作用(见图 7)。VCAN有16个TF基因和26个miRNA调控,BGN受SMAD4 TF基因和has-miR-647 miRNA的共同调控。此外,我们发现有16个化合物是这两个关键生物标志物相互作用的共同化合物(见图 8,表 1)。由于这些化合物是针对这两个关键生物标志物检测到的,因此它们与BMAH的发生和发展有重要联系。
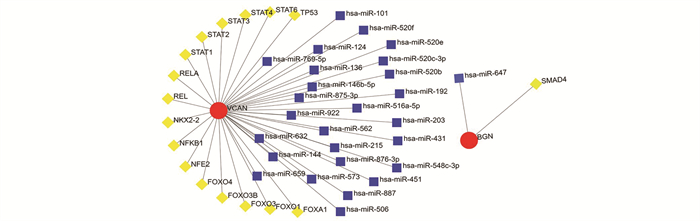
|
图 7 TF-miRNA相互作用的网络 Figure 7 network of TF-miRNAs interactions 注:红色节点表示hub基因,黄色节点代表TF基因,蓝色节点表示miRNA. |
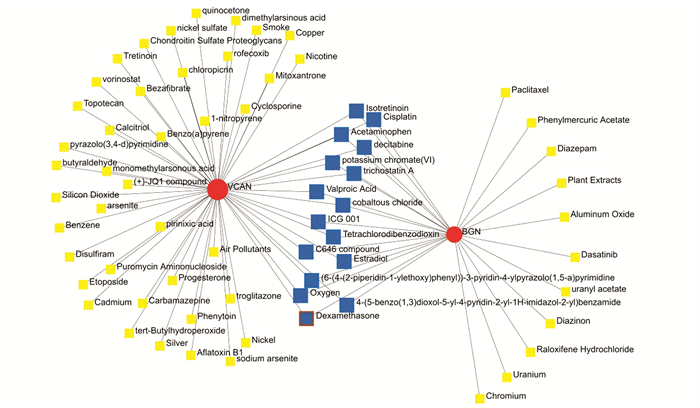
|
图 8 NetworkAnalyst的蛋白质-化学相互作用 Figure 8 Protein-chemical Interactions by NetworkAnalyst 注:红色节点表示hub基因,黄色节点代表相关的化合物,蓝色节点表示两个基因之间共同的化合物. |
| 表 1 关键生物标志物相互作用的前16种化合物 Table 1 Top 16 compounds with key biomarker interactions |
本研究共鉴定了336个DEGs,并进行生物信息学分析,探索家族性BMAH的分子生物学功能和途径,以找到影响BMAH发生发展的生物标志物。GO富集分析表明大部分DEGs主要与细胞粘附、细胞增殖、RNA加工过程、多细胞生物发育过程、细胞迁移过程、轴突引导等生物过程有关。因此做出推测,即这些基因可能通过这些过程在家族性BMAH中发挥关键作用。之前的研究表明,细胞增殖以及与细胞粘附相关的其他体细胞遗传事件也发生在各种结节中[15-16]。另一方面,本研究发现这336个靶基因大部分富集在钙信号通路、PI3K-Akt信号通路、心肌细胞中的肾上腺素能信号传导、扩张型心肌病、肥厚型心肌病、cAMP信号通路、醛固酮合成和分泌、cGMP-PKG信号通路等相关信号通路中。最近有研究表明环磷酸腺苷单磷酸蛋白(cAMP)激酶A信号传导,被发现在库欣综合征的良性肾上腺皮质肿瘤或增生的发展中起主要作用[17-18],而且改变细胞内钙信号传导与良性醛固酮产生肿瘤或增生的发展也有关[19]。然而,在双侧肾上腺皮质增生患者中,双侧肾上腺切除术可诱发明确的肾上腺皮质功能不全,有研究发现肾上腺功能不全也会使患者因心血管疾病和感染而增加发病率和死亡率[20-21]。也有研究表明接受肾上腺切除术的亚临床CS患者改善了心血管危险因素,尤其是高血压和糖尿病[22]。此外,特发性双侧肾上腺皮质增生是原发性醛固酮增多症的最常见原因[23],可见醛固酮合成和分泌与家族性BMAH也存在密切联系。另外,PI3K-Akt信号通路和cGMP-PKG信号通路目前没有相关研究表明其与BMAH的发生有关,因此需要做进一步研究,这可能是一种新的临床机制。
此外,对DEGs进行了PPI网络分析,确定了5个hub基因(VCAN、SNRPE、BGN、PPP2R1A和LSM3),并经GSE25031数据集验证,最终将基因表达差异具有统计学意义的VCAN和BGN视为家族性BMAH的潜在生物标志物,有研究也使用了与本文相同的数据集,因此本研究的结果具有一定的可靠性[24]。多功能蛋白聚糖(Versican,VCAN)是一种大型聚集的硫酸软骨素蛋白多糖,属于聚集蛋白聚糖/versican蛋白多糖家族,是细胞外基质的重要组成部分[25],参与细胞粘附、增殖、迁移、血管生成和组织形态发生和维持[26-28]。VCAN已被证明具有促进肿瘤发展的潜力[29-30],其能够激活EGFR-PI3K-AKT途径促进肝细胞癌的增殖和转移[31],参与骨髓瘤发病机制[32],也能够激活NF-kB信号通路促进卵巢癌细胞的迁移和侵袭[33],与许多不同类型癌症的不良结局密切相关[34]。这与我们研究所得结果类似,即VCAN的高表达与BMAH的发生呈正相关。进一步的GSEA结果分析显示,VCAN主要与丁酸代谢、ECM-受体相互作用、半乳糖代谢、蛋白质消化吸收和类固醇生物合成等有关。然而目前没有关于丁酸、半乳糖代谢和ECM-受体相互作用与BMAH的相关报道,这些途径可能是治疗BMAH新的潜在机制,可作进一步研究。但有研究指出调节类固醇的分泌与BMAH的发生发展密不可分,类固醇生物合成降低是原发性双侧大结节性肾上腺皮质增生症的一大特征[35]。此外,在几个AIMAH家族病例中,特定的异常激素受体在受影响成员的肾上腺中起作用,而一种或几种G蛋白偶联受体的异常肾上腺表达和功能可导致细胞增殖和类固醇生成的异常调节[15]。在本研究中VCAN的高表达会增加类固醇的分泌,由此可推测出抑制VCAN的表达能够减少类固醇的分泌,从而参与疾病的治疗。总之,VCAN参与多种致癌作用机制,因此,可进一步研究其在家族性BMAH中的可能机制。
双糖链蛋白聚糖(Biglycan,BGN)是一种I类分子的富含亮氨酸的小蛋白聚糖(SLRP),在软骨和骨骼中都存在,在维持结构和体内平衡方面发挥着重要作用[36]。BGN在肿瘤的生物发生和发展中也发挥重要作用,并且在各种癌症中发现了BGN的异常表达[37]。之前的研究发现BGN在人平滑肌肉瘤细胞系SK-UT-1中的表达与cAMP依赖性及蛋白激酶A介导有关[38]。除此之外,也发现细胞内cAMP水平升高会增加骨细胞中BGN启动子的转录,并首次暗示cAMP/蛋白激酶A信号转导通路参与BGN基因表达的调节[39]。而异常的cAMP/蛋白激酶A信号传导在肿瘤发生中起核心作用,其是肾上腺皮质皮质中皮质醇分泌的主要激活因子,与库欣综合征和肾上腺皮质肿瘤密切相关[40],可见,BGN在AIMAH的发病机制中发挥重要的作用。GSEA结果分析显示,BGN还与ABC转运蛋白、蛋白质消化吸收、核糖体、剪接体、各种类型的N-聚糖生物合成、皮质醇的合成和分泌、类固醇生物合成和血管内皮生长因子信号通路等密切相关。BMAH的发生与皮质醇的分泌有着更加密切的联系,皮质醇合成抑制剂能够参与该疾病的治疗[41]。另外,剪接体能够引导真核细胞中的前mRNA剪接,而之前有研究表明,剪接体可能构成了癌症中有吸引力的治疗靶点[42]。总之,BGN在家族性BMAH的发病机制中发挥重要的作用。
4 结论综上所述,本研究采用生物信息学方法对数据集进行分析,在家族性BMAH和正常组之间筛选出336个DEGs,进一步筛选出5个关键基因并进行验证,最终确定了VCAN和BGN基因的表达水平在BMAH和正常组之间存在显著差异,以此鉴定为家族性双侧大结节性肾上腺皮质增生症的潜在生物标志物,为临床诊断和治疗提供参考。但本研究存在一定局限性,即目前尚无相关实验研究这些基因在家族性BMAH中的具体作用机制。因此,需要通过实验进一步阐明这些基因在家族性BMAH中的功能作用。
| [1] |
HATIPOGLU B. Cushing's syndrome[J]. Journal of Surgical Oncology, 2012, 106(5): 565-571. DOI:10.1002/jso.23197 (  0) 0) |
| [2] |
FEELDERS R, PULGAR S, KEMPEL A, et al. The burden of Cushing's disease: Clinical and health-related quality of life aspects[J]. European Journal of Endocrinology, 2012, 167(3): 311-326. DOI:10.1530/EJE-11-1095 (  0) 0) |
| [3] |
FINDLING J, RAFF H. Cushing's Syndrome: Important issues in diagnosis and management[J]. The Journal of Clinical Endocrinology and Metabolism, 2006, 91(10): 3746-3753. DOI:10.1210/jc.2006-0997 (  0) 0) |
| [4] |
KIRSCHNER M, POWELL R, LIPSETT M. Cushing's syndrome: Nodular cortical hyperplasia of adrenal glands with clinical and pathological reatures suggesting adrenocortical tumor[J]. The Journal of Clinical Endocrinology and Metabolism, 1964, 24: 947-955. DOI:10.1210/jcem-24-10-947 (  0) 0) |
| [5] |
VERMA A, MOHAN S, GUPTA A. ACTH-independent macronodular adrenal hyperplasia: Imaging findings of a rare condition : A case report[J]. Abdominal Imaging, 2008, 33(2): 225-229. DOI:10.1007/s00261-007-9236-y (  0) 0) |
| [6] |
ZHOU Jingya, ZHANG Meng, BAI Xue, et al. Demographic characteristics, etiology, and comorbidities of patients with cushing's syndrome: A 10-Year retrospective study at a large general hospital in China[J]. International Journal of Endocrinology, 2019, 2019: 7159696. DOI:10.1155/2019/7159696 (  0) 0) |
| [7] |
LEE S, HWANG R, LEE J, et al. Ectopic expression of vasopressin V1b and V2 receptors in the adrenal glands of familial ACTH-independent macronodular adrenal hyperplasia[J]. Clinical Endocrinology, 2005, 63(6): 625-630. DOI:10.1111/j.1365-2265.2005.02387.x (  0) 0) |
| [8] |
ESPIARD S, DROUGAT L, LIBÉ R, et al. ARMC5 mutations in a large cohort of primary macronodular adrenal hyperplasia: Clinical and functional consequences[J]. The Journal of Clinical Endocrinology and Metabolism, 2015, 100(6): E926-E935. DOI:10.1210/jc.2014-4204 (  0) 0) |
| [9] |
DE VENANZI A, ALENCAR G, BOURDEAU I, et al. Primary bilateral macronodular adrenal hyperplasia[J]. Current Opinion in Endocrinology, Diabetes, and Obesity, 2014, 21(3): 177-184. DOI:10.1097/MED.0000000000000061 (  0) 0) |
| [10] |
CHEVALIER B, VANTYGHEM M C, ESPIARD S. Bilateral adrenal hyperplasia: Pathogenesis and treatment[J]. Biomedicines, 2021, 9(10): 1397. DOI:10.3390/biomedicines9101397 (  0) 0) |
| [11] |
RITCHIE M, PHIPSON B, WU D, et al. limma powers differential expression analyses for RNA-sequencing and microarray studies[J]. Nucleic Acids Research, 2015, 43(7): e47. DOI:10.1093/nar/gkv007 (  0) 0) |
| [12] |
ASHBURNER M, BALL C, BLAKE J, et al. Gene ontology: Tool for the unification of biology[J]. Nature Genetics, 2000, 25(1): 25-29. DOI:10.1038/75556 (  0) 0) |
| [13] |
KANEHISA M, GOTO S. KEGG: Kyoto encyclopedia of genes and genomes[J]. Nucleic Acids Research, 2000, 28(1): 27-30. DOI:10.1093/nar/28.1.27 (  0) 0) |
| [14] |
ZHOU G, SOUFAN O, EWALD J, et al. Network analyst 3.0: A visual analytics platform for comprehensive gene expression profiling and meta-analysis[J]. Nucleic Acids Research, 2019, 47(W1): W234-W241. DOI:10.1093/nar/gkz240 (  0) 0) |
| [15] |
LACROIX A. ACTH-independent macronodular adrenal hyperplasia[J]. Clinical Endocrinology & Metabolism, 2009, 23(2): 245-259. DOI:10.1016/j.beem.2008.10.011 (  0) 0) |
| [16] |
VOUILLARMET J, FERNANDES-ROSA F, GRAEPPI-DULAC J, et al. Aldosterone-producing adenoma with a somatic KCNJ5 mutation revealing APC-dependent familial adenomatous polyposis[J]. The Journal of Clinical Endocrinology and Metabolism, 2016, 101(11): 3874-3878. DOI:10.1210/jc.2016-1874 (  0) 0) |
| [17] |
METE O, DUAN K. The many faces of primary aldosteronism and cushing syndrome: A reflection of adrenocortical tumor heterogeneity[J]. Frontiers in Medicine, 2018, 5: 54. DOI:10.3389/fmed.2018.00054 (  0) 0) |
| [18] |
KAMILARIS C, STRATAKIS C, HANNAH-SHMOUNI F. Molecular genetic and genomic alterations in cushing's syndrome and primary aldosteronism[J]. Frontiers in Endocrinology, 2021, 12: 632543. DOI:10.3389/fendo.2021.632543 (  0) 0) |
| [19] |
KAMILARIS C, HANNAH-SHMOUNI F, STRATAKIS C. Adrenocortical tumorigenesis: Lessons from genetics[J]. Best Practice & Research Clinical Endocrinology & Metabolism, 2020, 34(3): 101428. DOI:10.1016/j.beem.2020.101428 (  0) 0) |
| [20] |
NGAOSUWAN K, JOHNSTON D, GODSLAND I, et al. Cardiovascular disease in patients with primary and secondary adrenal insufficiency and the role of comorbidities[J]. The Journal of Clinical Endocrinology & Metabolism, 2021, 106(5): 1284-1293. DOI:10.1210/clinem/dgab063 (  0) 0) |
| [21] |
TRESOLDI A, SUMILO D, PERRINS M, et al. Increased infection risk in addison's disease and congenital adrenal hyperplasia[J]. The Journal of Clinical Endocrinology and Metabolism, 2020, 105(2): 418-429. DOI:10.1210/clinem/dgz006 (  0) 0) |
| [22] |
BANCOS I, ALAHDAB F, CROWLEY R, et al. Thrapy of endocrine disease: Improvement of cardiovascular risk factors after adrenalectomy in patients with adrenal tumors and subclinical Cushing's syndrome: A systematic review and meta-analysis[J]. European Journal of Endocrinology, 2016, 175(6): R283-R295. DOI:10.1530/EJE-16-0465 (  0) 0) |
| [23] |
BOURDEAU I, PARISIEN-LA SALLE S, LACROIX A. Adrenocortical hyperplasia: A multifaceted disease[J]. Best Practice & Research Clinical Endocrinology & Metabolism, 2020, 34(3): 101386. DOI:10.1016/j.beem.2020.101386 (  0) 0) |
| [24] |
LI Junwu, WANG Yunhui, LI Qinke, et al. Exploration of core genes in ACTH-Independent macronodular adrenal hyperplasia[J]. Hormone and Metabolic Research, 2022, 54(5): 288-293. DOI:10.1055/a-1804-6047 (  0) 0) |
| [25] |
EDWARDS I J. Proteoglycans in prostate cancer[J]. Nature Reviews. Urology, 2012, 9(4): 196-206. DOI:10.1038/nrurol.2012.19 (  0) 0) |
| [26] |
ZHANG Yihong, ZOU Xiuqun, QIAN Wenli, et al. Enhanced PAPSS2/VCAN sulfation axis is essential for Snail-mediated breast cancer cell migration and metastasis[J]. Cell Death and Differentiation, 2019, 26(3): 565-579. DOI:10.1038/s41418-018-0147-y (  0) 0) |
| [27] |
SALEM M, O'BRIEN J, BERNAUDO S, et al. miR-590-3p promotes ovarian cancer growth and metastasis via a novel FOXA2-Versican pathway[J]. Cancer Research, 2018, 78(15): 4175-4190. DOI:10.1158/0008-5472.CAN-17-3014 (  0) 0) |
| [28] |
JIANG Kaiyuan, LIU Hongmei, XIE Dongyi, et al. Differentially expressed genes ASPN, COL1A1, FN1, VCAN and MUC5AC are potential prognostic biomarkers for gastric cancer[J]. Oncology letters, 2019, 17(3): 3191-3202. DOI:10.3892/ol.2019.9952 (  0) 0) |
| [29] |
FUJⅡ K, KARPOVA M, ASAGOE K, et al. Versican upregulation in Sézary cells alters growth, motility and resistance to chemotherapy[J]. Leukemia, 2015, 29(10): 2024-2032. DOI:10.1038/leu.2015.103 (  0) 0) |
| [30] |
ZHENG P, WEN J, ANG L, et al. Versican/PG-M G3 domain promotes tumor growth and angiogenesis[J]. FASEB Journal : Official Publication of the Federation of American Societies for Experimental Biology, 2004, 18(6): 754-756. DOI:10.1096/fj.03-0545fje (  0) 0) |
| [31] |
ZHANGYUAN G, WANG F, ZHANG H, et al. VersicanV1 promotes proliferation and metastasis of hepatocellular carcinoma through the activation of EGFR-PI3K-AKT pathway[J]. Oncogene, 2020, 39(6): 1213-1230. DOI:10.1038/s41388-019-1052-7 (  0) 0) |
| [32] |
GUPTA N, KUMAR R, SHARMA A. Inhibition of miR-144/199 promote myeloma pathogenesis via upregulation of versican and FAK/STAT3 signaling[J]. Molecular and Cellular Biochemistry, 2021, 476(6): 2551-2559. DOI:10.1007/s11010-020-04038-5 (  0) 0) |
| [33] |
YEUNG T, LEUNG C, WONG K, et al. TGF-β modulates ovarian cancer invasion by upregulating CAF-derived versican in the tumor microenvironment[J]. Cancer Research, 2013, 73(16): 5016-5028. DOI:10.1158/0008-5472.CAN-13-0023 (  0) 0) |
| [34] |
RICCIARDELLI C, SAKKO A, WEEN P, et al. The biological role and regulation of versican levels in cancer[J]. Cancer Metastasis Reviews, 2009, 28(1-2): 233-245. DOI:10.1007/s10555-009-9182-y (  0) 0) |
| [35] |
VASSILIADI D, TSAGARAKIS S. Diagnosis and management of primary bilateral macronodular adrenal hyperplasia[J]. Endocrine-related Cancer, 2019, 26(10): R567-R581. DOI:10.1530/ERC-19-0240 (  0) 0) |
| [36] |
MIGUEZ P. Evidence of biglycan structure-function in bone homeostasis and aging[J]. Connective Tissue Research, 2020, 61(1): 19-33. DOI:10.1080/03008207.2019.1669577 (  0) 0) |
| [37] |
ZHAO Longzhu, LIANG Jiusi, ZHONG Wen, et al. Expression and prognostic analysis of BGN in head and neck squamous cell carcinoma[J]. Gene, 2022, 827: 146461. DOI:10.1016/j.gene.2022.146461 (  0) 0) |
| [38] |
UNGEFROREN H, GELLERSEN B, KRULL N, et al. Biglycan gene expression in the human leiomyosarcoma cell line SK-UT-1. Basal and protein kinase A-induced transcription involves binding of Sp1-like/Sp3 proteins in the proximal promoter region[J]. The Journal of Biological Chemistry, 1998, 273(44): 29230-29240. DOI:10.1074/jbc.273.44.29230 (  0) 0) |
| [39] |
UNGEFROREN H, CIKÓS T, KRULL N, et al. Biglycan gene promoter activity in osteosarcoma cells is regulated by cyclic AMP[J]. Biochemical and Biophysical Research Communications, 1997, 235(2): 413-417. DOI:10.1006/bbrc.1997.6801 (  0) 0) |
| [40] |
LODISH M, STRATAKIS C. A genetic and molecular update on adrenocortical causes of Cushing syndrome[J]. Nature Reviews Endocrinology, 2016, 12(5): 255-262. DOI:10.1038/nrendo.2016.24 (  0) 0) |
| [41] |
BOUYS L, CHIODINI I, ARLT W, et al. Update on primary bilateral macronodular adrenal hyperplasia (PBMAH)[J]. Endocrine, 2021, 71(3): 595-603. DOI:10.1007/s12020-021-02645-w (  0) 0) |
| [42] |
QUIDVILLE V, ALSAFADI S, GOUBAR A, et al. Targeting the deregulated spliceosome core machinery in cancer cells triggers mTOR blockade and autophagy[J]. Cancer Research, 2013, 73(7): 2247-2258. DOI:10.1158/0008-5472.CAN-12-2501 (  0) 0) |
 2023, Vol. 21
2023, Vol. 21


