2. 武汉大学 护理学院,武汉 430000
2. School of Nursing, Wuhan University, Wuhan 430000, China
抑郁是一种情绪障碍,以心理愉悦感消失、情绪低落超过2个星期、明显躯体不适和功能缺陷为特征,临床表现为失眠、意志减退、食欲异常、精神颓废等,严重者有自杀倾向[1]。世界卫生组织(WHO)表示,截至2017年,全球患有抑郁症的人数约为3.22亿,而2005—2015这十年间,抑郁症的患病率提升了18.4%[2]。目前,临床上大部分抗抑郁药治疗周期长,有严重的副反应,且费用高昂,给抑郁症患者及家庭造成了巨大的压力[3]。因此,研究分子机制及靶点,研制出安全且高效的药物对抑郁症的治疗极为重要。
槲皮素(3,3’,4’,5,7-五羟基黄酮)是一种普遍存在于人类膳食中的类黄酮物质[4]。广泛存在于桑树、山茶花、菖蒲、辣木、金丝桃、葱、苜蓿、刺槐、葡萄和银杏叶中[5]。槲皮素具有许多生物活性,例如抗氧化剂、抗炎、神经保护和脑保护等[6]。一项膳食类黄酮摄入量与认知功能的队列表明,较高的类黄酮膳食摄入量可能与成年个体更好的认知健康有关,并且在单个多酚中,只有槲皮素与认知健康相关[7]。FANG Ke等[8]发现,槲皮素可以缓解大鼠腹膜内注射脂多糖(LPS)诱导的抑郁症。Samad等[9]也证明,槲皮素可以防止压力引起的焦虑和抑郁样行为,并改善雄性小鼠的记忆力。但截至目前,槲皮素改善抑郁的具体作用机制并未得到充分解释。
网络药理学是一门从系统生物学和网络生物学中衍生而来的新学科[10]。建立成分、靶点、疾病间的生物网络关系是其常用方法,以研究药物对机体的整体影响以及具体作用机制。本文拟采用网络药理学及分子对接技术,探讨槲皮素对抑郁的作用机制,为临床应用提供依据,以期开发出新的药物用于抑郁症的治疗。
1 资料与方法 1.1 药物靶点的收集在Pubchem (https://pubchem.ncbi.nlm.nih.gov/)数据库中收集槲皮素(Quercetin)名称、结构等相关信息,下载其二维结构并以SDF格式储存。将该文件导入SwissTargetPrediction(http://www.swisstargetprediction.ch/)平台草图绘制器,蛋白质靶标种类选择“智人”,对靶点进行预测。SwissTargetPrediction平台可以鉴定具有与查询分子高度相似的已知配体的蛋白质,进而预测分子的靶标。进行预测时,3D相似性值的阈值设置为0.75,2D相似性值的阈值设置为0.45[11]。低于这些阈值,配体与查询分子的相似性非常低,不显示在结果中。接下来在Superpred(https://prediction.charite.de/)数据库中收集槲皮素的靶点。Superpred生物物种默认为“智人”,置信度为大于等于0.7,采用逻辑回归机器学习模型对靶点进行预测。将收集到的靶点置于同一Excel文档中,进行去重整合,校正为人源靶点。
1.2 疾病靶点收集以“Depression”为关键词,分别在OMIM(https://omim.org)和Genecards(http://Genecards.org)两个数据库中获取抑郁疾病靶点信息。在OMIM中选择具有已知序列的基因进行搜索。在Genecards中,若靶点数目过多,则以大于等于“Relevance score”的2倍中位数为筛选条件。将靶点信息置于同一Excel文档中,整合抑郁相关靶点。
1.3 蛋白质互作网络(PPI)构建及核心靶点筛选通过Jvenn(http://jvenn.toulouse.inra.fr/app/index.html) 对槲皮素和抑郁靶点求交集,获得槲皮素-抑郁的共同靶点,以CSV文件形式导出。将交集靶点文件上传至STRING平台(https://cn.string-db.org/)进行PPI构建,蛋白质类型设置为智人,置信度设置为中等(0.400)。再将该网络数据导入到Cytoscape3.9.1应用软件,并使用CytoHubba插件中的MCC算法筛选出度值排行前10的基因为hub基因。CytoHubba插件是基于应用程序编程接口在Java中实现的。PPI网络中每个节点定义为v,度值定义为F(v)。MCC计算后的度值定义为
在David平台输入槲皮素-抑郁的共同靶点进行富集分析,物种选择“Homo sapiens”,最小基因数目为2,评分阈值<0.1。利用Excel软件计算并筛选富集分析中校正后P<0.05的项,并对GO生物过程、GO分子功能以及GO细胞成分分析的前15项进行可视化展示。KEGG通路按校正后P值大小排序,利用R软件,以图片形式对前15条通路进行展示。
1.5 分子对接在RCSB PDB(https://www.rcsb.org)下载度值前五的蛋白分子对应的复合体晶体结构,删除配体部分,去除水分子,利用Discovery Studio2019中Macromolecules/Prepare Protein/Clean Protein功能对蛋白分子进行预处理。接着利用LibDock依次进行分子对接,并需要LibDockScore以确定靶点蛋白与槲皮素之间的结合力,得分较高的组分被视为与槲皮素相互作用的活性组分。
2 结果 2.1 药物及疾病靶点的收集在SwissTargetPrediction数据库收集到100个槲皮素靶点,在Superpred数据库收集到111个靶点。取并集后共获得槲皮素人源靶点198个。在Genecards平台共查询到3 675个抑郁靶点,在OMIM平台共查询到188个靶点,去重合并后共获得疾病相关靶点3 718个。
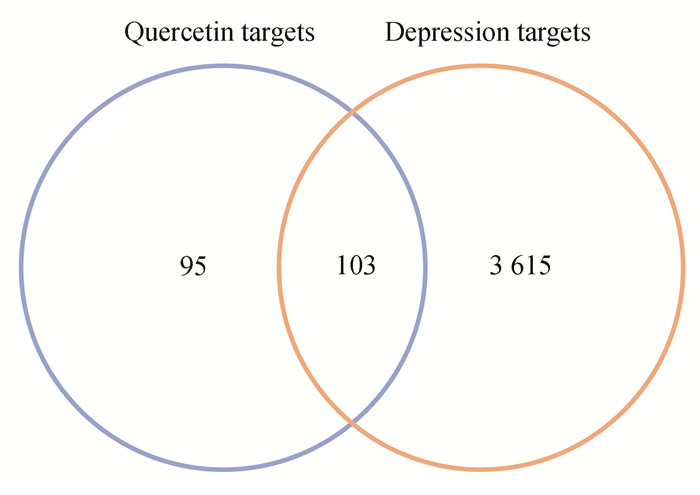
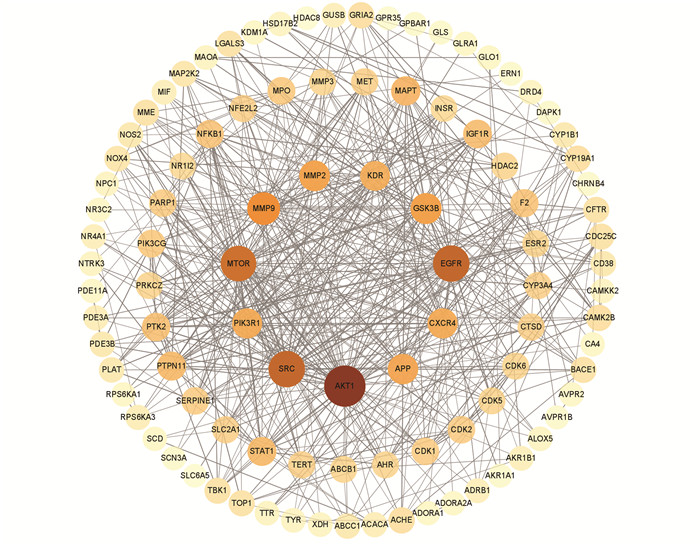
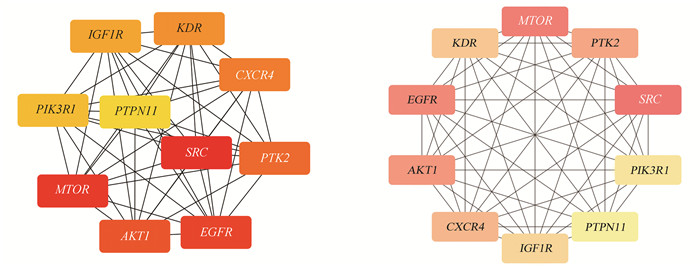
2.2 PPI网络以及核心靶点分析Jvenn中共获得103个槲皮素-抑郁共同靶点,用韦恩图表示(见图 1)。利用STRING平台绘制槲皮素和抑郁交集靶点的PPI网络图,包括103个节点,536条边。将其结果信息上传至Cytoscape3.9.1软件进行简化(见图 2)。经MCC算法计算后, 度值排名前10的hub基因依次为: SRC、MTOR、EGFR、AKT1、PTK2、CXCR4、KDR、IGF-1R、PIK3R1、PTPN11。依据MCC分数对hub基因进行可视化(见图 3),颜色由红转黄,MCC得分越高,其基因颜色越趋近于红色。
|
图 1 槲皮素靶点与抑郁靶点的Venny图 Figure 1 Venny diagram of quercetin targets and depression targets |
|
图 2 槲皮素和抑郁共同靶点的PPI网络图 Figure 2 PPI network diagram of common targets of quercetin and depression |
|
图 3 排名前10的hub基因 Figure 3 Top 10 hub genes |
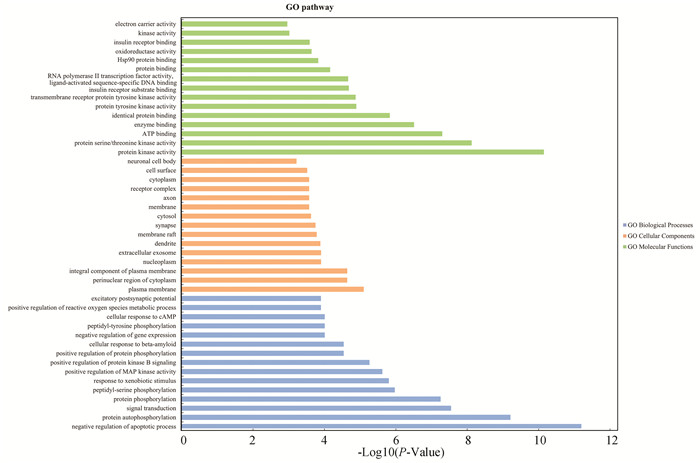
应用David平台进行GO、KEGG富集分析。GO是基因本体(Gene ontology)的简称,用于注释与其相关的生物功能、通路、以及其他的基因产品。经校正后P<0.05的富集条目筛选,获得了162条GO富集分析结果,其中包含88项生物过程条目,40项细胞成分条目,34项分子功能条目。图 4展示了各部分校正后P值最高的15条通路。各个部分颜色不同。横向坐标代表校正后的P值,校正后P值越高,说明基因在通路富集程度越大。其中,最具有代表性的是生物进程条目,涉及凋亡过程的负向调节(Negative regulation of apoptotic process)、信号转导(Signal transduction)和蛋白质磷酸化(Protein phosphorylation)等生物学过程。
|
图 4 槲皮素作用靶点的GO富集分析 Figure 4 GO enrichment analysis of quercetin targets |
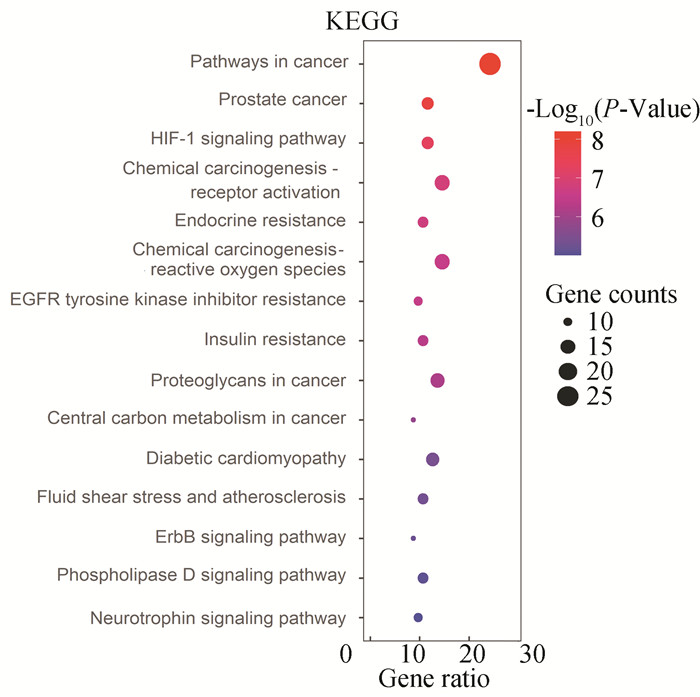
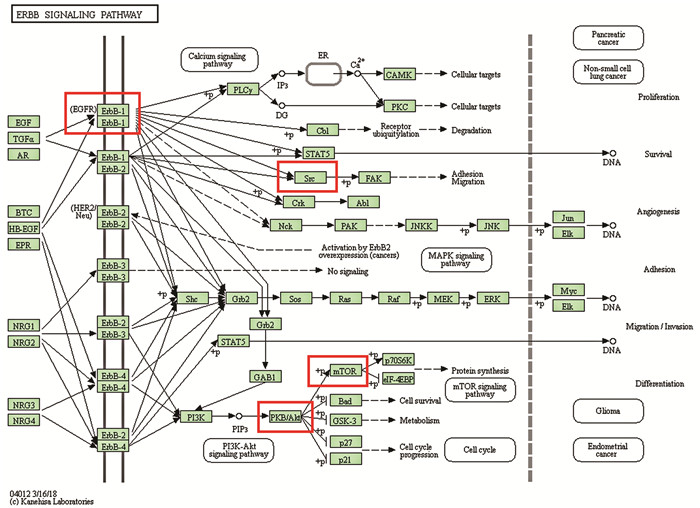
经校正P<0.05筛选后,共得到107条KEGG信号通路结果。校正后P值排名前15的通路结果如图 5所示,主要有:缺氧诱导因子-1信号通路(HIF-1 signaling pathway)、ErbB信号通路(ErbB signaling pathway)、磷脂酶D信号通路(Phospholipase D signaling pathway)、神经营养素信号通路(Neurotrophin signaling pathway)等。横轴表示Gene ratio,表示KEGG通路中所含的基因数目占所有基因的百分比;纵坐标表示路径名称;气泡大小代表着富集的基因数目;纵轴展示通路名称;气泡尺寸表示富集基因的数量,其大小与富集基因数呈整正相关;以不同色彩代表P值,气泡颜色随P值依次渐变。其中,ErbB信号通路高度值hub基因富集程度最高,可能是最重要的信号通路(见图 6)。
|
图 5 槲皮素作用靶点的KEGG通路富集分析 Figure 5 KEGG pathway enrichment analysis of quercetin targets Molecular docking results |
|
图 6 ErbB信号通路图 Figure 6 ErbB signaling pathway map |
分子对接结果显示(见图 7),槲皮素与SRC、MTOR、EGFR、AKT1、PTK2分子对接LibDockSccore值依次为95.718 8、97.583 3、77.993 5、114.16、93.314 5,对接评分均较高,说明槲皮素与这些靶标具有良好的结合能力。

|
图 7 分子对接结果 Figure 7 Molecular docking results |
本研究的主要目的是探析槲皮素治疗抑郁的潜在机制。网络药理学结果表明,SRC、AKT1和mTOR可能是槲皮素改善抑郁症的关键作用靶点。以往研究表明,LPS注射可导致小鼠神经炎症和抑郁样行为。LPS注射组小鼠脑组织中SRC-1表达降低,提示SRC-1在炎症和抑郁中的作用[13]。pCREB影响海马突触可塑性和空间记忆功能,它的表达减少与阿尔茨海默症的学习和记忆受损有关。体外实验中,SRC-1敲低显著降低了pCREB表达水平[14]。神经炎症可以诱导神经元再生,使神经营养因子释放减少,导致神经活动失调,并有助于抑郁症的发展[15]。有研究证实,PI3K / Akt通路的激活诱导NF-κB的磷酸化,这导致大脑区域的神经炎症,并有助于啮齿动物抑郁样行为的发展[16]。PI3K / Akt / NF-κB通路也能在新生儿母体剥夺和慢性轻度应激的抑郁模型中被激活[17]。mTOR作为一种丝氨酸/苏氨酸激酶[18],可通过p70S6激酶的磷酸化和哺乳动物eIF4E结合蛋白(4EBP)的抑制来调节神经发生、树突状脊柱生长和蛋白质翻译启动,从而合成神经元突触所需的蛋白质[18-19]。这与目前抗抑郁药的作用机制一致,即通过促使神经突触再生,从而达到抗抑郁的目的。这些发现与我们的结果一致。因此我们推测槲皮素可能通过作用于SRC、AKT1和mTOR产生抗抑郁效应。
KEGG通路富集分析结果显示,槲皮素治疗抑郁可能与HIF-1信号通路、ErbB信号通路等多条通路密切相关。HIF-1是一种由α、β两种亚基构成的转录因子,能对缺氧作出反应。已有研究表明,HIF-1通路激活的显着增加导致脑源性神经营养因子(BDNF)的持续表达[20]。BDNF广泛存在于中枢神经系统,在海马、皮质中大量表达,并参与神经元功能的维持、发育以及神经元受损后的修复,从而产生抗抑郁药样效应[21]。以上结果提示激活HIF-1信号传导可在槲皮素治疗抑郁中发挥重要作用。神经调节素-1(NRG1)是精神分裂症,双相情感障碍等多种精神疾病的易感基因,对皮质神经元、运动神经元、多巴胺能神经元、耳蜗感觉神经元和PC12细胞具有神经保护作用[22]。NRG1相关通路的异常改变与抑郁症的发生密切相关。Bi等人发现,阻断NRG1-ErbB4信号传导增强了焦虑样行为[23]。NRG/ErbB信号传导改变后,转基因小鼠出现异常行为以及学习记忆缺陷。因此,综合既往文献及本研究结果,推测槲皮素可能通过调控HIF-1、NRG/ErbB等多条信号通路来维持神经元功能和发育,从而发产生抗抑郁效应。
目前已有研究仅说明槲皮素可改善抑郁样行为,并未对其具体机制进行研究。本研究利用网络药理学方法,发现了槲皮素治疗抑郁的潜在靶点及通路,为设计和开发新的有效抗抑郁药物奠定基础。但本研究也存在一定局限性。首先,研究所使用的数据库数据覆盖范围有限,不包含未经证实和未记录的化合物或靶标。其次,分子对接本质上属于计算机预测技术,无法完全代替动物实验。因此,研究结果需在动物模型中进行进一步验证。
4 结论研究以网络药理学方法为指导,利用分子对接技术,对槲皮素-抑郁的关键靶点进行验证,发现槲皮素对抑郁的作用主要涉及SRC、AKT1、mTOR等靶点,HIF-1、NRG/ErbB等信号通路,提示槲皮素的抗抑郁机制可能是促进神经突触再生、改善脑肠轴功能以维持神经系统正常功能。
| [1] |
徐云芳, 陈红梅, 吴永梅, 等. 老年高血压合并抑郁患者动脉硬化指数及颈动脉内膜中层厚度与抑郁程度的相关性[J]. 中华保健医学杂志, 2022, 24(2): 91-94. XU yunfang, CHEN hongmei, WU yongmei, et al. Correlation between arteriosclerosis index, carotid intima-media thickness and depression in elderly patients with hypertension complicated with depression[J]. Chinese Journal of Health Care and Medicine, 2022, 24(2): 91-94. DOI:10.3969/j.issn.1674-3245.2022.02.003 (  0) 0) |
| [2] |
SHI Lei, LI Guoqiang, HAO Jiatong, et al. Psychological depletion in physicians and nurses exposed to workplace violence: A cross-sectional study using propensity score analysis[J]. International Journal of Nursing Studies, 2020, 103: 103493. DOI:10.1016/j.ijnurstu.2019.103493 (  0) 0) |
| [3] |
GUAN Yuechen, WANG Junming, WU Xiaohui, et al. Quercetin reverses chronic unpredictable mild stress-induced depression-like behavior in vivo by involving nuclear factor-E2-related factor 2[J]. Brain Research, 2021, 1772: 147661. DOI:10.1016/j.brainres.2021.147661 (  0) 0) |
| [4] |
BABAEI F, MIRZABABAEI M, NASSIRI-ASL M. Quercetin in food: Possible mechanisms of its effect on memory[J]. Journal of Food Science, 2018, 83(9): 2280-2287. DOI:10.1111/1750-3841.14317 (  0) 0) |
| [5] |
LI Yao, YAO Jiaying, HAN Chunyan, et al. Quercetin, Inflammation and Immunity[J]. Nutrients, 2016, 8(3): 167. DOI:10.3390/nu8030167 (  0) 0) |
| [6] |
SHEN Pan, LIN Weiji, DENG Xuan, et al. Potential implications of quercetin in autoimmune diseases[J]. Frontiers in Immunology, 2021, 12: 689044. DOI:10.3389/fimmu.2021.689044 (  0) 0) |
| [7] |
GODOS J, CARACI F, CASTELLANO S, et al. Association between dietary flavonoids intake and cognitive function in an italian cohort[J]. Biomolecules, 2020, 10(9): 1300. DOI:10.3390/biom10091300 (  0) 0) |
| [8] |
FANG Ke, LI Huarong, CHEN Xingxing, et al. Quercetin alleviates LPS-Induced depression-like behavior in rats via regulating BDNF-Related imbalance of copine 6 and TREM1/2 in the hippocampus and PFC[J]. Frontiers in Pharmacology, 2019, 10: 1544. DOI:10.3389/fphar.2019.01544 (  0) 0) |
| [9] |
SAMAD N, SALEEM A, YASMIN F, et al. Quercetin protects against stress-induced anxiety-and depression-like behavior and improves memory in male mice[J]. Physiological Research, 2018, 67(5): 795-808. DOI:10.33549/physiolres.933776 (  0) 0) |
| [10] |
刘若凡, 黄幸, 仪凡, 等. 基于网络药理学脑血疏口服液对脑出血继发脑损伤影响的作用机制研究[J]. 现代中西医结合杂志, 2021, 30(30): 3366-3371. LIU Ruofan, HUANG Xing, YI Fan, et al. The effect of naoxeshu oral liquid on secondary brain injury caused by cerebral hemorrhage based on network pharmacology study on the mechanism of influence[J]. Modern Journal of Integrated Traditional Chinese and Western Medicine, 2021, 30(30): 3366-3371. DOI:10.3969/j.issn.1008-8849.2021.30.012 (  0) 0) |
| [11] |
GFELLER D, GROSDIDIER A, WIRTH M, et al. SwissTargetPrediction: A web server for target prediction of bioactive small molecules[J]. Nucleic Acids Research, 2014, 42(Web Server issue): W32-W38. DOI:10.1093/nar/gku293 (  0) 0) |
| [12] |
CHIN C H, CHEN S H, WU H H, et al. CytoHubba: Identifying hub objects and sub-networks from complex interactome[J]. BMC Systems Biology, 2014, 8(Suppl 4): S11. DOI:10.1186/1752-0509-8-s4-s11 (  0) 0) |
| [13] |
WU Q, WANG B, NTIM M, et al. SRC-1 deficiency increases susceptibility of mice to depressive-like behavior after exposure to CUMS[J]. Neurochemical Research, 2021, 46(7): 1830-1843. DOI:10.1007/s11064-021-03316-y (  0) 0) |
| [14] |
BIAN Chen, HUANG Yan, ZHU Haitao, et al. Steroid receptor coactivator-1 knockdown decreases synaptic plasticity and impairs spatial memory in the hippocampus of mice[J]. Neuroscience, 2018, 377: 114-125. DOI:10.1016/j.neuroscience.2018.02.034 (  0) 0) |
| [15] |
BRITES D, FERNANDES A. Neuroinflammation and depression: Microglia activation, extracellular microvesicles and microRNA dysregulation[J]. Frontiers in Cellular Neuroscience, 2015, 9: 476. DOI:10.3389/fncel.2015.00476 (  0) 0) |
| [16] |
SUN Yan, ZHANG Hailou, WU Zhangjie, et al. Quercitrin rapidly alleviated depression-like behaviors in lipopolysaccharide-treated mice: The involvement of PI3K/AKT/NF-κB signaling suppression and CREB/BDNF signaling restoration in the hippocampus[J]. ACS Chemical Neuroscience, 2021, 12(18): 3387-3396. DOI:10.1021/acschemneuro.1c00371 (  0) 0) |
| [17] |
YE Yilu, YAO Siqi, WANG Rouxin, et al. PI3K/Akt/NF-κB signaling pathway regulates behaviors in adolescent female rats following with neonatal maternal deprivation and chronic mild stress[J]. Behavioural Brain Research, 2019, 362: 199-207. DOI:10.1016/j.bbr.2019.01.008 (  0) 0) |
| [18] |
PARK S W, LEE J G, SEO M K, et al. Differential effects of antidepressant drugs on mTOR signalling in rat hippocampal neurons[J]. International Journal of Neuropsychopharmacology, 2014, 17(11): 1831-1846. DOI:10.1017/s1461145714000534 (  0) 0) |
| [19] |
ZANOS P, GOULD T D. Mechanisms of ketamine action as an antidepressant[J]. Molecular Psychiatry, 2018, 23(4): 801-811. DOI:10.1038/mp.2017.255 (  0) 0) |
| [20] |
LI Gaifen, ZHAO Ming, CHENG Xiang, et al. FG-4592 improves depressive-like behaviors through HIF-1-Mediated neurogenesis and synapse plasticity in rats[J]. Neurotherapeutics, 2020, 17(2): 664-675. DOI:10.1007/s13311-019-00807-3 (  0) 0) |
| [21] |
赵迪克, 牛君, 杜志欣, 等. 基于cAMP/PKA-CREB-BDNF信号通路探讨柴胡加龙骨牡蛎汤抗抑郁的作用机制[J]. 中国实验方剂学杂志, 2023, 29(3): 17-25. ZHAO Dike, NIU Jun, DU Zhixin, et al. Exploring the antidepressant mechanism of Chaihu and Longgu Muli Decoction based on cAMP/PKA-CREB-BDNF signal pathway[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2023, 29(3): 17-25. (  0) 0) |
| [22] |
LIAO Dehua, GUO Yujin, XIANG Daxiong, et al. Dysregulation of neuregulin-1/ErbB signaling in the hippocampus of rats after administration of doxorubicin[J]. Drug Design Development and Therapy, 2018, 12: 231-239. DOI:10.2147/dddt.S151511 (  0) 0) |
| [23] |
BI Linlin, SUN Xiongdong, ZHANG Jie, et al. Amygdala NRG1-ErbB4 is critical for the modulation of anxiety-like behaviors[J]. Neuropsychopharmacology, 2015, 40(4): 974-86. DOI:10.1038/npp.2014.274 (  0) 0) |
 2023, Vol. 21
2023, Vol. 21


