干燥综合征(Sjogren's syndrome,SS) 是一种自身免疫性疾病,临床表现为腺体的功能障碍,出现唾液腺和泪腺分泌减少。在一般人群中,它的患病率在0.01%~0.1%之间,女性患病率则更高[1-2]。尽管目前认为遗传和环境因素等多种因素与SS有关,但SS的具体发病机制尚未完全阐明。
异常激活的炎症过程是自身免疫性疾病的基础,因此,炎症信号通路需要在转录和转录后水平进行严格的调控。最近的研究表明,长链非编码RNA (Long non-coding RNA,lncRNA) 能够在转录及转录后的水平调控炎症。lncRNA由200多个核苷酸组成,它们不会被翻译成蛋白质。lncRNA影响细胞和器官系统中的各种生物过程。多个研究揭示了lncRNA参与了免疫反应的调节[3-4],表明lncRNA在正常免疫系统中起着关键作用。而越来越多的证据也表明lncRNA的失调在自身免疫性疾病中起着重要作用,例如系统性红斑狼疮、类风湿关节炎[5-6]。
在病理学上,SS患者腺体通常显示大量免疫细胞细胞浸润,产生多种自身抗体和细胞因子。虽然B细胞和T细胞等免疫细胞因其主要存在于外分泌腺体而历来最受关注,但越来越多的证据表明SS中的免疫系统功能障碍也包含其他免疫系统的细胞的参与[7-11]。然而,迄今为止,lncRNA和SS腺体免疫细胞浸润之间的相关性对SS发病的影响还没有得到很好的研究。
本研究基于机器学习的方式,识别SS患者唇腺中的关键lncRNA以及其与唇腺组织中免疫细胞浸润的关系,并在SS患者全血中验证关键lncRNA表达情况及lncRNA与临床现状的相关性,为进一步深入了解SS的发病机制及SS的诊断和治疗提供新的方向。
1 资料与方法 1.1 资料获取从GEO数据库中以“Sjogren's syndrome”作为关键词检索,得到5个微阵列(Microarray)及3个高通量测序(RNA-seq)唇腺组织数据集,其中Microarray正常唇腺样本总数为33例,SS唇腺样本总数为43例;RNA-seq正常唇腺样本总数为36例,SS唇腺样本58例。得到2个SS患者全血数据集,其中GSE84844数据集包含了SS患者抗核抗体(Antinuclear antibody,ANA)、免疫球蛋白G(Immunoglobulin G,IgG)、SSA(Sjogren syndrome A antibody)、SSB(Sjogren syndrome B antibody)、疾病活动度指数(EULAR Sjögren's Syndrome Disease Activity Index, ESSDAI)等临床信息(见表 1)。
| 表 1 GEO数据库SS患者数据谱 Table 1 Data of SS patients in GEO database |
基于RStudio(V 1.4.1106)软件,通过Limma包、SVA包对5个Microarray唇腺组织数据集及3个RNA-seq进行合并和批次校正(以下分别简称为数据集A和数据集B),SVA包主要通过识别和估计实验中未知变异来源的替代变量以及使用ComBat函数直接去除已知的批处理效应。在Ensembl数据库中下载GTF文件,通过Perl (V 5.34)软件对合并后的数据,与GTF文件进行比对,根据比对结果对基因类型重注释以区分编码及长链非编码RNA,并提取lncRNA的表达谱。
1.3 差异lncRNA分析使用limma包对1.2步骤得到的两个数据集的lncRNA表达谱进行差异分析,取LogFC绝对值大于0.3,adjust P < 0.05,得到两个数据集的差异表达lncRNA的表达谱并绘制热图。
1.4 关键lncRNA的获取对1.3步骤得到的两个差异表达的lncRNA表达谱分别采用机器学习方法来进一步筛选关键基因。将数据分为测试集及训练集(1∶2)。使用R中的glmnet包,通过LASSO算法采取10折交叉验证对lncRNA表达谱进行筛选。然后,基于R的randomForest包,使用随机森林(RF)方法,其中ntree设置为1 000,Mtry设置为3,取MeanDecreaseGini排名前5的基因作为核心基因。将上述2种方法计算的结果取交集,得出共同交叉基因。通过UCSC Genome Browser获取基因结构。最后,在合并后的两个数据集中验证交叉基因在对照组和RA组中的差异表达情况,选择P < 0.05的核心基因进一步分析。
1.5 lncRNA在全血中表达及临床性状相关性分析基于RStudio(V 1.4.1106)软件,通过Limma包分析1.4步骤得到的lncRNA在两个SS全血数据集中差异表达情况。并采用斯皮尔曼相关性分析计算GSE84844数据集中lncRNA与ANA、SSA、SSB、ESSDAI等临床性状的相关性,以P < 0.05具有统计学差异,并通过ROCR包绘制lncRNA的ROC诊断曲线。
1.6 唇腺组织免疫浸润分析采用CIBERSORT软件[12]分析数据集A唇腺组织免疫细胞浸润的情况。CIBERSORT软件是通过对22个预先定义的不同的免疫细胞表达谱进行训练,用以区分不同的免疫细胞在组织免疫细胞中所占的百分比。使用Wilcoxon(秩和检验)计算SS组和正常之间不同免疫细胞浸润情况。以P < 0.05具有统计学差异。
1.7 免疫浸润细胞与lncRNA相关性分析对1.5步骤得到的lncRNA及唇腺组织免疫细胞浸润情况,采用斯皮尔曼相关性分析计算两者的相关性。以相关性绝对值大于0.4,P < 0.05具有统计学差异。
1.8 lncRNA与编码蛋白基因共表达及KEGG信号通路分析根据1.6步骤得到的与唇腺组织免疫细胞浸润具有相关性的lncRNA,通过R软件limma包,采用斯皮尔曼相关性分析计算与lncRNA在唇腺及全血中共表达的蛋白编码基因,以相关性绝对值大于0.4,P < 0.05具有统计学差异。随后,将目标lncRNA共表达的蛋白编码基因,通过kobas网站[13]进行KEGG信号通路分析,以P < 0.05具有统计学差异。
2 结果 2.1 数据合并及校正结果对数据集A和数据集B分别进行了合并以及批次校正。主成分分析显示,校正前数据集样本之间差异较大,对基因表达原始数据背景进行了矫正以及归一化处理后,数据处于随机分布状态,提示批次校正效果明显(见图 1)。
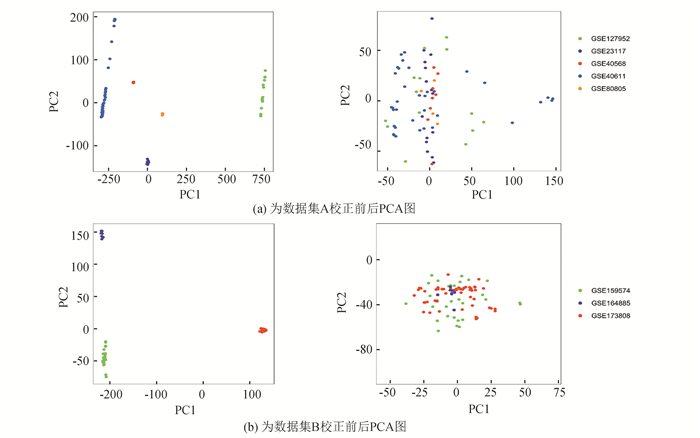
|
图 1 数据校正PCA图(左侧为校正前,右侧为校正后) Figure 1 Data correction PCA plot (left: before correction, right: after correction) |
差异分析结果显示,以LogFC绝对值大于0.3,adjust P < 0.05为条件,数据集A和数据集B均有7个差异表达lncRNA(见图 2)。
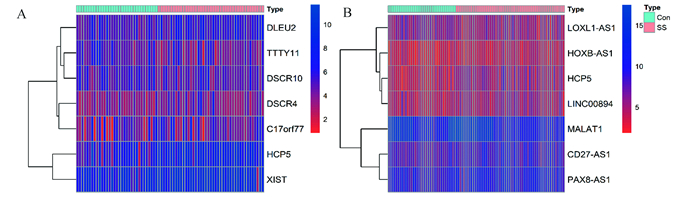
|
图 2 健康对照组和SS组之间差异lncRNA热图 Figure 2 Heatmap of differential lncRNA between healthy control and SS groups |
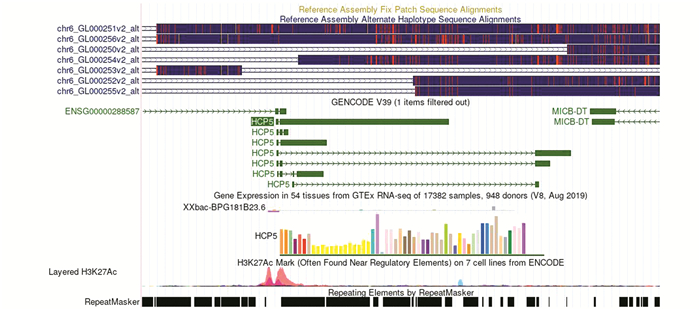
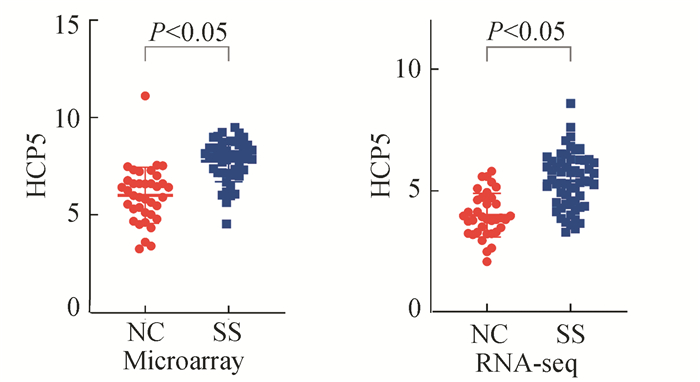
RF、LASSO 2种算法在数据集A分别筛选得到5个及4个关键lncRNA,将结果取交集共得到4个LncRNA(见图 3a);数据集B两种算法筛选得到关键lncRNA均为5个(见图 3b)。根据上述结果取交集共得到关键lncRNA HCP5。HCP5是一种人类物种特异性基因,定位于染色体6p21.33(31, 463, 170-31, 478, 936),长度为9 239,位于主要组织相容性复合体(MHC) Ⅰ类区域内的MICA和MICB基因之间。该基因有7个剪接变体和1个基因等位基因(见图 4)。在数据集A和B中计算HCP5表达情况,结果提示HCP5在SS唇腺组织中表达上调,差异具有统计学意义(见图 5)。

|
图 3 RF、LASSO2种算法筛查关键基因 Figure 3 Identifying key genes by RF and LASSO algorithms |
|
图 4 HCP5在染色体的位置 Figure 4 Location of the HCP5 gene |
|
图 5 lncRNA在正常唇腺组织与SS唇腺组织中差异表达情况 Figure 5 Differential expression of lncRNA in normal and SS labial gland tissues |
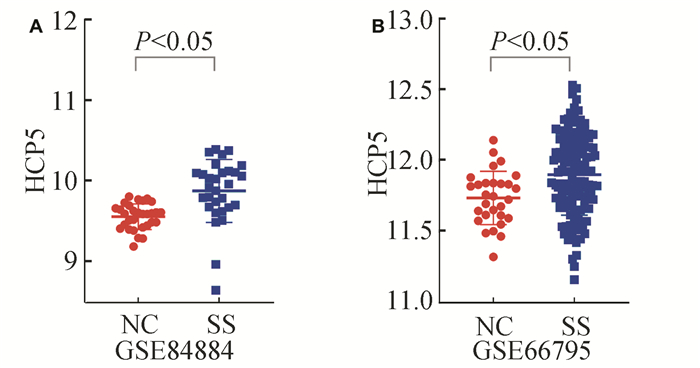
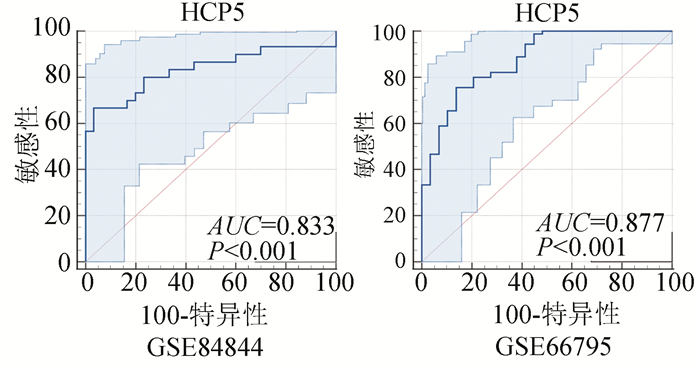
HCP5在SS全血不同数据集中表达均上调,(见图 6)。进一步分析显示,HCP5与ANA、IgG、SSA、SSB、ESSDAI具有明显相关性(见图 7)。ROC诊断曲线结果显示HCP5在不同数据集的AUC分别位为0.833(95%CI,0.715 - 0.917)和0.877(95%CI,0.805 - 0.949),P均小于0.001(见图 8)。
|
图 6 HCP5在对照组与SS组全血中差异表达情况 Figure 6 Differential expression of HCP5 in whole blood of control and SS groups |

|
图 7 HCP5与ANA、IgG、SSA、SSB、ESSDAI的相关性分析 Figure 7 Correlation analysis of HCP5 with ANA, IgG, SSA, SSB, and ESSDAI |
|
图 8 ROC诊断曲线 Figure 8 ROC diagnostic curves |
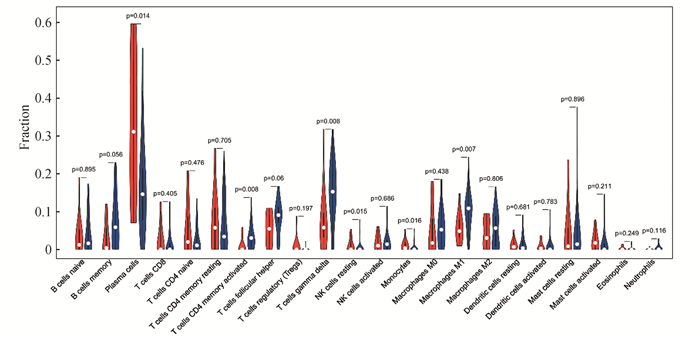
唇腺组织免疫细胞浸润结果显示,在SS唇腺组织中,γδT细胞、巨噬细胞、CD4+记忆T细胞比例明显升高,相反,浆细胞的比例在SS唇腺组织中比例减少(见图 9)。
|
图 9 SS唇腺组织中免疫细胞浸润结果 Figure 9 Results of immune infiltration in SS labial gland tissue |
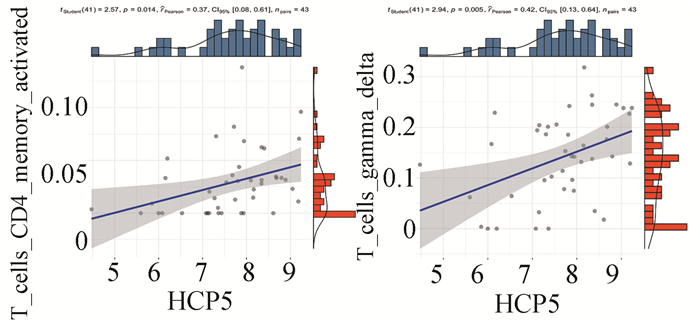
HCP5与免疫细胞浸润的相关性分析显示,HCP5的表达与γ/δT细胞、CD4+记忆T细胞在唇腺中的浸润程度呈正相关(见图 10)。
|
图 10 HCP5表达与免疫细胞浸润相关性 Figure 10 Correlation between HCP5 expression and immune cell infiltration |
lncRNA与编码蛋白基因共表达分析显示,在唇腺组织中,与HCP5共表达的编码蛋白基因为556个;在全血中中,与HCP5共表达的编码蛋白基因为355个。KEGG分析结果显示,唇腺组织中与HCP5共表达的蛋白功能集中于抗原加工和呈递、B细胞受体信号通路、趋化因子信号通路、Th1和Th2细胞分化、NF-κB信号通路、Th17细胞分化等信号通路(见图 11a),而全血中与HCP5表达的蛋白功能集中于代谢途径NOD样受体信号通路、糖酵解/糖异生、细胞凋亡、MAPK信号通路、p53信号通路等信号通路(见图 11b)。
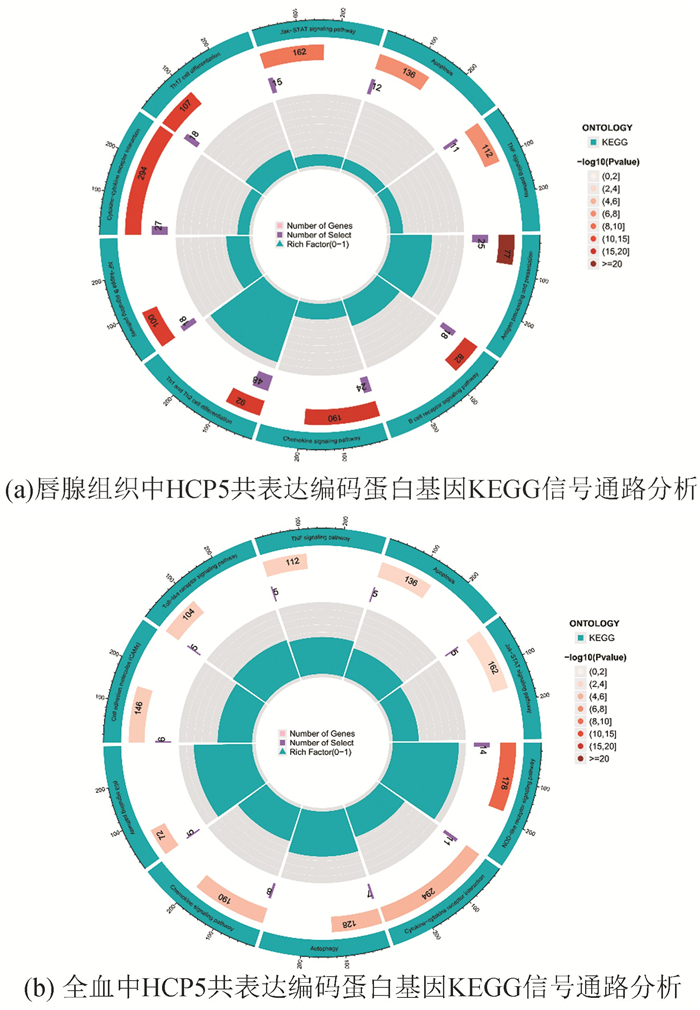
|
图 11 KEGG信号通路分析 Figure 11 Analysis of KEGG signaling pathway |
机器学习目前在医学上已经得到了广泛的应用,大量研究表明,机器学习在疾病的生物标志物筛选、诊断、预后中均发挥着重要作用[14-16]。本研究在机器学习的基础上,结合免疫浸润分析了干燥综合征患者唇腺组织lncRNA表达及局部免疫细胞浸润情况,并发现了两者之间存在相关性,这可能有助于对SS发病机制的理解。
SS是一种自身免疫性疾病,其特点是全身性B细胞激活和腺体内自身抗体的产生。免疫介导的炎症细胞浸润与淋巴趋化因子的异位产生、T/B细胞分离的形成以及淋巴细胞浸润有关。SS中唾液腺的组织病变特别令人感兴趣,因为一些生物学和免疫学异常经常导致患者腺体组织中发生的变化[17-18]。通过研究唇腺在SS中的变化,可以增加对疾病发病机制的理解。
免疫细胞浸润结果显示,γ/δ T细胞、CD4+记忆T细胞、巨噬细胞在SS患者唇腺组织中明显升高。一项研究显示,在SS患者中,γ/δ T细胞数量显著增加[19]。另一项研究显示,pSS患者的γδ T细胞产生更高的白介素-17,从而影响SS疾病的进程[20]。这说明γ/δ T细胞可能在SS中病理免疫反应中起作用。然而,到目前为止,这种T细胞亚群参与的确凿证据还很少,在未来的研究中,γ-δ T细胞在SS中的实验验证将是非常有意义的,因为我们对其在SS发病机制中的作用的理解仍然很少。CD4+记忆T细胞与自身免疫性疾病高度相关,它们的寿命长,对抗原的反应效率高,而且具有重复介导自身免疫反应的特殊潜力[21]。然而,关于CD4+记忆T细胞对自身免疫性疾病的影响仍有许多关键问题仍未得到解答。Michelle研究发现,SS患者唾液腺中CD4+记忆T细胞数量与正常组对比明显升高,并与唾液腺纤维化程度、病灶评分、角膜损伤和血清Ro抗体滴度呈正相关,提示CD4+记忆T细胞在SS发病中发挥着重要[22]。确定CD4+记忆T细胞在SS发病及病情进展中的作用,对于开发针对CD4+记忆T细胞驱动的自身免疫性疾病的靶向疗法至关重要。此外,SS患者巨噬细胞的浸润程度与病变严重程度及IL-18表达呈正相关[23],表明在腺体的浸润中存在巨噬细胞活化[24]。巨噬细胞相关的蛋白酶基因,包括组织蛋白酶、基质金属蛋白酶和羧肽酶,在SS患者高度发炎的腺体活检中被发现上调,表明巨噬细胞在SS腺体协调组织破坏和异常修复过程中发挥着作用[25]。在SS的小鼠模型中观察到,在B细胞和T细胞到来腺体之前,巨噬细胞已经在疾病的早期浸润腺体[26]。对SS患者单核细胞的分析显示其吞噬功能受损,并且在启动免疫抑制信号时存在相应缺陷[27]。对SS单核细胞衍生的巨噬细胞的进一步研究显示,SS患者巨噬细胞的吞噬能力明显降低[28],表明巨噬细胞参与了SS的发病。
本研究发现,HCP5在SS唇腺组织及全血中均中表达上调,在全血中,HCP5的表达水平与ANA、IgG、SSA、SSB均有明显相关性。所有这些结果都表明,HCP5与SS的典型表现密切相关。ESSDAI评分是SS疾病活动的评价指标之一,其分数越高,表明疾病具有更高的活动度。研究结果显示HCP5与ESSDAI评分呈正相关,表明HCP5与SS的疾病活动性也存在相关,可能参与了SS病情进展,具有促炎作用。同时,为进一步评价HCP5在SS诊断中的诊断价值,在不同数据集中进行了ROC曲线分析,其AUC值为0.833和0.877,表明HCP5可以作为诊断SS的潜在生物标志物。
HCP5主要在免疫系统细胞中表达,参与适应性和先天免疫反应[29]。目前对HCP5的研究多集中于肿瘤,如YU等发现,HCP5通过抑制miR-15a调节MACC1以促进宫颈癌的发展[30]。另一项研究显示,敲低HCP5后能够通过调节AKT信号激活增强了食管癌的放射敏感性[31]。而HCP5在干燥综合征中尚未见相关的报道。在研究免疫浸润模式时,我们发现lncRNAs明显参与了SS腺体的浸润。HCP5在腺体中的表达与γ/δ T细胞、CD4+记忆T细胞在腺体中的浸润程度呈正相关。KEGG富集分析结果显示,在唇腺中,与HCP5共表达的蛋白功能集中于Th1和Th2细胞分化、B细胞受体信号通路、Th17细胞分化、自噬等信号通路,而全血中与HCP5共表达的蛋白功能集中于NOD样受体信号通路、细胞凋亡、p53信号通路、自噬等,这些信号通路均参与了干燥综合征发病[32-39],且唇腺组织与全血中与HCP5共表达的蛋白富集的信号通路具有相似性。鉴于这些途径与SS的发病机制高度相关,推测HCP5可能参与了SS的发病及疾病的进展。
本研究预测了免疫浸润模式和相关lncRNA,揭示了SS潜在的免疫发病机制,确定了与免疫浸润有关的HCP5和可能与SS特异性免疫浸润模式有关的基本机制,并为靶向特定的免疫细胞和基因,改善该疾病的免疫治疗提供了线索。然而本研究也存在局限性,如总体研究样本量仍偏少,HCP5在SS发病机制中的详细作用仍有待通过对分子机制的体内和体外深入研究来验证。
4 结论1) 机器学习在分析、预测、筛选疾病的生物标志物中发挥着重要作用。
2) 在SS患者中,LncRNA HCP5表达越高,其疾病活动度越高。
3) HCP5表达水平与唇腺组织免疫细胞浸润密切相关。
4) HCP5有望成为SS潜在的诊断、预后标志物以及免疫治疗的靶点。
| [1] |
MALDINI C, SEROR R, FAIN O, et al. Epidemiology of primary Sjögren's syndrome in a French multiracial/multiethnic area[J]. Arthritis Care & Research, 2014, 66(3): 454-463. DOI:10.1002/acr.22115 (  0) 0) |
| [2] |
MARIETTE X, CRISWELL L. Primary Sjögren's syndrome[J]. The New England Journal of Medicine, 2018, 378(10): 931-939. DOI:10.1056/NEJMcp1702514 (  0) 0) |
| [3] |
FITZGERALD K, CAFFREY D. Long noncoding RNAs in innate and adaptive immunity[J]. Current Opinion in Immunology, 2014, 26: 140-146. DOI:10.1016/j.coi.2013.12.001 (  0) 0) |
| [4] |
HEWARD J, LINDSAY M. Long non-coding RNAs in the regulation of the immune response[J]. Trends in Immunology, 2014, 35(9): 408-419. DOI:10.1016/j.it.2014.07.005 (  0) 0) |
| [5] |
CHEN X, CHENG Q, WU H, et al. Long non-coding RNAs in systemic lupus erythematosus: New insights into disease pathogenesis and diagnosis[J]. Scandinavian Journal of Immunology, 2022, 95(6): e13167. DOI:10.1111/sji.13167 (  0) 0) |
| [6] |
YAMANAKA H. TNF as a target of inflammation in rheumatoid arthritis[J]. Endocrine, Metabolic & Immune Disorders Drug Targets, 2015, 15(2): 129-134. DOI:10.2174/1871530315666150316121808 (  0) 0) |
| [7] |
AINOLA M, POROLA P, TAKAKUBO Y, et al. Activation of plasmacytoid dendritic cells by apoptotic particles-mechanism for the loss of immunological tolerance in Sjögren's syndrome[J]. Clinical and Experimental Immunology, 2018, 191(3): 301-310. DOI:10.1111/cei.13077 (  0) 0) |
| [8] |
HILLEN M R, VERVERS F A, KRUIZE A A, et al. Dendritic cells, T-cells and epithelial cells: A crucial interplay in immunopathology of primary Sjögren's syndrome[J]. Expert Review of Clinical Immunology, 2014, 10(4): 521-531. DOI:10.1586/1744666X.2014.878650 (  0) 0) |
| [9] |
DU Wenhan, HAN Man, ZHU Xiaoxia, et al. The multiple roles of b cells in the pathogenesis of sjögren's syndrome[J]. Frontiers in Immunology, 2021, 12: 684999. DOI:10.3389/fimmu.2021.684999 (  0) 0) |
| [10] |
ZHOU Huimin, YANG Jun, TIAN Jie, et al. CD8+ T Lymphocytes: Crucial players in Sjögren's syndrome[J]. Frontiers in Immunology, 2020, 11: 602823. DOI:10.3389/fimmu.2020.602823 (  0) 0) |
| [11] |
KIRIPOLSKY J, MCCABE L G, KRAMER J M. Innate immunity in Sjögren's syndrome[J]. Clinical Immunology, 2017, 182: 4-13. DOI:10.1016/j.clim.2017.04.003 (  0) 0) |
| [12] |
NEWMAN A M, LIU C L, GREEN M R, et al. Robust enumeration of cell subsets from tissue expression profiles[J]. Nature Methods, 2015, 12(5): 453-457. DOI:10.1038/nmeth.3337 (  0) 0) |
| [13] |
BU Dechao, LUO Haitao, HUO Peipei, et al. KOBAS-i: Intelligent prioritization and exploratory visualization of biological functions for gene enrichment analysis[J]. Nucleic Acids Research, 2021, 49(W1): W317-W325. DOI:10.1093/nar/gkab447 (  0) 0) |
| [14] |
HU Ying, GUO Geyang, LI Junjun, et al. Screening key lncRNAs with diagnostic and prognostic value for head and neck squamous cell carcinoma based on machine learning and mRNA-lncRNA co-expression network analysis[J]. Cancer Biomarkers: Section A of Disease Markers, 2020, 27(2): 195-206. DOI:10.3233/CBM-190694 (  0) 0) |
| [15] |
MELLO A C, FREITAS M, COUTINHO L, et al. Machine learning supports long noncoding RNAs as expression markers for endometrial carcinoma[J]. BioMed Research International, 2020, 2020: 3968279. DOI:10.1155/2020/3968279 (  0) 0) |
| [16] |
XIAO Jianwei, WANG Rongsheng, CAI Xu, et al. Coupling of co-expression network analysis and machine learning validation unearthed potential key genes involved in rheumatoid arthritis[J]. Frontiers in Genetics, 2021, 12: 604714. DOI:10.3389/fgene.2021.604714 (  0) 0) |
| [17] |
LEE K E, KANG J H, YIM Y R, et al. The significance of ectopic germinal centers in the minor salivary gland of patients with Sjogren's syndrome[J]. Journal of Korean Medical Science, 2016, 31(2): 190-195. DOI:10.3346/jkms.2016.31.2.190 (  0) 0) |
| [18] |
GOULES A V, ARGYROPOULOU O D, PEZOULAS V C, et al. Primary Sjogren's syndrome of early and late onset: Distinct clinical phenotypes and lymphoma development[J]. Frontiers in Immunology, 2020, 11: 594096. DOI:10.3389/fimmu.2020.594096 (  0) 0) |
| [19] |
GERLI R, AGEA E, BERTOTTO A, et al. Analysis of T cells bearing different isotypic forms of the gamma/delta T cell receptor in patients with systemic autoimmune diseases[J]. The Journal of Rheumatology, 1991, 18(10): 1504-1510. DOI:10.1002/art.1780341023 (  0) 0) |
| [20] |
CICCIA F, ACCARDO-PALUMBO A, ALESSANDRO R, et al. Interleukin-36α axis is modulated in patients with primary Sjögren's syndrome[J]. Clinical and Experimental Immunology, 2015, 181(2): 230-238. DOI:10.1111/cei.12644 (  0) 0) |
| [21] |
RAPHAEL I, JOERN R R, FORSTHUBER T G. Memory CD4(+) T cells in immunity and autoimmune diseases[J]. Cells, 2020, 9(3): 531. DOI:10.3390/cells9030531 (  0) 0) |
| [22] |
JOACHIMS M L, LEEHAN K M, DOZMOROV M G, et al. Sjögren's syndrome minor salivary gland CD4+ memory T cells associate with glandular disease features and have a germinal center T follicular helper transcriptional profile[J]. Journal of Clinical Medicine, 2020, 9(7): 2164. DOI:10.3390/jcm9072164 (  0) 0) |
| [23] |
CHRISTODOULOU M I, KAPSOGEORGOU E K, MOUTSOPOULOS H M. Characteristics of the minor salivary gland infiltrates in Sjögren's syndrome[J]. Journal of Autoimmunity, 2010, 34(4): 400-407. DOI:10.1016/j.jaut.2009.10.004 (  0) 0) |
| [24] |
MANOUSSAKIS M N, BOIU S, KORKOLOPOULOU, et al. Rates of infiltration by macrophages and dendritic cells and expression of interleukin-18 and interleukin-12 in the chronic inflammatory lesions of Sjogren's syndrome: Correlation with certain features of immune hyperactivity and factors associated with high risk of lymphoma development[J]. Arthritis and Rheumatism, 56(12): 3977-3988. DOI:10.1002/art.23073 (  0) 0) |
| [25] |
GREENWELL-W, ILD T, MOUTSOPOULOS N M, GLIOZZI M, et al. Chitinases in the salivary glands and circulation of patients with Sjögren's syndrome: Macrophage harbingers of disease severity[J]. Arthritis and Rheumatism, 2011, 63(10): 3103-3115. DOI:10.1002/art.30465 (  0) 0) |
| [26] |
ROESCHER N, LODDE B M, VOSTERS J L, et al. Temporal changes in salivary glands of non-obese diabetic mice as a model for Sjögren's syndrome[J]. Oral Diseases, 2012, 18(1): 96-106. DOI:10.1111/j.1601-0825.2011.01852.x (  0) 0) |
| [27] |
HAUK V, FRACCAROLI L, GRASSO E, et al. Monocytes from Sjögren's syndrome patients display increased vasoactive intestinal peptide receptor 2 expression and impaired apoptotic cell phagocytosis[J]. Clinical and Experimental Immunology, 2014, 177(3): 662-670. DOI:10.1111/cei.12378 (  0) 0) |
| [28] |
MANOUSSAKIS M N, FRAGOULIS G E, VAKRAKOU A G, et al. Impaired clearance of early apoptotic cells mediated by inhibitory IgG antibodies in patients with primary Sjögren's syndrome[J]. PloS One, 2014, 9(11): e112100. DOI:10.1371/journal.pone.0112100 (  0) 0) |
| [29] |
KULSKI J K. Long noncoding RNA HCP5, a hybrid HLA class I endogenous retroviral gene: Structure, expression, and disease associations[J]. Cells, 2019, 8(5): 480. DOI:10.3390/cells8050480 (  0) 0) |
| [30] |
YU Y, SHEN H M, FANG D M, et al. LncRNA HCP5 promotes the development of cervical cancer by regulating MACC1 via suppression of microRNA-15a[J]. EuropeanReview for Medical and Pharmacological Sciences, 2018, 22(15): 4812-4819. DOI:10.26355/eurrev_201808_15616 (  0) 0) |
| [31] |
GUO Yue, WANG Lan, YANG Hui, et al. Knockdown long non-coding RNA HCP5 enhances the radiosensitivity of esophageal carcinoma by modulating AKT signaling activation[J]. Bioengineered, 2022, 13(1): 884-893. DOI:10.1080/21655979.2021.2014386 (  0) 0) |
| [32] |
PSIANOU K, PANAGOULIAS I, PAPANASTASIOU A D, et al. Clinical and immunological parameters of Sjögren's syndrome[J]. Autoimmunity Reviews, 2018, 17(10): 1053-1064. DOI:10.1016/j.autrev.2018.05.005 (  0) 0) |
| [33] |
CARRILLO-BALLESTEROS F, PALAFOX-SÁNCHEZ C, FRANCO-TOPETE R., et al. Expression of BAFF and BAFF receptors in primary Sjögren's syndrome patients with ectopic germinal center-like structures[J]. Clinical and Experimental Medicine, 2020, 20(4): 615-626. DOI:10.1007/s10238-020-00637-0 (  0) 0) |
| [34] |
LUO Jing, MING Bingxia, ZHANG Cai, et al. IL-2 inhibition of Th17 generation rather than induction of Treg cells is impaired in primary Sjögren's syndrome patients[J]. Frontiers in Immunology, 2018, 13(9): 1755. DOI:10.3389/fimmu.2018.01755 (  0) 0) |
| [35] |
KIM Y H, LI Zhengri, CUI Lian, et al. Expression of nod-like receptors and clinical correlations in patients with dry eye disease[J]. American Journal of Ophthalmology, 2019, 200: 150-160. DOI:10.1016/j.ajo.2019.01.002 (  0) 0) |
| [36] |
FU Jiayao, SHI Huan, WANG Baoli, et al. LncRNA PVT1 links Myc to glycolytic metabolism upon CD4+ T cell activation and Sjögren's syndrome-like autoimmune response[J]. Journal of Autoimmunity, 2020, 107: 102358. DOI:10.1016/j.jaut.2019.102358 (  0) 0) |
| [37] |
LI Zhe, GUO Jialong, BI Liqi. Role of the NLRP3 inflammasome in autoimmune diseases[J]. Biomed Pharmacother, 2020, 130: 110542. DOI:10.1016/j.biopha.2020.110542 (  0) 0) |
| [38] |
YE Lei, SHI Huan, YU Chuangqi, et al. LncRNA Neat1 positively regulates MAPK signaling and is involved in the pathogenesis of Sjögren's syndrome[J]. International Immunopharmacology, 2020, 88: 106992. DOI:10.1016/j.intimp.2020.106992 (  0) 0) |
| [39] |
MARIETTE X, SIBILIA J, ROUX S, et al. A new defensive mechanism to prevent apoptosis in salivary ductal cells from patients with Sjögren's syndrome: over-expression of p53 and p21[J]. Rheumatology (Oxford), 2002, 41(1): 96-99. DOI:10.1093/rheumatology/41.1.96 (  0) 0) |
 2023, Vol. 21
2023, Vol. 21


