缺血性神经损伤(Ischemic Nerve Injury, INI),指脑部动脉血管管壁发生病理改变,血管管腔狭窄、闭塞、血流停滞,进而引起脑组织缺血坏死,出现神经功能障碍[1-2]。研究神经损伤发病机制,开发新型治疗药物,对于减少神经损伤的发病率、改善患者预后有重要意义。
异鼠李素(Isorhamnetin, Iso)广泛存在于多种植物的花、果实和叶中。研究表明,异鼠李素能够通过NF-κB信号通路抑制炎症反应、保护内皮细胞[3],还能够清除自由基、抑制线粒体脂质过氧化、减轻氧化应激造成的心肌损伤[4]。此外,异鼠李素能够提高MPP+损伤后SH-SY5Y细胞存活率,抑制MPP+引起的细胞活性氧和线粒体超氧化物增加,减缓线粒体膜电位下降[5]。并且,异鼠李素通过激活PI3K/Akt/GSK-3β/CREB信号通路减轻鱼藤酮诱导的PC12细胞损伤[6]。目前尚缺乏异鼠李素治疗缺血性神经损伤的报道,本研究采用网络药理学和分子对接技术,结合细胞生物学和分子生物学验证,系统阐述异鼠李素治疗缺血性神经损伤的作用。
1 材料与方法 1.1 数据库所用数据库及网址(见表 1)。
| 表 1 数据库及网址 Table 1 Databases and websites |
异鼠李素购自上海源叶生物科技有限公司。PC12细胞购自中国医学科学院基础医学研究所。Roswell Park Memorial Institute 1640(RPMI 1640),马血清,胎牛血清,均购自Gibco; MTT,多聚赖氨酸,均购自Sigma-Aldrich。蛋白激酶Bα(Protein Kinase B α, AKT1)、白介素6(Interleukin 6, IL6)、基质金属蛋白酶2(Matrix Metalloproteinase2, MMP2)、β-actin均购自Cell Signaling Technology。
1.3 靶点收集与网络构建1) 靶点收集 采用PubChem数据库获得异鼠李素的三维结构,应用ChEMBL、SwissTargetPrediction、DrugBank、STITCH及BindingDB数据库检索异鼠李素潜在靶点,运用UniProt数据库将靶点统一转换为靶基因形式,构建异鼠李素药理作用靶基因集合。应用DisGeNET、GenCLiP及CTD数据库检索缺血性神经损伤疾病相关靶点。将异鼠李素药理作用靶点与缺血性神经损伤疾病相关靶点取交集,作为异鼠李素治疗缺血性神经损伤的靶点。将上述靶点导入VarElect数据库,分析基因与表型之间相关性。
2) 蛋白质相互作用网络构建 将异鼠李素治疗缺血性神经损伤的靶点导入STRING数据库,构建蛋白-蛋白相互作用(Protein-protein Interaction, PPI)网络。之后将PPI网络导入Cytoscape软件,使PPI网络可视化。CytoHubba排名前十的靶点作为异鼠李素治疗缺血性神经损伤的关键靶点。使用Cytoscape的Network analyser插件进行拓扑分析。同时应用MODE进行聚类构建功能模块,并基于ClueGo对功能模块进行分析。
3) GO功能分析和KEGG通路富集分析 为了进一步探究治疗靶点参与的生物学过程及所涉及的信号通路,将核心治疗靶蛋白上传至DAVID数据库进行GO分析和KEGG通路富集分析,显著性阈值设为P < 0.05,筛选排名靠前的生物学过程和信号通路,并做气泡图进行可视化。
1.4 生物活性验证1) 分子对接 利用PDB数据库查询核心靶点的PDB ID,导入Discovery Studio进行分子对接,预测和评价活性成分与靶点的结合活性。
细胞培养。PC12细胞用RPMI1640培养液,加10%马血清和5%胎牛血清,37 ℃、5% CO2,饱和湿度条件下培养。
2) 细胞活力检测 PC12细胞以完全培养基8 000 cells/well接种于96孔板24 h,之后PBS洗一次,分为正常对照组、缺糖缺氧/复糖复氧(Oxygen Glucose Deprivation/ Reoxygenation, OGD/R)损伤模型组和异鼠李素低中高(1.5, 5和15 μmol·L-1)给药组。除正常对照组外,其余各组均更换Earle’s平衡盐溶液,并置于低氧培养箱(1% O2, 5% CO2, 94% N2)37 ℃培养2 h。之后更换完全培养基,重新置于常氧培养箱37 ℃继续培养至24 h。正常对照组始终使用完全培养基在常氧培养箱孵育24 h。实验终点时,取细胞上清,测定LDH释放; 下层每孔加入100 μL 0.5 mg/mL MTT溶液,4 h后加入150 μL DMSO振荡摇匀5 ~ 10 min,用酶标仪在490 nm处测定吸光度。
3) Western blot检测蛋白表达 实验终点,提取细胞蛋白,进行聚丙烯酰胺凝胶电泳。分别用稀释后的AKT1、IL6、MMP2和β-actin 4 ℃孵育过夜,再置于相应种属二抗中孵育2 h,接下来用Tris缓冲盐溶液洗涤后显色成像。
1.5 研究策略运用各数据库及软件进行的网络药理学分析,通过小分子化合物筛选和疾病靶标蛋白基因筛选,分别得到化合物与疾病对应相关靶标蛋白大分子。之后将筛选得到的交集基因进行整合,在基因层面建立化合物与疾病之间的联系,并进行蛋白质相互作用及信号通路研究。最后,对网络中的关键节点和功能模块,辅以生物学验证。即以“化合物-疾病”两个分支开始,以网络构建、网络可视化、网络分析预测二者相互作用为基础,以化合物对疾病的生物学功能为终止(见图 1)。
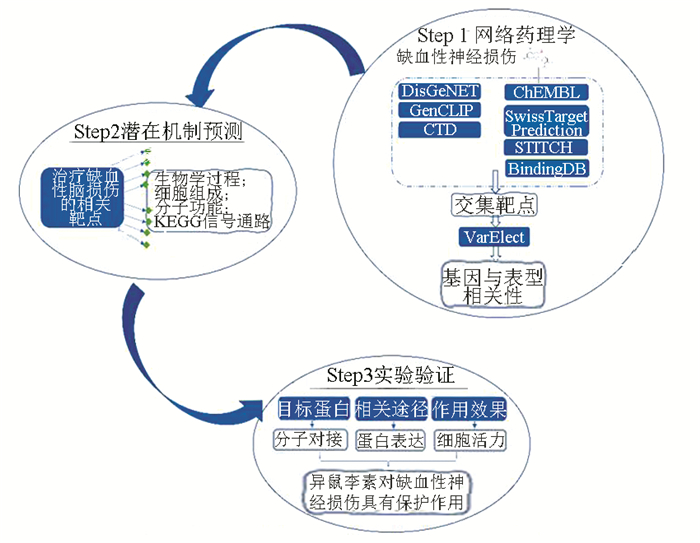
|
图 1 采用网络药理学方法预测化合物新适应症的流程概览 Figure 1 Process overview of predicting new indications of compounds with a network pharmacology approach |
通过数据库检索得到异鼠李素药理作用靶点,与缺血性神经损伤疾病相关靶点取交集,共得到50个共有靶点,作为异鼠李素治疗缺血性神经损伤靶点。将上述靶点导入STRING数据库,构建PPI网络,结果(见图 2和表 1),PPI网络中的关键基因包括促分裂原活化蛋白激酶3(Mitogen-activated Protein Kinase 3, MAPK3)、白细胞介素家族、MMP2、AKT1、非受体酪氨酸激酶c(SRC proto-Oncogene, non-receptor, SRC)、半胱氨酸天冬氨酸蛋白酶8(Recombinant caspase 8, CASP8)、基质金属蛋白酶-9(Matrix metallopeptidase 9, MMP9)等。

|
图 2 异鼠李素治疗缺血性神经损伤靶点的PPI网络 Figure 2 PPI network of potential targets of isorhamnetin for ischemic nerve injury treatment |
借助MCODE算法对核心靶点互作网络进行模块识别,从互作网络中识别出3个功能模块(见图 3)。
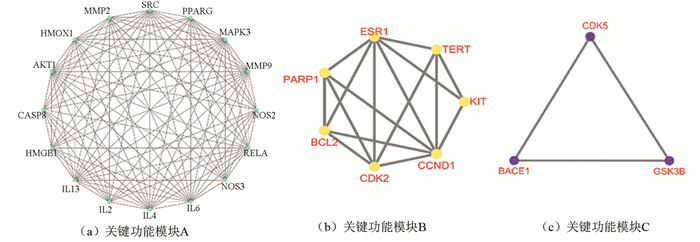
|
图 3 异鼠李素治疗缺血性神经损伤核心靶点的关键功能模块 Figure 3 Key functional modules in targets of isorhamnetin against ischemic nerve injury |
进一步借助ClueGo对识别的模块进行分析(见图 4和表 3),MCODE A主要功能富集在VEGF信号通路、HIF-1信号通路、Toll样受体信号通路等。MCODE B主要富集在卵泡发育、p53信号通路。MCODE C主要富集在淀粉样β蛋白反应。
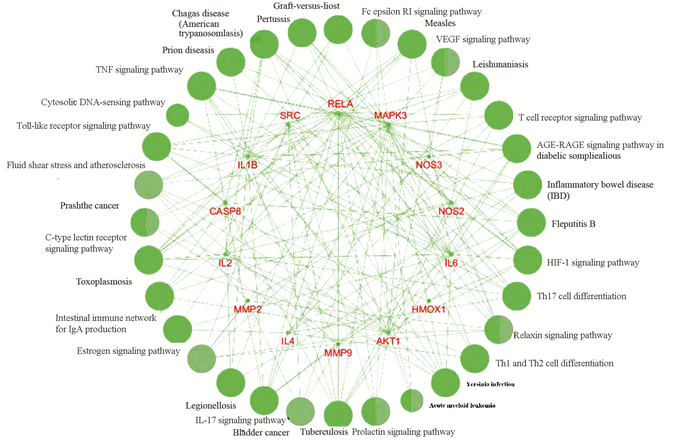
|
图 4 模块A GO分析和KEGG富集分析 Figure 4 GO and KEGG enrichment results of MCODE A |
| 表 2 核心基因命名和拓扑参数 Table 2 Designations and topological parameters of hub genes |
| 表 3 功能模块的GO分析和KEGG富集分析 Table 3 GO and KEGG enrichment results of functional modules |
将异鼠李素治疗缺血性神经损伤靶点导入VarElect数据库,选择表型为缺血性神经损伤,进行基因与表型相关性分析,其中49个潜在基因与缺血性神经损伤表型直接相关,1个潜在基因与缺血性神经损伤表型间接相关,Average Disease Causing Likelihood大于65%的靶点(见表 4)。
| 表 4 异鼠李素治疗缺血性神经损伤基因-表型相关性分析 Table 4 Gene-phenotype correlation analysis of targets of isorhamnetin for ischemic nerve injury treatment |
将核心治疗靶蛋白上传至DAVID数据库,进行GO分析和KEGG通路富集分析,P < 0.05。筛选排名靠前的生物学过程和信号通路,并做气泡图进行可视化,结果(见图 5)。富集度较高的生物学过程主要涉及调控细胞凋亡、转录、蛋白质磷酸化、炎症反应、ERK1和ERK2级联反应、细胞内信号转导、细胞增殖、缺糖缺氧、血管生成、MAPK级联反应、一氧化氮生物合成等。细胞组成主要包括细胞核、细胞质、等离子体膜、线粒体、蛋白质复合体、小窝、细胞骨架、核染色体、生长锥、周期蛋白依赖性蛋白激酶全酶复合物等。同时异鼠李素治疗缺血性神经损伤的作用与蛋白结合、ATP结合、酶结合、类固醇激素受体活性、细胞因子活性、血红素结合、受体蛋白酪氨酸激酶活性、核心启动子序列特异性DNA结合性等分子功能密切相关。对异鼠李素治疗缺血性神经损伤靶点涉及的KEGG通路进行富集分析,排名靠前的主要包括PI3K-AKT信号通路、HIF-1信号通路、雌激素信号通路、肿瘤坏死因子信号通路、FoxO信号通路、细胞凋亡、ErbB信号通路、Toll样受体信号通路、血小板激活、Jak-STAT信号通路等。
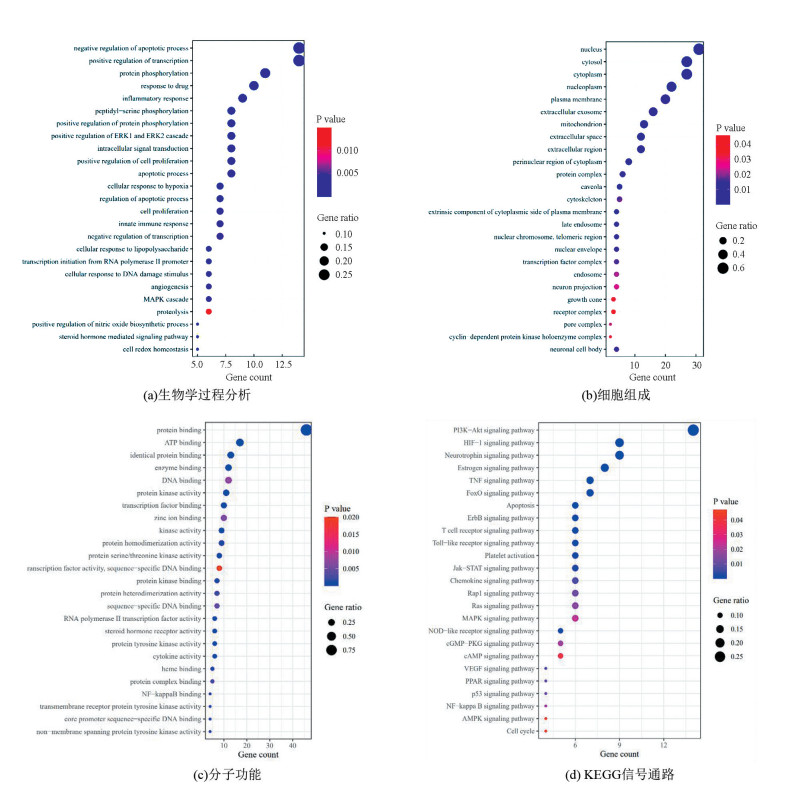
|
图 5 异鼠李素治疗缺血性神经损伤靶基因GO分析和KEGG通路分析 Figure 5 GO analysis and KEGG pathway analysis of isorhamnetin target for ischemic nerve injury treatment |
将CytoHubba排名前十的核心靶点与异鼠李素进行分子对接,异鼠李素与AKT1、CASP8、IL6、MMP2的结合能力均高于其内在配体,结果(见图 6)。
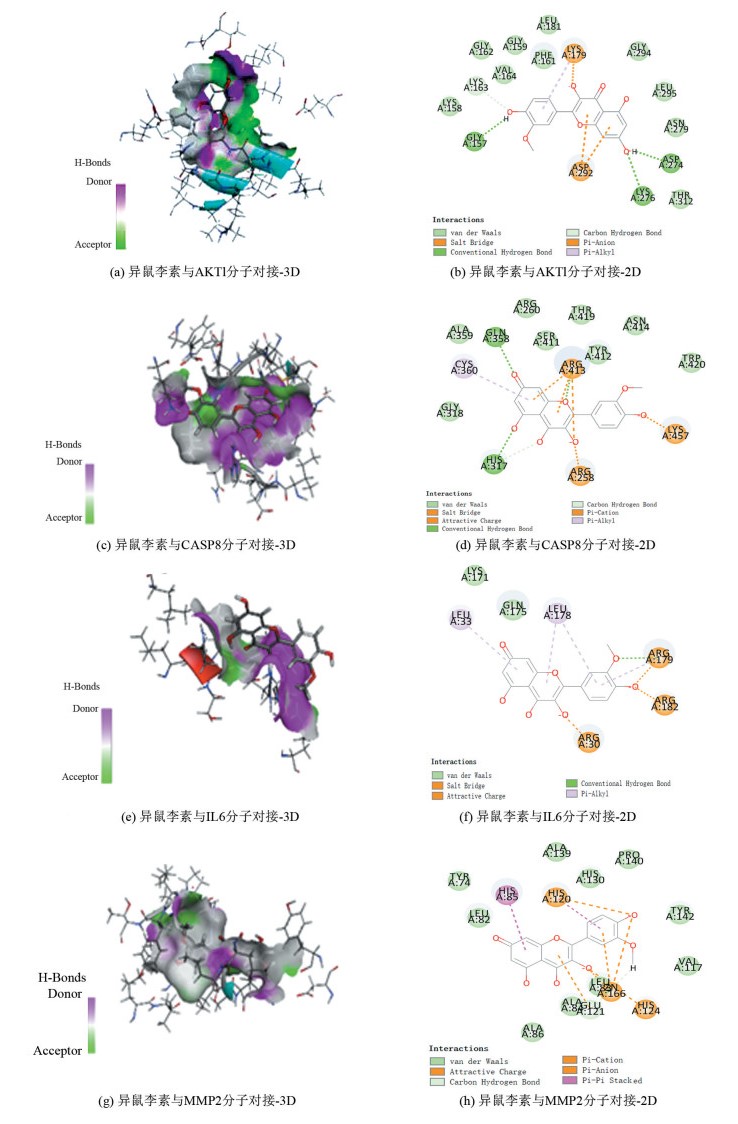
|
图 6 异鼠李素与AKTl(a和b)、CASP8(c和d)、IL6(e和f)和MMP2(g和h)分子对接 Figure 6 Docking patterns of isorhamnetin interacting with AKTl(a and b), CASP8 (c and d), IL6(e and f), and MMP2(g and h) |
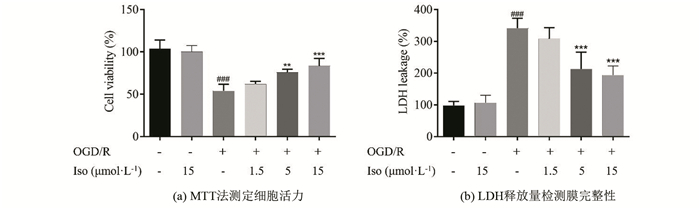
|
图 7 异鼠李素对OGD/R损伤后PC12细胞活力的影响 Figure 7 Effects of isorhamnetin on cell viability of PC12 cells subjected to OGD/R |
MTT检测结果显示,15 μmol·L-1 异鼠李素作用PC12细胞24 h,不影响细胞生长。缺糖缺氧2 h,复糖复氧至24 h后,PC12细胞存活率显著降低为正常对照组的54.2%。1.5、5和15 μmol·L-1异鼠李素能够显著降低OGD/R对PC12细胞造成的损伤,其细胞存活率分别达到62.06%、75.59%、84.42%。LDH检测结果显示,15 μmol·L-1异鼠李素作用不影响PC12细胞LDH的释放。OGD/R损伤显著提高LDH释放量(P < 0.001),异鼠李素(5和15 μmol· L-1)可以显著降低OGD/R诱导的LDH释放(P < 0.01,P < 0.001)。
2.7 异鼠李素改善OGD/R损伤PC12细胞中AKT1、IL6、MMP2蛋白表达采用Western blot检测异鼠李素对SH-SY5Y细胞中AKT1、IL6和MMP2蛋白表达的影响。与正常对照组相比,缺糖缺氧/复糖复氧(Oxygen glucose deprivation/ reoxygenation, OGD/R)损伤SH-SY5Y细胞模型组中p-AKT1、IL6和MMP2蛋白水平均显著升高。与模型组相比,异鼠李素能够显著降低p-AKT1、IL6和MMP2的活化或表达(见图 8)。
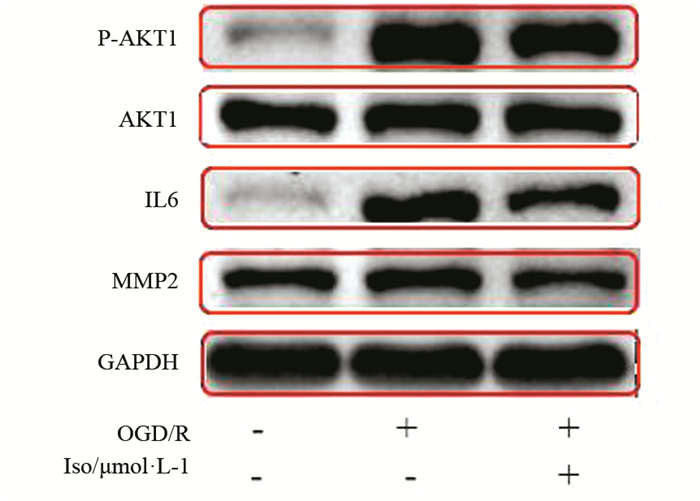
|
图 8 异鼠李素对OGD/R损伤PC12细胞AKT1、IL6和MMP2表达水平的影响 Figure 8 Effects of isorhamnetin on AKT1, IL6, and MMP2 levels in OGD/R-injured PC12 cells |
异鼠李素具有抗炎、抗氧化、抑制细胞内活性氧和线粒体超氧化物增加,减缓线粒体膜电位下降等作用,本文借助网络药理学、分子对接、分子生物学技术,分析异鼠李素治疗缺血性神经损伤的潜在作用机制。
首先通过数据库检索得到异鼠李素治疗缺血性神经损伤靶点共50个,主要包括炎症因子、丝裂原活化蛋白激酶家族、基质金属蛋白酶家族等。进一步借助MCODE对靶点互作网络进行模块识别,并采用ClueGo对识别的模块进行分析。
血管内皮生长因子(Vascular Endothelial Growth Factor, VEGF)家族主要包括VEGFA、VEGFB、VEGFC、VEGFD、VEGFE和胎盘生长因子[7],属于高度特异性的生长因子。VEGF家族通过作用于内皮生长因子受体发挥作用,能够促进血管内皮细胞的增生和迁移、增加血管通透性、改变细胞外基质,在缺血性神经损伤的发生发展过程中扮演着重要的角色。其中,VEGFA主要作用于新生血管,在促进神经元功能中具有重要作用。VEGFB主要作用于非新生血管、病理性血管及肿瘤组织。VEGFE主要作用于血管内皮细胞,与血管形成密切相关[8-9]。HIF-l为异二聚体转录因子,包括α和β两个亚型。其中,α亚基是调控HIF-1氧依赖性降解的关键元件,参与调控缺氧细胞存活以及新血管形成。HIF-lα是缺氧激活的重要转录因子,参与调控细胞代谢、细胞凋亡、细胞自噬、新血管形成等生物学过程,一方面,HIF-lα通过促进糖酵解、抑制线粒体氧化磷酸化,减少细胞耗氧。此外,HIF-lα能够激活细胞自噬,清除受损的细胞器。另一方面,HIF-lα也是调控新血管形成的重要物质,参与调控众多血管新生相关蛋白,包括基质金属蛋白酶、血小板衍生生长因子、红细胞刺激因子、表皮生长因子、转化生长因子以及细胞趋化因子等[9-11]。Toll样受体(Toll-like Receptors, TLRs)信号通路主要存在髓样分化因子88(Myeloid Differentiation Factor 88, MyD88)依赖性和MyD88非依赖性两条途径,绝大部分TLRs信号转导均需依赖MyD88的活化,经多个信号分子激活传递,激活转录因子NF-κB,导致促炎性因子释放,激活天然免疫系统,形成适应性免疫炎症反应,在缺血性损伤中发挥重要作用[12]。异鼠李素治疗缺血性神经损伤核心靶点主要集中在VEGF信号通路、HIF-1信号通路、Toll样受体信号通路、T细胞受体信号通路、肿瘤坏死因子信号通路等。由此可见,异鼠李素确实能够调节上述通路,发挥治疗缺血性神经损伤的作用。
将CytoHubba排名前十的核心靶点与异鼠李素进行分子对接,异鼠李素与AKT1、CASP8、IL6、MMP2的结合能力均高于其内在配体,最后建立OGD/R损伤PC12细胞模型,异鼠李素能够显著降低OGD/R对PC12细胞造成的损伤,提高细胞存活率降低LDH的释放,并且能够显著降低OGD/R损伤引起的PC12胞中AKT1、IL6和MMP2的活化或表达。
AKT也被称为蛋白激酶B(Protein Kinase B, PKB)主要包括PKBα/AKT1,PKBβ/AKT2和PKBγ,AKT1广泛存在于大脑中。磷脂酰肌醇-3, 4, 5-三磷酸盐能够诱导无活性的AKT1在Ser473和Thr308磷酸化生成p-AKT,p-AKT可以通过磷酸化多种介质促进细胞存活[13-15]。异鼠李素能够显著抑制OGD/R损伤引起的AKT1的磷酸化。炎性因子是胶质细胞介导炎症反应的主要信使。炎性反应与众多疾病的发生发展密切相关。TNFα、IL1β和IL6等都是重要的炎症因子,可以促进炎症反应和组织损伤,IL-6过量释放会导致炎症反应的加重和扩大[16-18]。OGD/R损伤PC12细胞后,IL6表达显著升高,异鼠李素能够明显抑制IL6的蛋白表达,从而抑制炎症反应。MMPs属于锌依赖性酶,其主要生物学功能是降解细胞外基质。与脑缺血关系密切的主要为明胶酶A(MMP-2)和明胶酶B(MMP-9)。这两种MMPs被激活或活性上调,导致血脑屏障结构破坏,功能损伤,继而引起脑水肿和出血[19-21]。OGD/R损伤PC12细胞后,MMP2表达活化明显升高,异鼠李素能够显著降低MMP2活化。
4 结论异鼠李素可能通过AKT1、IL6、CASP8和MMP2等靶点作用于PI3K-AKT信号通路、VEGF信号通路、HIF-1信号通路、Toll样受体信号通路等多条信号通路发挥脑保护作用,为异鼠李素的进一步研究提供理论基础。
| [1] |
ASAKAWA T, ZONG L, WANG L, et al. Unmet challenges for rehabilitation after stroke in China[J]. Lancet, 2017, 390(190): 121-122. DOI:10.1016/S0140-6736(17)31584-2 (  0) 0) |
| [2] |
BENJAMIN E J, MUNTNER P, ALONSO A A, et al. Heart disease and stroke statistics-2019 update: A report from the American Heart Association[J]. Circulation, 2019, 139(10): E56-E528. DOI:10.1161/CIR.0000000000000659 (  0) 0) |
| [3] |
KIM S Y, JIN C Y, KIM C H, et al. Isorhamnetin alleviates lipopolysaccharide-induced inflammatory responses in BV2 microglia by inactivating NF-κB, blocking the TLR4 pathway and reducing ROS generation[J]. International Journal of Molecular Medicine, 2019, 43(2): 682-692. DOI:10.3892/ijmm.2018.3993 (  0) 0) |
| [4] |
ZHAO T T, YANG T L, GONG L, et al. Isorhamnetin protects against hypoxia/reoxygenation-induced injure by attenuating apoptosis and oxidative stress in H9c2 cardiomyocytes[J]. Gene, 2018, 666: 92-99. DOI:10.1016/j.gene.2018.05.009 (  0) 0) |
| [5] |
张雯, 宋俊科, 朱晓瑜, 等. 异鼠李素激活Sirt1/PGC-1α信号通路抑制MPP+诱导的SH-SY5Y细胞损伤[J]. 药学学报, 2019, 54(11): 1976-1981. ZHANG Wen, SONG Junke, ZHU Xiaoyu, et al. Isorhamnetin activates Sirt1/PGC-1α signaling pathway to inhibit MPP+ -induced SH-SY5Y cell injury[J]. Acta Pharmaceutica Sinica, 2019, 54(11): 1976-1981. DOI:10.16438/j.0513-4870.2019-0205 (  0) 0) |
| [6] |
谭会洁, 宋俊科, 石峰, 等. 异鼠李素激活PI3K/Akt/GSK-3β/CREB信号通路减轻鱼藤酮诱导的PC12细胞损伤[J]. 中国药理学通报, 2020, 36(2): 272-276. TAN Huijie, SONG Junke, SHI Feng, et al. Isorhamnetin prevents PC12 cell from rotenone-induced injury via PI3K/Akt/GSK-3β/CREB signaling pathway[J]. Chinese Pharmacological Bulletin, 2020, 36(2): 272-276. DOI:10.3969/j.issn.1001-1978.2020.02.023 (  0) 0) |
| [7] |
SAMUEL J G, CECILIE M. The Janus face of VEGF in stroke[J]. International Journal of Molecular Sciences, 2018, 19(5): 1362. DOI:10.3390/ijms19051362 (  0) 0) |
| [8] |
SETYOPRANOTO I, SADEWA A H, WIBOWO S, et al. Comparison of mean VEGF-A expression between acute ischemic stroke patients and non-ischemic stroke subjects[J]. Open Access Macedonian Journal of Medical Sciences, 2019, 7(5): 747-751. DOI:10.3889/oamjms.2019.175 (  0) 0) |
| [9] |
YANG X, ZHANG Y, GENG K, et al. Sirt3 protects against ischemic stroke injury by regulating HIF-1α/VEGF signaling and blood-brain barrier integrity[J]. Cellular and Molecular Neurobiology, 2020. DOI:10.1007.DOI:10.1007/s10571-020-00889-0 (  0) 0) |
| [10] |
JIANG Q, GENG X K, WARREN J, et al. Hypoxia inducible Factor-1α (HIF-1α) mediates NLRP3 inflammasome-dependent-pyroptotic and apoptotic cell death following ischemic stroke[J]. Neuroscience, 2020, 448: 126-139. DOI:10.1016/j.neuroscience.2020.09.036 (  0) 0) |
| [11] |
PENG X, LI C, YU W, et al. Propofol attenuates hypoxia-induced inflammation in BV2 microglia by inhibiting oxidative stress and NF-κ B/Hif-1 α signaling[J]. BioMed Research International, 2020, 8978704. DOI:10.1155/2020/8978704 (  0) 0) |
| [12] |
LI B, XIA Y, HU B. Infection and atherosclerosis: TLR-dependent pathways[J]. Cellular and Molecular Life Sciences, 2020, 77(14): 2751-2769. DOI:10.1007/s00018-020-03453-7 (  0) 0) |
| [13] |
HOU Y Y, WANG K, WAN W J, et al. Resveratrol provides neuroprotection by regulating the JAK2/STAT3/PI3K/AKT/mTOR pathway after stroke in rats[J]. Genes & Diseases, 2018, 5(3): 245-255. DOI:10.1016/j.gendis.2018.06.001 (  0) 0) |
| [14] |
LIU Q, JIN Z Q, XU Z L, et al. Antioxidant effects of ginkgolides and bilobalide against cerebral ischemia injury by activating the Akt/Nrf2 pathway in vitro and in vivo[J]. Cell Stress & Chaperones, 2019, 24(2): 441-452. DOI:10.1007/s12192-019-00977-1 (  0) 0) |
| [15] |
SAMAKOVA A, GAZOVA A, SABOVA N, et al. The PI3k/Akt pathway is associated with angiogenesis, oxidative stress and survival of mesenchymal stem cells in pathophysiologic condition in ischemia[J]. Physiological research/Academia Scientiarum Bohemoslovaca, 2019, 68(S2): S131-S138. DOI:10.33549/physiolres.934345 (  0) 0) |
| [16] |
LYKKE K, BENTE F, BETTINA H, et al. Post-stroke inflammation-target or tool for therapy[J]. Acta Neuropathologica, 2019, 137(5): 693-714. DOI:10.1007/s00401-018-1930-z (  0) 0) |
| [17] |
BENJAMIN, H, SARAH H, LENA U, et al. IL-6 plasma levels correlate with cerebral perfusion deficits and infarct sizes in stroke patients without associated infections[J]. Frontiers in Neurology, 2019, 10.3389. DOI:10.3389/fneur.2019.00083 (  0) 0) |
| [18] |
YANG J X, PAN Y Y, GE J H, et al. Tanshinone ⅡA attenuates TNF-alpha-induced expression of VCAM-1 and ICAM-1 in endothelial progenitor cells by blocking activation of NF-kappaB[J]. Cellular Physiology and Biochemistry, 2016, 40(1/2): 195-206. DOI:10.1159/000452537 (  0) 0) |
| [19] |
SHEN Y F, GU J X, LIU Z J, et al. Inhibition of HIF-1α reduced blood brain barrier damage by regulating MMP-2 and VEGF during acute cerebral ischemia[J]. Frontiers in Cellular Neuroscience, 2018, 288. DOI:10.3389/fncel.2018.00288 (  0) 0) |
| [20] |
CHEN L, YANG Q, DING R, et al. Carotid thickness and atherosclerotic plaque stability, serum inflammation, serum MMP-2 and MMP-9 were associated with acute cerebral infarction[J]. Experimental and Therapeutic Medicine, 2018, 16(6): 5253-5257. DOI:10.3892/etm.2018.6868 (  0) 0) |
| [21] |
YANG Y, ROSENBERG G A. Matrix metalloproteinases as therapeutic targets for stroke[J]. Brain Research, 2015, 1623: 30-38. DOI:10.1016/j.brainres.2015.04.024 (  0) 0) |
 2023, Vol. 21
2023, Vol. 21


