骨肉瘤(Osteosarcoma,OS)是来源于骨组织的恶性肿瘤,多见于青少年和儿童,发生部位在长骨远端,在早期就容易产生远处转移和侵袭[1-2]。大约15%~20%的患者在早期就诊时可发现转移。肺是最常见的转移部位,占转移疾病的85%以上,而骨骼是远处转移的第二常见部位。近几年来化疗药物的使用虽然提高了骨肉瘤患者的生存率和生活质量,但患者对化疗药物产生的耐药性和较高的毒副作用仍然是难解决的问题[3]。因此,急需新的药物进行治疗。
染料木素(Genistein)是一种天然存在于水果、坚果和大豆中的物质,前期的许多研究表明了它能有效的抑制乳腺癌、前列腺癌、肝癌、卵巢癌、膀胱癌、胃癌,脑癌以及神经母细胞瘤和慢性淋巴细胞白血病的活性[4]。同时染料木素也能够通过抑制炎症、促进细胞凋亡、调节类固醇激素受体和代谢途径等方面来降低肿瘤细胞的活性和数量[5]。染料木素的抗肿瘤能力在许多癌症中都得等到了体现,但在骨肉瘤的研究中却很少见。
近几年来开始使用生物信息学的方法来筛选药物可能作用的靶基因,在通过靶基因与肿瘤之间的关系来评价药物对肿瘤是否有作用,例如利用生物信息学预测白黎芦醇作用于前列腺癌的靶基因[6];用生物信息学方法来筛选对乳腺癌治疗有用的药物和它们的靶基因[7]。本研究在DrugBank数据库筛选染料木素作用的靶基因。经过一系列方法筛选出CXCL8, CXCL12, LPAR1和CNR1;hsa-miR-23b-3p,hsa-miR-23a-3p,hsa-miR-141-3p和hsa-miR-200a-3p作为染料木素在骨肉瘤中最重要的靶基因,对于靶向治疗的前景具有重要价值。
1 材料与方法 1.1 选择药物相关的靶基因DrugBank数据库(https://www.drugbank.ca/)是一个全面的、可以免费访问的、包含药物和药物靶基因的在线数据库。它是生物信息学和化学信息学的详细来源,它将药物数据和药物靶标的信息相结合,它总共包含13 494种药物,其中包括2 638种已经批准的小分子药物,1 367种批准的生物制剂(蛋白质,多肽,疫苗和能引起过敏的过敏原),131种营养药品和至少6 347种正进行实验的药物[8]。用DrugBank用于搜索与染料木素相关的靶基因。
1.2 构建PPI网络和筛选关键基因String数据库(https://string-db.org/cgi/input.pl)是构建蛋白质和蛋白质相互作用网络(PPI)的常用数据库,同时可以预测蛋白质与蛋白质之间的关系,将基因上传至String数据库,从而构建蛋白质与蛋白质的互作网络图[9]。Cytoscape软件是一款可以将PPI可视化的软件,并且具有多种功能强大的插件,可以继续对PPI进行后续的分析和编辑。将与染料木素有关的基因导入到string数据库中,单个基因连接数不超过35个同时基因与基因之间的关联最低为0.7。随后将string数据库中得到的数据导入到Cytoscape(http://www.cytoscape.org/)中得到PPI图。随后用插件CytoHubba来对PPI网路进行相互作用分析,筛选出排名前25的关键基因。
1.3 Kyoto encyclopedia of genes and genomes (KEGG)分析WebGestalt (http://www.webgestalt.org)和DAVID数据库相似,是一个全面的进行GO和KEGG功能分析的网站[10],更新比DAVID及时。将25个关键基因导入到WebGestalt数据库中,以P < 0.05为基准筛选信号通路,最终选出10个基因信号通路。
1.4 数据库验证关键靶基因HCMDB (Human Cancer Database)是一个用于存储和分析肿瘤的数据库。从GEO和TCGA中收集了124个以前发表的转录组数据集。它包含了29种癌症类型。将得到的关键靶基因输入HCMDB中进行验证。
1.5 预测靶基因的miRNA和验证将验证后的靶基因输入到miRDB数据库中,miRDB数据库是可以进行mRNA和miRNA预测的数据库,筛选条件为target score≥80。随后将得到的miRNA在GSE65071数据库中进行验证。
2 结果分析 2.1 与染料木素相关的靶基因表 1详细展示了染料木素在DrugBank里的信息,是属于小分子物质,分子量为270.236 9,同时它可以抑制蛋白酪氨酸激酶和拓扑异构酶-Ⅱ(DNA拓扑异构酶,Ⅱ型)的活性,所以可以作为抗肿瘤的药物。在实验上,它已经显示出在人和鼠细胞系中可以诱导G2期停滞,而阻滞细胞周期也是诱导凋亡的一个重要途径,目前正在进行前列腺癌的研究,表 2展现出了与染料木素有关的13个基因,分别是ESR2, TOP2A, PTK2B, NCOA1, ESR1, NCOA2, ESRRA, ESRRB, NR1I2, AKT1, GPER1, CYP1B1和SHBG,在其中选择对基因作用仍不是很明确的靶基因,因此,最终选出11个与染料木素有关的靶基因。
| 表 1 染料木素在DrugBank里的信息 Table 1 Information on genistein in DrugBank |
| 表 2 染料木素的靶基因信息 Table 2 Target gene information of genistein |
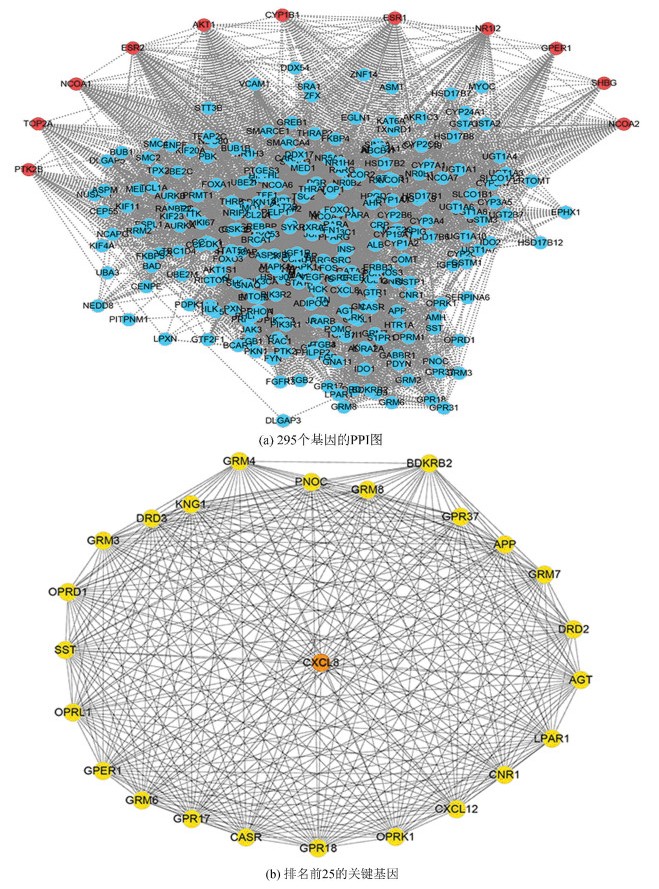
将所选取的11个靶基因导入string数据库中,随后删除重复的蛋白,得到了284个与11个靶基因有关的基因(见图 1a),用Cytoscape插件中的CytoHubba来分析,得出在PPI网络图中排名前25的基因,这25个基因就是关键基因(见图 1b),分别为CXCL8,GRM4,GPER1,OPRK1,GRM7,OPRD1,SST,GRM3,LPAR1,CXCL12,GRM8,CASR,GPR37,GPR17,GPR18,GRM6,CNR1,DRD2,APP,BDKRB2,KNG1,OPRL1,PNOC,DRD3,AGT。
|
图 1 PPI图和25个关键基因 Figure 1 PPI network and 25 key genes 注:(a)中红色代表 11个与染料木素的靶基因,蓝色代表与11个靶基因有关的基因;(b)中红色为排名第1的关键基因. |
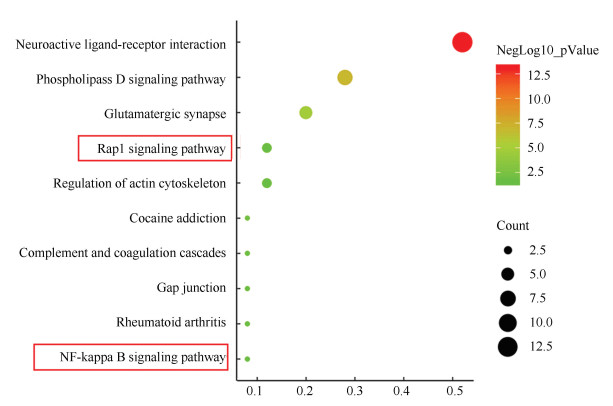
将25个关键基因导入到WebGestalt中,以P < 0.05为基准筛选出信号通路,最终得到了10个与关键基因有关的信号通路(见图 2),分别为神经活性配体-受体相互作用(Pvalue为7.016 609 515 630 98×10-14);磷脂酶D信号通路(Pvalue为1.259 889 412 796 86×10-7);谷氨酸能突触(Pvalue为1.623 606 752 154 67×10-5);可卡因成瘾(Pvalue为8.957 925 689 391 24×10-3);Rap1信号通路(Pvalue为2.163 675 640 824 39×10-2);补体途径(Pvalue为2.225 309 023 143 79×10-2);肌动蛋白细胞骨架的调节(Pvalue为2.361 391 695 821 74×10-2);细胞间隙连接(Pvalue为2.721 187 625 285 12×10-2);类风湿性关节炎(Pvalue为2.836 966 674 350 58×10-2);NF-kappa B信号通路(Pvalue为3.135 002 865 670 41×10-2)(见表 3)。在这些通路中,NF-kappa B和Rap1信号通路在骨肉瘤中研究较多,例如骨肉瘤差异基因的分析也证实了差异基因主要存在于Rap1信号通路[12],同时也有文献证实了类黄酮B可以通过抑制NF-kappa B信号通路从而使得骨肉瘤细胞对阿霉素的敏感性提高[13]。因此,选取这两个信息通路所在的基因,进行下一步的分析。
|
图 2 KEGG富集分析结果 Figure 2 Results of KEGG enrichment analysis |
| 表 3 KEGG富集分析结果 Table 3 Results of KEGG enrichment analysis |
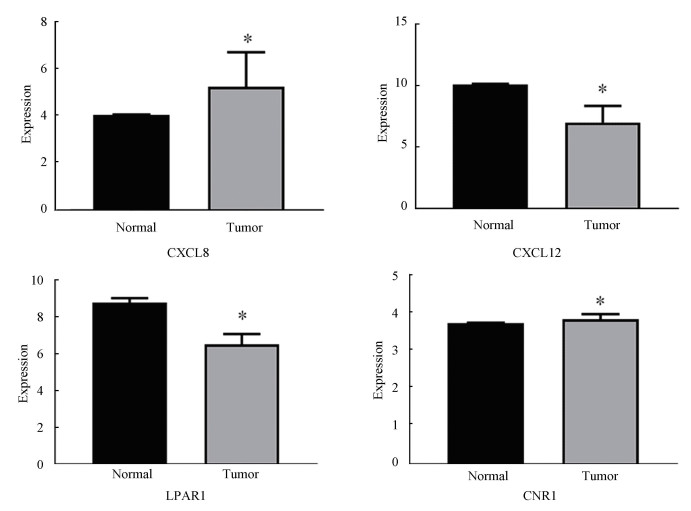
将最后得到的5个靶基因输入HCMDB数据库中进行验证,最后发现4个基因在骨肉瘤中具有统计学差异,分别是CXCL8, CXCL12, LPAR1和CNR1(见图 3)。
|
图 3 CXCL8, CXCL12, LPAR1和CNR1数据库验证(*P<0.05) Figure 3 Verification of CXCL8, CXCL12, LPAR1 and CNR1 in database(*P < 0.05) |
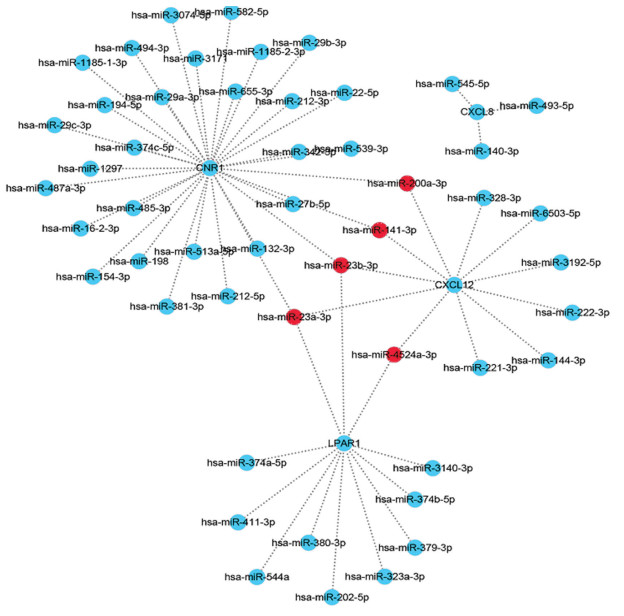
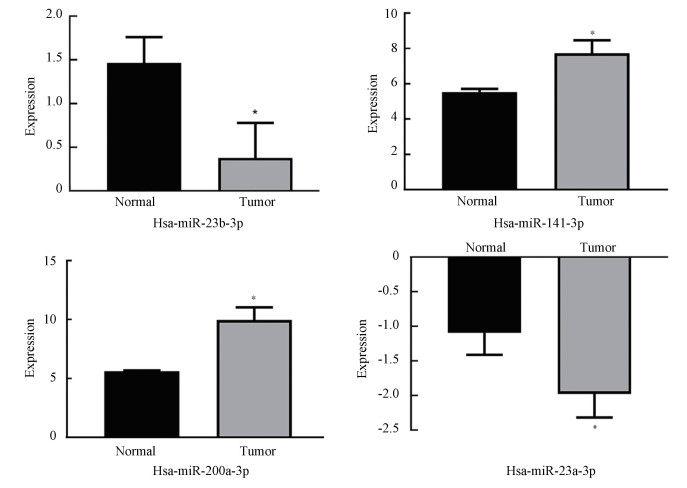
将验证后的4个靶基因利用miRDB进行miRNA预测,筛选标准为与靶基因的target score≥80,得到了mRNA-miRNA调控网络图(见图 4)。其中选取与4个靶基因关联程度高的5个miRNA:hsa-miR-23b-3p,hsa-miR-23a-3p,hsa-miR-141-3p,hsa-miR-200a-3p和has-miR-4524a-3p。随后将5个miRNA用GSE65071进行验证,最后得到4个miRNA:hsa-miR-23b-3p,hsa-miR-23a-3p,hsa-miR-141-3p,hsa-miR-200a-3p(见图 5)。
|
图 4 mRNA-miRNA调控网络图 Figure 4 Regulation network diagram of mRNA-miRNA |
|
图 5 hsa-miR-23b-3p,hsa-miR-23a-3p,hsa-miR-141-3p,hsa-miR-200a-3p在GSE65071验证(*P<0.05) Figure 5 Verification of hsa-miR-23b-3p, hsa-miR-23a-3p, and hsa-miR-141-3p, hsa-miR-200a-3p in GSE65071(*P < 0.05) |
骨肉瘤恶性程度较高,发病率较低但死亡率较高。当前的治疗主要以手术切除加术前术后放化疗为金标准,但治疗效果往往不佳,主要是因为患者的耐受和化疗药物严重的毒副作用[3]。染料木素是一种天然的小分子物质,在前期的研究中已经发现染料木素可以抑制多种肿瘤的活性,诱导肿瘤细胞的凋亡。通过生物信息学的方法来分析染料木素调控骨肉瘤可能的信号通路和可能的靶基因,为后续的基础实验提供理论依据。
首先在DrugBank数据库中选取与染料苏木有关的靶基因,后将与染料苏木有关的靶基因导入到string数据库中进行分析,用Cytoscape中的插件Cytohubb进行分析,获得排名前25的关键基因。随后将这个25个基因导入到WebGestalt数据库中筛选与骨肉瘤相关的通路,将通路中的基因导入HCMDB数据库中进行验证,确认了4个靶基因:CXCL8, CXCL12, LPAR1, CNR1。最后预测4个靶基因的miRNA并进行验证,得到4个miRNA:hsa-miR-23b-3p,hsa-miR-23a-3p,hsa-miR-141-3p,hsa-miR-200a-3p。
以上4个靶基因都与骨肉瘤之间有关,前期研究报道了CXCL8通过调节PI3K / Akt信号通路促进人骨肉瘤细胞的侵袭和转移[14];而CXCL12/ CXCR4轴在骨肉瘤原发性肿瘤的生长和转移中存在重要的作用,特别是肺转移[15]。研究发现单酰基甘油脂肪酶抑制剂JZL184可以抑制骨肉瘤所造成的骨溶解现象,可能是通过调控CNR1进行的[16]。而用顺铂处理后的骨肉瘤MG63细胞中发现LPAR1的表达明显减低,证实LAPR1也和骨肉瘤的发生发展有关[17]。miR-23b-3p可以通过抑制PGC1α从而促进骨肉瘤增殖从[18];miR-141-3p是骨肉瘤中EGFR通路的关键负调控因子,影响骨肉瘤的发生发展[19];另外两种miRNA虽与骨肉瘤无直接相关,但这两种miRNA在骨肉瘤中表达均有统计学差异,且两种miRNA可调节肿瘤的发展[20-21]。因此,以上分析中所得到的4个靶基因和4个miRNA都与骨肿瘤有着联系,可以作为骨肉瘤潜在的靶基因。为以后对骨肉瘤的基础实验提供了理论依据,同时也为染料木素治疗骨肉瘤增加了靶基因并且提供了理论支持。
4 结论通过对染料木素中11个靶基因有关的基因进行生物信息学分析, 探讨染料木素对骨肉瘤潜在的作用靶基因。运用STRING、WebGestalt,cytoscape和HCDMB以及miRDB数据库进行分析,发现CXCL8, CXCL12, LPAR1, CNR1以及hsa-miR-23b-3p,hsa-miR-23a-3p,hsa-miR-141-3p,hsa-miR-200a-3p基因可能是骨肉瘤的潜在靶基因。不仅能促进骨肉瘤研究的进展,也可以老药新用,提供新的药物治疗靶点,进而扩大药物的适用范围。
| [1] |
ISAKOFF M S, BIELACK S S, MELTZER P, et al. Osteosarcoma: Current treatment and a collaborative pathway to success[J]. Journal of Clinical Oncology, 2015, 33(27): 3029-3035. DOI:10.1200/JCO.2014.59.4895 (  0) 0) |
| [2] |
SUN L, LI Y, ZHANG J, et al. Prognostic value of pathologic fracture in patients with high grade localized osteosarcoma: A systemic review and meta-analysis of cohort studies[J]. Journal of Orthopaedic Research, 2015, 33(1): 131-139. DOI:10.1002/jor.22734 (  0) 0) |
| [3] |
LUETKE A, MEYERS P A, LEWIS L, et al. Osteosarcoma treatment: Where do we stand? A state of the art review[J]. Cancer Treatment Reviews, 2014, 40(4): 523-532. DOI:10.1016/j.ctrv.2013.11.006 (  0) 0) |
| [4] |
MUKUND V, MUKUND D, SHARMA V, et al. Genistein: Its role in metabolic diseases and cancer[J]. Critical Reviews in Oncology Hematology, 2017, 119: 13-22. DOI:10.1016/j.critrevonc.2017.09.004 (  0) 0) |
| [5] |
ZHANG C, YANG F, NI S, et al. Drug-target-disease network analysis of gene-phenotype connectivity for genistein in ovarian cancer[J]. Onco Targets and Therapy, 2018, 11: 8901-8908. DOI:10.2147/OTT.S183302 (  0) 0) |
| [6] |
HSIEH T C, WU S T, BENNETT D J, et al. Functional/activity network (FAN) analysis of gene-phenotype connectivity liaised by grape polyphenol resveratrol[J]. Oncotarget, 2016, 7(25): 38670-38680. DOI:10.18632/oncotarget.9578 (  0) 0) |
| [7] |
廖思帆, 吴丽媛, 梁碧怡, 等. 基于生物信息学的乳腺癌治疗药物的筛选及其分子机制研究[J]. 广东药科大学学报, 2019, 35(2): 84-87+91. LIAO Sifan, WU Liyuan, LIANG Biyi, et al. Screening and molecular mechanism study of therapeutic drugs for breast cancer based on bioinformatics[J]. Journal of Guangdong Pharmaceutical University, 2019, 35(2): 84-87+91. DOI:10.16809/j.cnki.2096-3653.2019030104 (  0) 0) |
| [8] |
NING Y, LI Q, XIANG H, et al. Apoptosis induced by 7-difluoromethoxyl-5, 4′-di-n-octyl genistein via the inactivation of FoxM1 in ovarian cancer cells[J]. Oncology Reports, 2012, 27(6): 1857-1864. DOI:10.3892/or.2012.1739 (  0) 0) |
| [9] |
JIANG P, LIU X S. Big data mining yields novel insights on cancer[J]. Nature Genetics, 2015, 47(2): 103-104. DOI:10.1038/ng.3205 (  0) 0) |
| [10] |
WANG J, VASAIKAR S, SHI Z, et al. WebGestalt 2017: A more comprehensive, powerful, flexible and interactive gene set enrichment analysis toolkit[J]. Nucleic Acids Research, 2017, 45(W1): W130-W137. DOI:10.1093/nar/gkx356 (  0) 0) |
| [11] |
ZHOU G, SOUFAN O, EWALD J, et al. "NetworkAnalyst 3.0: A visual analytics platform for comprehensive gene expression profiling and meta-analysis"[J]. Nucleic Acids Research, 2019, 47(W1): W234-W241. DOI:10.1093/nar/gkz240 (  0) 0) |
| [12] |
SHI Z, ZHOU H, PAN B, et al. Exploring the key genes and pathways of osteosarcoma with pulmonary metastasis using a gene expression microarray[J]. Molecular Medicine Reports, 2017, 16(5): 7423-7431. DOI:10.3892/mmr.2017.7577 (  0) 0) |
| [13] |
XIA Y Z, NI K, GUO C, et al. Alopecurone B reverses doxorubicin-resistant human osteosarcoma cell line by inhibiting P-glycoprotein and NF-kappa B signaling[J]. Phytomedicine, 2015, 22(3): 344-351. DOI:10.1016/j.phymed.2014.12.011 (  0) 0) |
| [14] |
JIANG H, WANG X, MIAO W, et al. CXCL8 promotes the invasion of human osteosarcoma cells by regulation of PI3K/Akt signaling pathway[J]. Acta Pathologica, Microbiologica et Immunologica Scandinavica, 2017, 125(9): 773-780. DOI:10.1111/apm.12721 (  0) 0) |
| [15] |
NEKLYUDOVA O, ARLT M J, BRENNECKE P, et al. Altered CXCL12 expression reveals a dual role of CXCR4 in osteosarcoma primary tumor growth and metastasis[J]. Journal of Cancer Research and Clinical Oncology, 2016, 142(8): 1739-1750. DOI:10.1007/s00432-016-2185-5 (  0) 0) |
| [16] |
MARINO S, DE RIDDER D, BISHOP R T, et al. Paradoxical effects of JZL184, an inhibitor of monoacylglycerol lipase, on bone remodelling in healthy and cancer-bearing mice[J]. EBioMedicine, 2019, 44: 452-466. DOI:10.1016/j.ebiom.2019.05.048 (  0) 0) |
| [17] |
TAKAHASHI K, FUKUSHIMA K, TANAKA K, et al. Involvement of LPA signaling via LPA receptor-2 in the promotion of malignant properties in osteosarcoma cells[J]. Experimental Cell Research, 2018, 369(2): 316-324. DOI:10.1016/j.yexcr.2018.05.037 (  0) 0) |
| [18] |
ZHU R, LI X, MA Y. miR-23b-3p suppressing PGC1alpha promotes proliferation through reprogramming metabolism in osteosarcoma[J]. Cell Death & Disease, 2019, 10(6): 381. DOI:10.1038/s41419-019-1614-1 (  0) 0) |
| [19] |
WANG J, WANG G, LI B, et al. miR-141-3p is a key negative regulator of the EGFR pathway in osteosarcoma[J]. Onco Targets and Therapy, 2018, 11: 4461-4478. DOI:10.2147/OTT.S171304 (  0) 0) |
| [20] |
XIANG Y, YANG Y, LIN C, et al. MiR-23a-3p promoted G1/S cell cycle transition by targeting protocadherin17 in hepatocellular carcinoma[J]. Journal of Physiology and Biochemistry, 2020, 76(1): 123-134. DOI:10.1007/s13105-020-00726-4 (  0) 0) |
| [21] |
SHI C, YANG Y, ZHANG L, et al. MiR-200a-3p promoted the malignant behaviors of ovarian cancer cells through regulating PCDH9[J]. Onco Targets and Therapy, 2019, 12: 8329-8338. DOI:10.2147/OTT.S220339 (  0) 0) |
 2021, Vol. 19
2021, Vol. 19


