2. 上海微创电生理医疗科技股份有限公司,上海 201318
2. Shanghai MicroPort EP MedTech Co., Ltd., Shanghai 201318, China
心房颤动(简称房颤)是一种常见的心律失常,我国的房颤患者已超过1 000万[1]。随着现代社会老龄化程度的加深,房颤患者的数量还会继续增加。
由于人们尚未完全理解房颤的病理机制,对房颤的研究一直在持续。其中借助主导频率(Dominant frequency,简称DF)分析手段对房颤的研究也一直在继续[2-4]。许多学者、医生针对DF消融策略展开了许多研究、实验。他们通过实际临床实验,证明了基于DF的补充术式在中长的恢复过程中效果优于传统术式;探究了人或动物心腔不同部位房颤时DF的大小;探究了消融手术前后DF的变化,证明了手术前后DF会有11%的降低;也尝试小波变换、盲源分析、模板匹配等多种方法提取DF特征,使得我们可以在更普遍的条件下快速、准确地提取DF特征[5-12]。
但目前,研究学者和临床医生在对DF进行研究时,仅孤立的观测房颤患者心内各个位置是否拥有频率较高的DF,却忽略了对心内不同部位DF的关联性的分析,更加忽略了对环肺静脉(Pulmonary veins,简称PV)附近的DF能否真正传导到心房,并影响心房活动的分析。
基于上述研究现状,本文一方面对传统的Botteron’s算法进行了改进,提高了其提取DF的能力。另一方面为了比较心内不同位置DF的关联性,本文选取距离心房较近的冠状静脉窦(Coronary sinus,简称CS)和房颤最主要触发病灶区域PV这两个区域的信号进行研究,对比其在手术过程中的DF的联系与区别[10-13]。在传统DF分析的基础上更侧重分析PV、CS附近的DF能否相互传导、相互影响。这对揭示房颤机理有着重要意义。
1 经典Botteron’s算法经典的Botteron’s算法被广泛应用于房颤DF研究领域里[14-15],它能够从心电信号(ECG)中提取出频域信息,并能突出体现房颤的DF特征。
经典的Botteron’s算法主要三个步骤依次如下:
(1) 带通滤波:用40-250 Hz带通滤波器对信号进行滤波;
(2) 取模运算:对信号进行取模运算;
(3) 低通滤波:对信号进行20 Hz的低通滤波。
经过以上算法处理后,再对信号进行取窗处理(本文采用的窗函数是Hamming窗),最后再对其进行傅里叶变换(Fourier transformation,简称FFT),就可以获得较为清晰的频谱图。该频谱图包含了房颤的DF信息,我们可以借助该图分析DF特征。
经过杨翠微等学者的研究,经典Botteron’s算法省略最后一个步骤(低通滤波),对主频提取结果影响不大[16]。经过本文作者的验证,也得出了相同结论。所以为了减少计算量,提高算法实时性,下文所叙述的经典Botteron’s算法均为省略了第三步骤的简化版Botteron’s算法。
2 基于R波滤除的Bottern’s算法通过实验发现,当信号中含有较大幅值的室波时,经典Botteron’s算法容易引入谐频干扰,且这种谐频干扰主要是由心室跳动引起的。一方面CS、PV附近的电信号能受室波的影响[17];另一方面我们所关注的DF主要存在于心房信号里[18]。所以通过滤除信号中的R波(在室波中R波包含较多的室波能量)能够减少这类谐频干扰的同时保留DF特征。
2.1 R波滤除算法为了滤除R波,我们首先应当计算出R波出现的时刻,并进一步确定R波出现的时间段,进而才能对其进行滤除。
我们选取了只需占用较小的计算量及内存资源的二阶差分阈值的算法来寻找R波出现的时刻。该算法原理是利用了R波与其二阶差分的极小值存在相对固定的位移关系。所以通过设定合适的阈值求出二阶差分的局部极小值可以确定R波出现的时刻[19]。具体公式如式(1)所示:
| $ \begin{array}{l}{x^{(2)}(n)=2 x(n+1)+x(n+2)-} \\ {x(n-2)-2 x(n-1)}\end{array} $ | (1) |
式中x(n)表示原始信号,n=3,4,…k,k为对应信号序列。
通过上述算法我们可以定位出R波出现的时刻。再结合R波时长的经验值,可以确定R波出现的区间。进而再将区间内的信号进行衰减。为了避免在衰减过程中引入脉冲波,通过多次实验,我们选择利用式(2)、(3)、(4)所示的公式对R波区间内的信号进行衰减,并将衰减倍数设定为100。
| $ k=\frac{x_{a}-x_{b}}{a-b} $ | (2) |
| $ x_{R}^{*}=k(R-a)+x_{a} $ | (3) |
| $ X_{R}=\frac{x_{R}-x_{R}^{*}}{k_{R}}+x_{R}^{*} $ | (4) |
式中a、b分别代表R波区间起止序列号,xa、xb代表对应序列原始信号,R表示R波区间任意一点的序列号,xR为其对应的原始信号,XR为R序列衰减后的信号,kR为R波衰减倍数。最终可以得到滤除R波后的ECG信号。再对信号进行Botteron’s算法,可以有效减少谐频干扰。
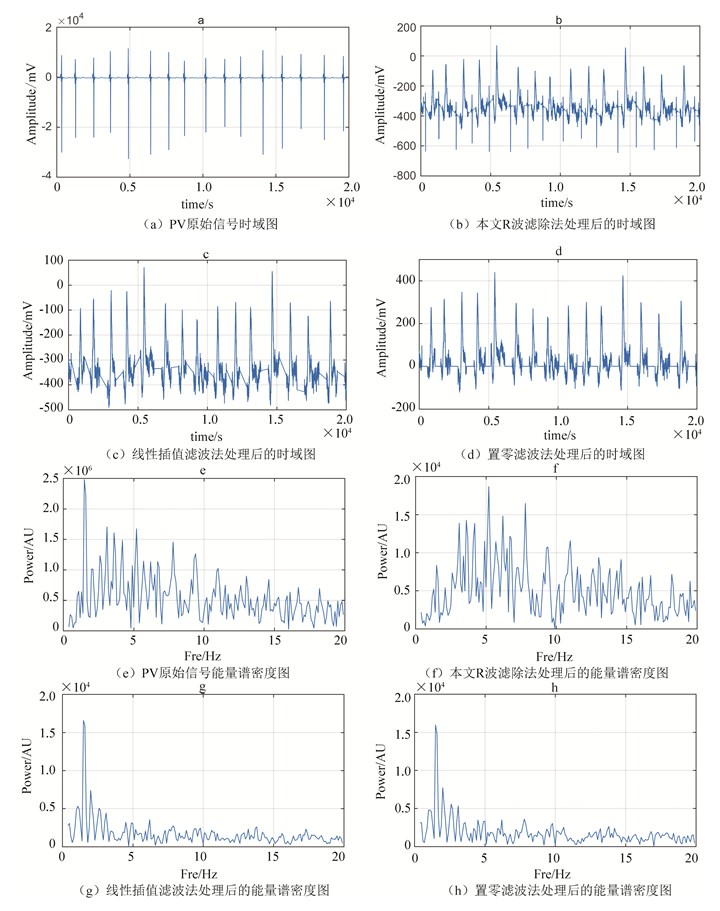
为证明该滤波算法的优越性,与线性插值滤波法、置零滤波法进行了对比。所谓线性插值滤波法既是以R波两端为起止点,中间所有值用线性插值的方式进行替代;所谓置零滤波法既是将R波区间内所有的信号置零,但是由于大部分情况下ECG的基准信号都不为零,所以在滤波之前做了减平均值的处理。其原始信号和三种滤波后的信号的时域图(见图 1(a)、(b)、(c)、(d))和能量谱密度图(见图 1(e)、(f)、(g)、(h))如下。时域图为房颤时的PV信号示例,采样时间为10 s,采样率为2 000 Hz;能量谱密度图为0.5 Hz至20 Hz的能量分布。由于谐波的干扰,很难从图 1(e)、(g)、(h)中分辨出心房的DF,但从图 1(f)却可以较为清晰的看到5.2 Hz、7.7 Hz左右频率的DF。由此说明该算法较之线性插值滤波法和置零滤波法能更好的提取房颤时的DF特征,具有一定优越性。
|
图 1 PV原始信号、三种不同滤波后的信号的时域图和能量谱密度图 Figure 1 Maps for time-domain and energy spectral density of PV original signal and signals after three different wave filtering |
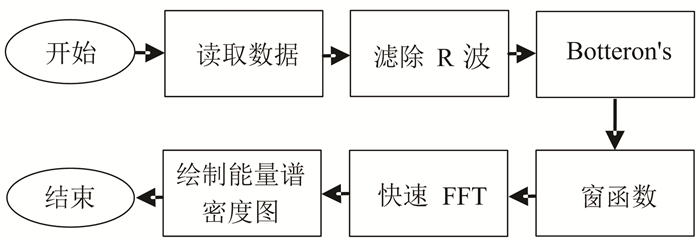
具体算法流程如下(见图 2)。首先进行R波滤除;再进行Botteron’s算法处理;再运用Hamming窗函数进行加窗处理;再进行快速FFT变换;最后根据帕塞瓦尔定理的公式绘制出对应时间段的能量谱密度图。
|
图 2 算法流程图 Figure 2 Algorithm flow charts |
本实验选用的20例实验数据均是近六年房颤消融临床手术中采集的数据,且来自于国内多家不同实验中心。数据采集的过程得到了伦理委员会的批准和患者的知情同意。
3.2 心电信号的采集采集数据所使用的系统是由上海微创电生理医疗科技股份有限公司独立自主研发的三维心脏电生理标测系统。该系统采样率为2 000 Hz,可以实时获取多路心电信号。
3.3 试验信号的选取CS标测导管放置于冠状静脉窦中。该位置位于心房与心室之间,相比于PV标测导管可以更全面的反映心房的信号变化,且这一放置位置在手术过程中保持固定不变[13]。CS导管上共10个电极,均匀地分布于导管头端5厘米内,通过这10个电极可获取5路双极信号。这些信号是本文的重点分析对象之一。
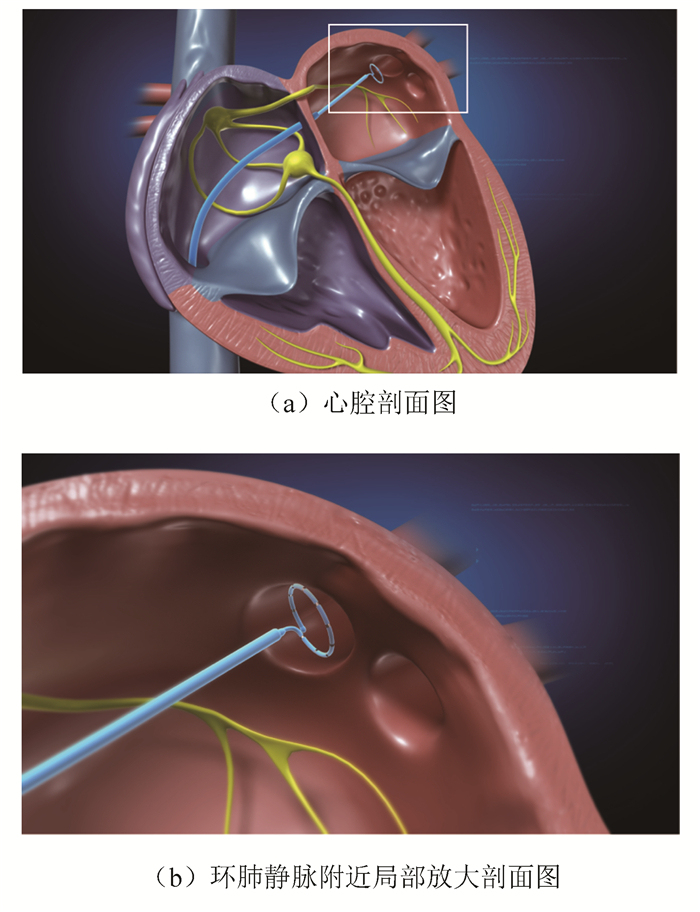
PV标测导管放置于环肺静脉附近。其具体位置如下(见图 3)。医生在进行环肺静脉隔离时需要观察PV导管信号,用以判断环肺静脉隔离是否完成。同时环肺静脉附近也被普遍认为是房颤最主要的触发灶[11-12]。
|
图 3 PV标测导管位置示意图 Figure 3 Diagram of PV calibration catheter location |
本文的研究重点是观测PV、CS标测导管采集信号的DF特性之间的区别与联系,为揭示房颤机理提供帮助。
4 数据处理及分析本文所有程序在win10环境下运行,处理器品牌型号为intel i5-7 500,内存大小为16 GB。本文使用Matlab(版本为R2016a)编写相应程序,并将采集到的数据导入程序,绘制出相关图形及其他结果进行对照分析。
本文选取20例患者的消融手术数据进行研究,其中有17位患者为持续性房颤患者,并且他们在手术过程中保持房颤。为了更客观地进行实验,本文从这17位患者手术正式开始直至恢复窦性心律前,等比例选取30组数据,每组数据采样时间为10 s。同时从剩余3例患者中选取了12段房颤片段,每段采样时间10 s。通过比较发现,患者的CS、PV的DF之间既存在一致性又存在差异性。并且随着手术进行,两者DF之间的关联性也会发生变化。
本文归纳出4种典型类型:A类型,CS、PV信号的DF一致;B类型,CS信号的部分峰值频率与PV信号的DF一致;C类型,CS信号的DF与PV信号的次高峰频率一致;D类型,CS、PV信号的DF不一致。
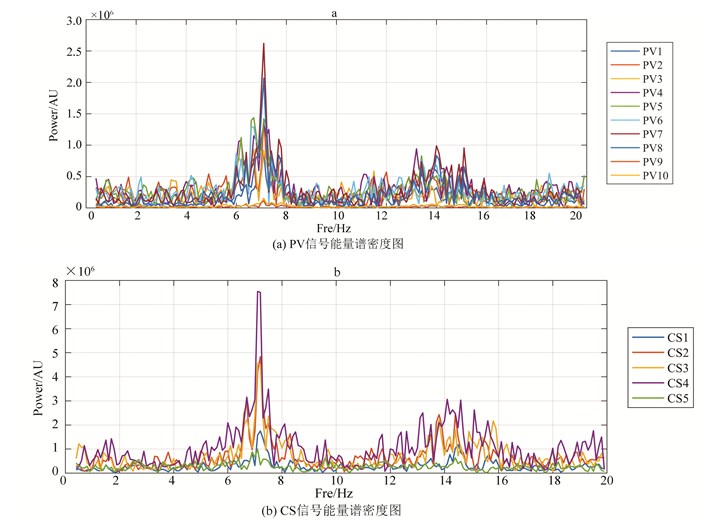
4.1 CS、PV信号的DF一致本文通过比较CS与PV的信号,发现CS、PV的DF存在一致的情况。如图 4(a)、(b)所示,图 4(a)为某患者的10路PV标测导管信号0.5 Hz至20 Hz的能量谱密度图;图 4(b)为该患者的5路CS标测导管信号0.5 Hz至20 Hz的能量谱密度图。采样率为2 000 Hz,采样时间为10 s(下文绘制的能量谱密度图均按上述规则)。从图中可以清晰地看到PV、CS信号中均含有7.1 Hz的DF。
|
图 4 某患者PV、CS信号能量谱密度图,CS、PV信号的DF一致 Figure 4 Maps for energy spectral density of PV and CS signals of a patient (CS and PV signals are consistent with DF signal) |
这证明房颤患者房颤时其PV中不但含有高频DF,并且该DF同时存在于CS中。说明患者房颤时心内确实存在高频DF,并且该DF可能经由PV传导至心房,或经由其他位置传导至PV和心房。
4.2 CS信号的部分峰值频率与PV信号的DF一致本文还在病例中发现CS信号的部分峰值频率与PV信号的DF一致的情况。如图 5(a)、(b)所示,CS能量谱密度图中,存在6.0 Hz和6.4 Hz两个峰值频率。其中6.0 Hz为DF,与PV的DF有对应关系,但次高的峰值频率6.4 Hz在PV中却没有对应信号。说明当前标测的PV里存在DF能影响到CS,但同时CS也受到其他位置传导过来的高频信号的影响。

|
图 5 某患者PV、CS信号能量谱密度图,CS信号的部分峰值频率与PV信号的DF一致 Figure 5 Maps for energy spectral density of PV and CS signals of a patient(partial peak frequency of CS signal is consistent with the DF of PV signal) |
由此可以推断,房颤时其CS的峰值频率可能来自多个PV,甚至来自心腔其他位置。说明确实存在触发病灶产生的DF能够传导至心房的,并且该DF并没有传导至PV。所以仅仅在手术中标测PV很难捕捉到那些潜在的触发病灶。
4.3 CS信号的DF与PV信号的次高峰频率一致本文还在病例中发现CS信号的DF与PV信号的次高峰频率一致的情况。如图 6(a)、(b)所示,在PV能量谱密度图中,有6.9 Hz和7.8 Hz的峰值频率。但在CS能量谱密度图中,只存在6.9 Hz的DF。说明当前标测的PV里只有次高的6.9 Hz的峰值频率传导至CS,而7.8 Hz的DF却没能影响CS。
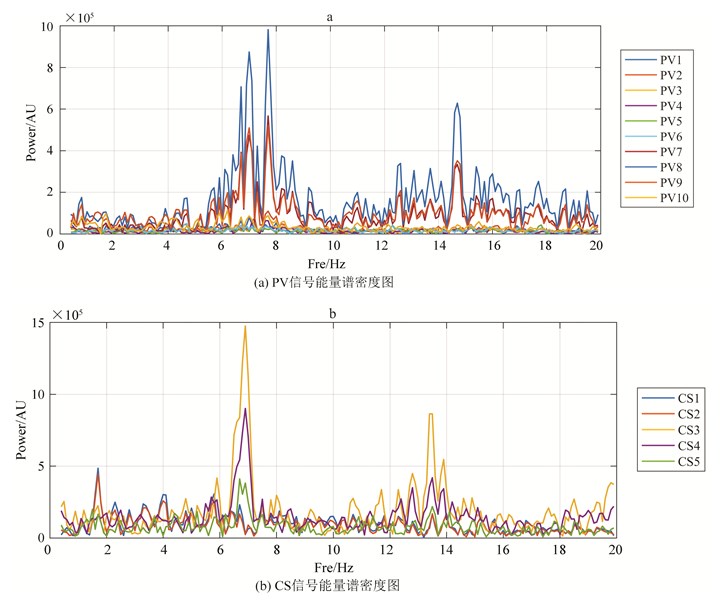
|
图 6 某患者PV、CS信号能量谱密度图,CS信号的DF与PV信号的次高峰频率一致 Figure 6 Maps for energy spectral density of PV and CS signals of a patient(DF of CS signal is consistent with the second summit frequency of PV signal) |
由此可以猜测房颤时其PV的次高峰值频率有时对CS的影响可能大于PV的DF。这说明在PV位置若存在两个甚至多个不同峰值频率的信号时,能够真正影响心房活动的可能只是其中一部分信号。并且这一部分信号不一定需要在PV中占主导地位。我们由此可以推测这类情况下驱动房颤的病灶并不完全来自当前标测PV。
4.4 CS、PV信号的DF不一致本文还在病例中发现CS、PV信号的DF完全不一致的情况。如图 7(a)、(b)所示,PV能量谱密度中存在5.8 Hz的DF,但CS的DF为7.1 Hz。其余频率信号也不存在明显对应关系。说明当前标测的PV信号里虽然存在明显的高频DF,但该DF并没有影响CS。
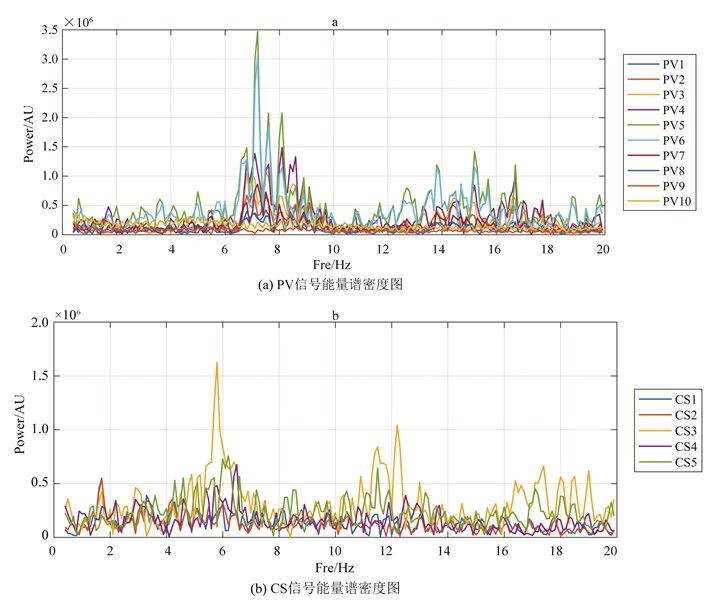
|
图 7 某患者PV、CS信号能量谱密度图,CS、PV信号的DF不一致 Figure 7 Maps for energy spectral density of PV and CS signals of a patient(CS and PV signals are inconsistent with DF signal) |
这一现象说明,房颤时,并不是所有的PV的DF信号都能影响CS。由此可推断,即使某些部位能产生高频的DF,但该DF不一定能够影响心房活动,所以该部位不一定是房颤的触发病灶。
4.5 统计分析经统计,17例持续性房颤患者其CS、PV信号对应类型具体分布情况及手术结果见图 8,剩余3例患者的12例数据,有7段属于A,5段属于B,其手术结果均为成功。图 8中A、B、C、D表示对应4种类型,A+B表示出现A和B类型的合计次数, E表示未能成功提取出明显DF。经复查E片段原始信号,发现大部分对应信号质量不佳或正在进行射频治疗,故无法正常提取DF。手术成功是指经过手术治疗后一年内无房颤复发,反之则为手术失败。房颤复发是指消融3个月后发生房颤、房扑、房速且持续时间大于等于30s[20]。
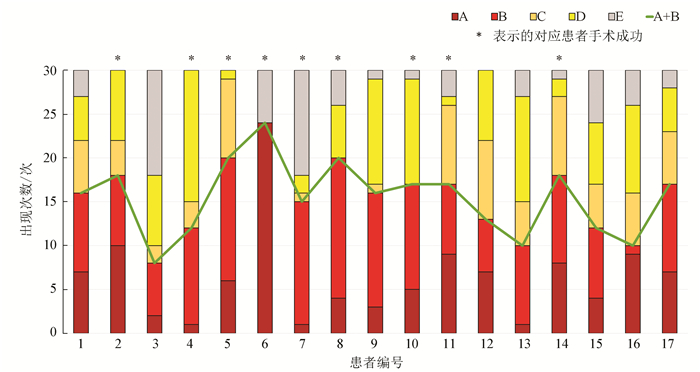
|
图 8 十七例患者信号对应类型分布图及手术结果 Figure 8 Histogram for types corresponding to signals and surgical results of 17 patients |
通过上文对4种典型类型的介绍,我们不难理解当CS、PV两者呈现A、B两种状态时,说明两者联系紧密,PV信号更有可能影响CS信号,所以传统的肺静脉隔离术式效果应当更加显著;当CS、PV两者呈现C、D两种状态时,说明两者联系较弱,PV信号对CS信号的影响有限,甚至不能影响CS信号,所以传统的肺静脉隔离术式可能效果较差。
根据上述推测,若患者的A+B值较大,其手术的成功率应当更高。为了进一步验证上述推测,我们根据手术结果将17例患者分为手术成功组和手术失败组(见表 1),对其A+B的数值进行统计学分析。经过T检验,计算出P < 0.01。说明手术成功组和手术失败组之间的A+B值确实存在显著统计学差异。由此可以证明若患者的A+B值较大,其手术成功率更高。
| 表 1 手术成功、失败组的A+B值统计表 Table 1 Statistical table for A + B in surgical success group and surgical failure group |
由于本实验是回顾性实验,在手术过程中,施术者会根据手术需要调整PV标测导管的位置,这会给统计引入一定误差。尽管如此,上述统计结果仍具有相当程度的科学性,能够从一定程度上证明上述假设的正确性。
5 结论和展望借助Botteron’s算法及其改进算法,我们发现PV、CS的DF特征存在一定联系与差异。首先,PV信号中确实存在能够影响CS信号的DF。这佐证了环肺静脉消融术式的科学性和必要性。其次,本文也在CS信号中发现存在部分DF并不来自当前标测的PV,由此也说明了进行其他相关补充术式的必要性。
传统基于DF指导的消融术式,会将具有较高频率的DF的区域都认为是潜在病灶区域。但通过实验证明,并不是所有的高频DF都会传导至CS。所以关注与CS、心房有一致频率的DF的区域,可能会有利于提高消融手术的效果,并且可避免一些不必要的消融。
另外我们也发现同一时刻,10路PV或5路CS彼此之间有时也存在较大差异,希望可以在今后的研究中进一步探究这些差异的临床意义。
致谢 特别致谢心电医师王蜜蜜、主任医师储慧民、电生理工程师王路为本研究提供的巨大帮助。
| [1] |
胡盛寿, 高润霖, 刘力生, 等.中国心血管病报告2017[Z].北京: 中国大百科全书出版社, 2017. ISBN: 978-7-5202-0215-2. HU Shengshou, GAO Runlin, LIU Lisheng, et al. Report on cardiovascular diseases in China 2017[Z]. Beijing: Encyclopedia of China Publishing House, 2017. ISBN: 978-7-5202-0215-2. (  0) 0) |
| [2] |
CALKINS H, HINDRICKS G, CAPPATO R, et al. WITHDRAWN: 2017 HRS/EHRA/ECAS/APHRS/SOLAECE expert consensus statement on catheter and surgical ablation of atrial fibrillation[J]. Journal of Arrhythmia, 2017, 50(6): 1-55. DOI:10.1016/j.joa.2017.05.001 (  0) 0) |
| [3] |
李梦梦, 马长生. 2017年HRS_EHRA_ECAS_APHRS_SOLAECE心房颤动导管消融和外科消融专家共识解读[J]. 中国循环杂志, 2017, 11(32): 7-10. DOI: 10.3969/j.issn.1000-3614.2017. LI Mengmeng, MA Changsheng. Understanding and interpreting WITHDRAWN: 2017 HRS/EHRA/ECAS/APHRS/SOLAECE expert consensus statement on catheter and surgical ablation of atrial fibrillation[J]. Chinese Circulation Journal, 2017, 11(32): 7-10. DOI: 10.3969/j.issn.1000-3614.2017. (  0) 0) |
| [4] |
钱永军, 肖锡俊. 2017STS外科治疗心房颤动临床实践指南中文版及解读[J]. 中国胸心血管外科临床杂志, 2017, 24(4): 249-253. QIAN Yongjun, XIAO Xijun. Chinese version and interpretation of clinical practice guide for surgical treatment of atrial fibrillation by STS in 2017[J]. Chinese Journal of Clinical Thoracic and Cardiovascular Surgery, 2017, 24(4): 219-253. DOI:10.7507/1007-4848.201703002 (  0) 0) |
| [5] |
KUMAGAI K, MINAMI K, KUTSUZAWA D, et al. Efficacy of atrial substrate modification based on dominant frequency of paroxysmal atrial fibrillation[J]. Journal of Arrhythmia, 2016, 32(3): 212-217. DOI:10.1016/j.joa.2016.02.005 (  0) 0) |
| [6] |
KUMAGAI K, NAKANO M, KUTSUZAWA D, et al. The efficacy of ablation based on the combined use of the dominant frequency and complex fractionated atrial electrograms for non-paroxysmal atrial fibrillation[J]. Journal of Cardiology, 2016, 67(6): 545-550. DOI:10.1016/j.jjcc.2015.07.010 (  0) 0) |
| [7] |
LI X, SALINET J L, ALMEIDA T P, et al. An interactive platform to guide catheter ablation in human persistent atrial fibrillation using dominant frequency, organization and phase mapping[J]. Computer Methods and Programs in Biomedicine, 2017, 141: 83-92. DOI:10.1016/j.cmpb.2017.01.011 (  0) 0) |
| [8] |
LIN Y J, TAI C T, KAO T, et al. Frequency analysis in different types of paroxysmal atrial fibrillation[J]. Journal of the American College of Cardiology, 2006, 47(7): 1401-1407. DOI:10.1016/j.jacc.2005.10.071 (  0) 0) |
| [9] |
YOSHIDA K, CHUGA A, GOOD E, et al. A critical decrease in dominant frequency and clinical outcome after catheter ablation of persistent atrial fibrillation[J]. Heart Rhythm, 2010, 7(3): 295-302. DOI:10.1016/j.hrthm.2009.11.024 (  0) 0) |
| [10] |
RIETA J, CASTELLS F, SANCHEZ C, et al. Atrial activity extraction for atrial fibrillation analysis using blind source separation[J]. IEEE Transactions on Bio-Medical Engineering, 2004, 51(7): 1176-1186. DOI:10.1109/TBME.2004.827272 (  0) 0) |
| [11] |
马长生, 刘兴鹏, 王勇, 等. 起源于肺静脉的局灶性心房颤动的电生理特征和射频消融治疗[J]. 中华心律失常学杂志, 2000, 4(1): 18-22. MA Changsheng, LIU Xingpeng, WANG Yong, et al. Electrophysiological characteristics and effects of radiofrequency ablation of focal atrial fibrillation originating from the pulmonary veins[J]. Chinese Journal of Cardiac Arrhythmias, 2000, 4(1): 18-22. DOI:10.3760/cma.j.issn.1007-6638.2000.01.004 (  0) 0) |
| [12] |
马坚, 唐恺, 麻付胜, 等. 环肺静脉电隔离术后房性快速心律失常的机制和再消融治疗[J]. 中华心律失常学杂志, 2007, 11(2): 118-123. MA Jian, TANG Kai, MA Fusheng, et al. Mechanisms of recurrent atrial tachyarrhythmias after circular pulmonary veins isolation and the outcome of repeat ablation[J]. Chinese Journal of Cardiac Arrhythmias, 2007, 11(2): 118-123. DOI:10.3760/cma.j.issn.1007-6638.2007.02.009 (  0) 0) |
| [13] |
唐恺, 马坚, 张澍, 等. 冠状静脉窦的解剖和电生理[J]. 中华心律失常学杂志, 2005, 9(4): 313-316. TANG Kai, MA Jian, ZHANG Shu, et al. The anatomy and electrophysiology of the coronary sinus[J]. Chinese Journal of Cardiac Arrhythmias, 2005, 9(4): 313-316. (  0) 0) |
| [14] |
CASTELLS F, CERVIGON R, MILLET J. On the preprocessing of atrial electrograms in atrial fibrillation: Understanding Botteron's approach[J]. Pacing Clinical Electrophysiology, 2014, 37(2): 133-143. DOI:10.1111/pace.12288 (  0) 0) |
| [15] |
NG J, GOLDBERGER J. Understanding and interpreting dominant frequency analysis of AF electrograms[J]. Journal of Cardiovascular Electrophysiology, 2007, 18(6): 680-685. DOI:10.1111/j.1540-8167.2007.00832.x (  0) 0) |
| [16] |
LI Wenhai, YANG Cuiwei, WANG Yanlei, et al. Several insights into the preprocessing of electrograms in atrial fibrillation for dominant frequency analysis[J]. BioMedical Engineering OnLine, 2016, 15(1): 38. DOI:10.1186/s12938-016-0157-2 (  0) 0) |
| [17] |
NG J, KADISH A, GOLDBERGER J. Technical considerations for dominant frequency analysis[J]. Journal of Cardiovascular Electrophysiology, 2007, 18(7): 757-764. DOI:10.1111/j.1540-8167.2007.00810.x (  0) 0) |
| [18] |
TⅡNANEN S, NOPONEN K, TULPPO M, et al. ECG-derived respiration method: Adapted ICA and PCA[J]. Medical Engineering & Physics, 2015, 37(5): 512-517. DOI:10.1016/j.medengphy.2015.03.004 (  0) 0) |
| [19] |
吴建, 李康, 庞宇, 等. 基于差分阈值与模板匹配的心电R波提取算法[J]. 重庆邮电大学学报(自然科学版), 2015, 27(3): 372-376. WU Jian, LI Kang, PANG Yu, et al. Algorithm of ECG R-wave extraction based on differential threshold and template matching[J]. Journal of Chongqing University of Posts and Telecommunications(Natural Science Edition), 2015, 27(3): 372-376. DOI:10.3979/j.issn.1673-825X.2015.03.014 (  0) 0) |
| [20] |
黄从新, 张澍, 黄德嘉, 等. 心房颤动:目前的认识和治疗建议(2018)[J]. 中华心率失常学杂志, 2018, 22(4): 279-346. HUANG Congxin, ZHANG Shu, HUANG Dejia, et al. Algorithm of ECG R-wave extraction based on differential threshold and template matching[J]. Chinese Journal of Cardiac Arrhythmias, 2018, 22(4): 279-346. DOI:10.3760/cma.j.issn.1007-6638.2018.04.002 (  0) 0) |
 2019, Vol. 17
2019, Vol. 17


