随着人们生活水平提高、饮食结构变化和环境恶化等因素的影响,目前血栓性心脑血管性疾病已经严重危害人类的健康,不但发病率逐年增加,而且是致残率和死亡率最高的疾病之一,所以医学行业对相关血栓病的治疗和预防药物一直非常重视。人体一般正常情况下,凝血系统、抗凝血系统及纤溶系统在体内共同作用,保持动态平衡。当血液中凝血系统被不适当激活、或凝血-抗凝血体系中任一环节出现调节障碍,就容易引发血栓形成[1]。血栓药物对于血栓栓塞性疾病的预防与治疗, 其临床用药作用机制主要分为抗血小板凝集、抗凝和溶栓三大类,其中前两种是预防性的,后一种是治疗已经发作的血栓。
血小板凝集是正常凝血中的一个关键环节, 血小板的粘附、聚集和释放反应是伤口止血的正常过程,由于是级联激活,所以简称“凝血瀑布”。动脉粥样硬化斑块破裂、严重感染和分娩有时也会开启这个过程,引起心脑梗、弥漫性凝血和羊水栓塞。从血小板发生聚集作用的机制来看, 抗血小板凝集药主要分为四类:(1)抑制环氧合酶和花生四烯酸代谢产物的药物,如口服的阿司匹林;(2)增加血小板内CAMP含量的药物,如潘生丁等;(3)作用于血小板膜特异激动剂和受体的药物,如氯吡格雷;(4)抑制血小板活化因子(PAF)药物,如银杏叶等。
抗凝药是指能降低机体的凝血功能、防止血栓形成或进一步发展的药物。在多种生理及病理状态下, 人体凝血活性可显著增强, 如房颤患者的血液瘀滞,表现为某些凝血因子水平升高或活性增加, 而高凝状态是血栓性疾病的发病基础。常用的抗凝药物注射类有肝素,口服的有华法林、利伐沙班等,还包括重组水蛭素衍生物和L-精氨酸衍生物。一般都是作用于凝血过程中的凝血因子,控制凝血过程,而不是针对已经形成的血栓。
纤溶系统是降解已经形成的血栓的体系(见图 1),包括纤溶酶原、组织型纤溶酶原激活物、尿激酶型纤溶酶原激活物、纤溶酶原激活物抑制剂几种物质。纤溶酶原在纤溶酶原激活剂的作用下,变成有活性的纤溶酶,纤溶酶作用于纤维蛋白凝块,从精氨酸-赖氨酸键位置分解,得到可溶性的纤维蛋白降解产物,以保持血管通畅,防止血栓进一步扩大。
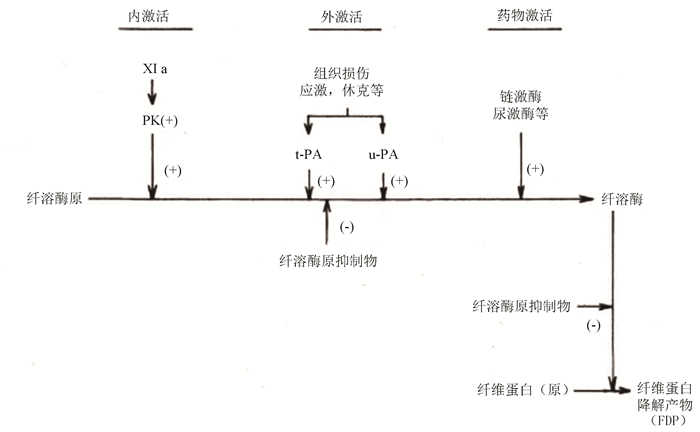
|
图 1 纤溶酶降解纤维蛋白示意图 Figure 1 Schematic diagram of the degradation of fibrous protein by fibrinolytic enzyme |
抗血小板和抗凝血两类药物只能抑制或者预防血栓的形成, 而不能从根本上溶解血栓[2-3]。溶栓药物主要用于已形成的血栓, 因此溶栓治疗是目前临床界治疗血栓性疾病最为重要、有效且可靠的手段。纤溶酶作为治疗血栓性疾病的主要溶栓药物, 一直倍受药物开发者的高度关注。科研人员在人体、动物、植物和微生物中陆续发现了多种具有溶栓活性的成分, 有些已经在临床上使用,有些纤溶酶的基因序列进行了生物学的改造,这为寻找新型、高效的溶栓药物提供了更多的思路,本文主要针对国内外发表的纤溶酶生物来源和特性进行了总结,并对产纤溶酶的微生物种群进行了分类比较。
1 来源于人体组织的溶栓药物溶栓酶可来源于人体, 比如人体内的子宫、肾脏、肺组织,以及癌细胞培养组织,都可以产生纤溶酶,其中开发最早、处理工艺最成熟的是来源于健康人尿液的尿激酶(UK),后来采用细胞培养开发了尿激酶纤溶酶原激活剂(uPA)和组织纤溶酶原激活剂(t-PA)等。
1.1 尿激酶(Urokinase,UK)尿激酶是从健康人尿或肾组织培养液中获得的丝氨酸蛋白酶,有两种,分子量分别是33 KD和54 KD。尿激酶可以直接作用于纤维蛋白凝块,也可以影响内源性纤维蛋白溶解系统, 催化裂解纤溶酶原成纤溶酶, 从而发挥溶栓作用。尿激酶溶栓能力强且毒性很低, 临床使用过程中也罕见过敏反应,是现在临床治疗急性血栓的主要药物之一。但是尿激酶缺乏溶栓特异性, 有导致出血的危险,临床应用要严密的监护。目前医院临床还在为急性血栓患者使用,国内厂家有北京赛生药业有限公司。
1.2 尿激酶纤溶酶原激活剂(uPA)和组织纤溶酶原激活剂(t-PA)尿激酶型纤溶酶原激活剂是尿激酶的前体, 是一种丝氨酸蛋白水解酶, 主要由健康人尿、血液或条件培养液中提取或者基因重组得到,可激活纤溶酶原转变为纤溶酶, 同时能够降解血栓中的水不溶纤维蛋白形成水溶性降解片断, 从而使血栓溶解。组织型纤溶酶原激活剂, 又称纤溶酶原激活因子(Tissue plasminogen activator), 属于丝氨酸蛋白酶类, 可特异性水解纤溶酶原中精氨酸-赖氨酸之间的肽键, 从而能使纤溶酶原转变为纤溶酶。这两种药物溶栓特异性较强, 极大的减小了因系统纤溶活性导致的出血, 同时还具有抗血小板凝集的作用, 但是体内半衰期都较短[4]。临床药物有阿替普酶和瑞替普酶,生产技术一般采取基因克隆细胞培养,工艺和设备要求比较高,所以市场价格一直不低。
2 来源于动物组织的溶栓药物 2.1 蚓激酶(Vermis kinase)蚯蚓在药学上称地龙,蚓激酶是日本的Mihara首先从特种蚯蚓中提取的一组蛋白水解酶, 分子量23~30 KD,具有纤溶和抗凝的作用[5]。蚓激酶可以直接降解纤维蛋白, 也可以激活纤溶酶原,具有直接和间接溶栓功能;也可吸附凝血因子, 并将其水解, 具有间接抗凝的作用。对于蚓激酶的安全性,Tjandrawinata等[6]对于蚓激酶DLBS1033口服剂量进行了临床安全性评价,研究表明DLBS1033以每日490 mg的剂量分3次给予,在健康成人中是安全的。这说明蚓激酶具有良好的生物安全性,值得深入研究开发[7]。
蚓激酶是一组群蛋白的总称,有些科研人员进行了分离纯化的研究,到目前报道的蚓激酶成分超过20种,并且口服蚓激酶具有溶栓和抗凝的效果,所以推测一般的蚓激酶提取物除了蛋白成分复杂,还可能具有糖类或其他小肽类成分,可以抵抗胃酸环境对蚓激酶的影响。国内口服蚓激酶产品于1992年上市,如国内的百奥、博洛克、普恩复和降宁蚓激酶都采用肠溶胶囊。蚓激酶口服的效果虽然出血性小,费用低,但是作用相对较慢,静脉或注射的针剂开发是其发展方向之一。
2.2 蛇毒抗栓酶类李时珍的《本草纲目》就有蝮蛇能治疗半身枯死的叙述。上世纪60年代国外从蝮蛇毒液中提取到了有纤溶活性的酶,80年代国内开始提取研究,命名为降纤酶或降纤酶(Defibrinogenase), 并且于1995年颁布了国家标准[8]。蛇毒抗栓酶能直接溶解血栓纤维蛋白和纤维蛋白原,从而降低血液黏度, 同时可抑制血小板聚集。因而具有溶栓、去纤和抗凝的作用, 不良反应有出血倾向和其它脏器的受损可能性。日本的东菱精纯抗栓是从巴西矛头蛇毒液中提取,可以用于急性脑梗和闭塞性缺血;2001年曹郁等将TSV-PV基因插入供体质粒pFastBacHTa中并在Tn-5B1-4细胞中表达,经过Western及酶活检测表明,TSV-PV蛋白在昆虫细胞内的表达具有较高的活性,为天然溶栓药物的制备提供了新来源[9]。蛇毒抗栓酶由于来源特殊,多采用基因重组的方法制备。由于制备工艺不一,质量控制有难度,并且对其它脏器具有不良作用较多,所以临床使用一般用于急症或重症病例,少于其它同类溶栓药物的应用。
2.3 吸血蝙蝠唾液纤溶酶原激活剂吸血蝙蝠唾液纤溶酶原激活剂最早是美国西点军校研究室从南美吸血蝙蝠唾液中分离的,一种能与纤维蛋白特异性结合的高分子蛋白(Bat-PA),其溶栓能力与组织纤溶酶原激活剂相同, 但纤维蛋白的特异性较高且免疫原性极低[10]。吸血蝙蝠唾液纤溶酶原激活剂半衰期较长, 用量少, 但由于吸血蝙蝠是稀有物种, 其消耗性研究受到了严格的控制, 因此重组蛋白是其应用开发的主要研究方向。Ma等[11]在吸血蝙蝠唾液中鉴定出一种新型溶栓酶Desmolaris, 在抗血栓形成中起重要作用,同时能够对多巴胺引起的血管通透性增加有缓解作用,是一种新型的靶向抗凝血剂。西南大学的刘堰和苏畅等进行了DSPAa1在毕赤酵母中的表达研究[12],但是目前还是处于实验室阶段。
2.4 水蛭素(Hirudin)早在17世纪欧洲医学工作者就发现了水蛭的抗凝血作用,成分分离后命名为水蛭素,含有65-66个氨基酸的多肽链,分子量约7 KD。水蛭素与凝血酶可以形成非共价可逆性复合物, 是目前最安全的天然凝血酶抑制剂[13]。但是天然水蛭素来源有限, 所以现在大多采用基因重组的手段获得。1986年RP Harvey首次在大肠杆菌中表达,获得重组水蛭素(r-HVZ);国内的谭树华等在水蛭素基因克隆方面研究较早,并且在毕赤酵母和乳酸菌表达水蛭素成功[14]。现在关于水蛭素的研究主要在鼻腔给药方面,因为水蛭素口服效果吸收很差。
2.5 来源于动物的纤溶酶分类比较纤溶酶可来源于动物,作用方式不尽相同,且各有优势和不足,其对比见表 1。
| 表 1 产纤溶酶的动物种类 Table 1 Animal types of fibrinolytic enzymes |
微生物种类繁多, 生长繁殖快, 而且易于培养, 生长条件较易控制, 是溶栓药物的重要来源。作用机理不同微生物来源的溶栓药物可分为两类:(1)纤溶酶原激活剂, 如链激酶(SK)、葡激酶(SaK), 其作用原理是将纤溶酶原激活成为纤溶酶, 纤溶酶再降解构成血栓骨架的纤维蛋白, 从而溶解血栓;(2)纤溶酶类物质, 可以直接降解血栓中的纤维蛋白, 如纳豆激酶(NK), 以及来源于芽孢杆菌、粪链球菌、链酶菌等的纤溶活性物质。当前微生物溶栓药物不仅可以从自然界中筛选, 还可以通过改造的基因工程菌, 提高生产效率和溶栓作用的专一性。
3.1 链激酶(Streptokinase, SK)链激酶是于1949年发现的由β-溶血链球菌(Streptococcus homolyticus,也称乙型溶血链球菌)分泌的一种胞外酶, 是最早应用于临床的纤溶酶原激活剂,分子量约47~50 KD。链激酶进入血液后, 须与纤溶酶原结合, 使纤溶酶原活化位点暴露, 从而使纤溶酶原成为有活性的纤溶酶。纤溶酶可以迅速降解纤维蛋白原成小分子产物, 使这些降解产物不能参与血纤维网的形成过程, 从而阻碍血栓形成;同时纤溶酶可以通过降解纤维蛋白, 使血栓溶解[15]。经临床应用表明, 链激酶高效且价廉, 但是半衰期短, 容易引起过敏和抗原性抗体反应。为了使链激酶的应用更具安全性和有效性, 现在使用基因重组的方法制备SK,取得一定的进展。
3.2 葡激酶(Staphylokinase, SaK)葡激酶是由金黄色葡萄球菌分泌的一种胞外蛋白质水解酶, 分子量为16.5 KD。葡激酶的作用机制与链激酶相似, 也是一种间接纤溶酶原激活物。SaK具有极强的纤维蛋白特异性, 且临床使用过程中未见过敏反应。但由于葡激酶来源于细菌, 仍具有一定的潜在免疫原性, 最初的动物实验发现出血倾向和毒副作用较大,造成对其研究一度沉寂。随着基因工程的发展, 克隆Sak基因在大肠杆菌中获得高效表达,重组SaK特异性高易于大量制备, 且无变态反应, 价格相比tPA低廉许多。
3.3 纳豆激酶(Nattokinase, NK)纳豆激酶是1987年日本的Sumi首先在纳豆(日本的一种传统食品)中发现的一种具有溶栓活性的丝氨酸蛋白酶, 是一种起步晚但发展迅速的溶栓剂。纳豆激酶不仅可以直接溶解血栓, 而且可激活血浆中的纤溶酶原。纳豆激酶的纤维蛋白原水解活性远低于纤溶酶和尿激酶, 这表明纳豆激酶在发挥纤溶作用的同时, 不水解血浆蛋白原, 因此不易引起出血。纳豆激酶生产成本低, 溶栓能力强, 半衰期长, 安全性高, 具而有很大的开发价值。国内研究纳豆激酶较早的是东北农业大学的徐仲等,测定了湿纳豆的酶活性是1 600 IU/g;南京工业大学的熊晓辉等[16]和河北省科学院生物研究所的董超等[17]通过优化发酵技术,酶活水平都达到了2 200 IU/ml以上;北京大学基础医学院韩慧明, 李咏梅已通过构建工程菌使纳豆激酶基因在大肠杆菌中表达[18]。但是到目前为止,尚未有关于纳豆激酶的注册药物上市,大多以保健食品形式销售。
3.4 链霉菌产生的新型纤溶酶以放线菌产纤溶酶的报道很少,链霉菌属的一些菌株可以产生丝氨酸蛋白酶,因此利用链霉菌产生的新型纤溶酶来制备溶栓药物可能是一种新的尝试。
链霉菌是以产抗生素引起人们关注,但是关于分泌纤溶酶的研究不是太多。1996年法国血液病研究所的F.bono等从一株链霉菌中得到纤溶酶,分子量约33 KD,等电点pH 6.7;印度的Chitte和Ratnakar等从高温温泉中分离得到的链霉菌SD5可以分泌一种耐高温的具有溶栓作用的蛋白酶。该酶可以特异性地裂解纤溶酶原的肽键使其转变为纤溶酶。该酶在37~60 ℃和pH值6.0~9.0时稳定性较高, 由于范围比较宽, 有可能规模生产的成本较低[19-20]。朝鲜大学药学院P.Mander等从链霉菌CS624和684中分别得到了分子量18 KD和35 KD的纤溶酶,并且后一种还可以耐受高温,在45 ℃酶活最高,确定是丝氨酸蛋白酶[21-22]。
1999年中国医学科学院的王骏等从云南土壤筛选得到的链霉菌Y405可产多种纤溶活性物质, 其中有一种新型具有纤溶活性的蛋白酶-SW1,经研究表明, 它不是一种纤溶酶原激活剂, 而可以直接降解血栓中的纤维蛋白,效果与同剂量的尿激酶相当[23]。2001年中国医学科学院和中国协和医科大学龚勇等从链霉菌C3662中分离出一种分子量约为30 KD的具有纤溶活性的蛋白酶, 并使用鸟枪法对该纤溶酶基因进行克隆, 实验结果表明该基因为一种新的基因[24]。河北工业大学的侯正欣等从海洋环境中筛选了一株产纤溶酶的链霉菌,发酵水平可以达到2 190 IU/ml, 但是不具有激活纤溶酶原的作用[25]。
3.5 假单胞菌产生的纤溶酶假单胞菌属是指一群无芽孢、无荚膜的不能发酵糖类的革兰氏阴性杆菌,专性需氧,广泛分布于土壤、水和空气中,是人类或动物的条件致病菌。关于假单胞菌的纤溶酶报道多见于海洋来源的假单胞菌,海洋微生物具有耐盐、耐高压、嗜低温等其独特的生理特性, 是获取新生物活性物质的又一重要来源。由青岛海洋大学刘晨光等报道[26], 从一株海洋假单胞菌中分离制备出一种具有纤溶活性的海洋假单胞菌碱性蛋白酶(MPAP), 研究结果表明, 该酶具有较强的直接溶解纤维蛋白的作用, 静脉用药后, 血栓形成时间明显延长, 血小板聚集率降低[27]。由此说明, MPAP具有明显的抗血栓形成作用。但是对于该酶的结构、催化特征以及毒理药效作用等还需进一步研究, 为进一步开发该酶成为新的溶栓药剂提供科学依据。
3.6 真菌类微生物产的纤溶酶真菌类产纤溶酶的主要包括根霉、木霉、脉孢霉和几种食用菌类。中华根霉12号是国内研究较早的产纤溶酶菌株,来源于传统制酒行业的酒曲中,经过发酵可以产生类似于纳豆激酶的丝氨酸蛋白酶;天津科技大学的孙哲等也从酒曲中筛选得到一株产纤溶酶的根霉,见鉴定为菊芋小孢根霉[28];米曲霉也是食品发酵重点重要菌株之一,高占争等优化了米曲霉的产酶培养基,纤溶酶活性达到98.13 U/ml[29];天津科技大学的江洁等采用t-PA cDNA整合到里氏木霉的一株工程菌,发酵产t-PA进行了研究[30];脉孢霉是一种可以分解纤维素的真菌,在食用菌行业属于污染菌株,齐齐哈尔大学的许爱清等对脉孢霉产纤溶酶菌株进行了诱变育种研究[31];沈阳药科大学的吴黎诚筛选一株植物内生真菌镰孢霉,产纤溶酶约28 KD,与其它纤溶酶无同源性,为丝氨酸蛋白酶和金属蛋白酶[32];台湾的张静如研究了白僵菌所产纤溶酶[33];李华平等从冬虫夏草中提取了纤溶酶CSP,分子量约31 KD,可以直接裂解纤维蛋白,不是纤溶酶原激活剂[34]。蛹虫草产纤溶酶的研究最早见于齐齐哈尔大学的液体深层培养和江苏农业科学院的蛹虫草形态和分子鉴定[35-36],关于食用真菌类的有榆干离褶伞菌和黄绿蜜环菌产纤溶酶的报道[37-38]。
3.7 其它类别单株菌产纤溶酶Vijayaraghavan P从一株海洋希瓦氏菌Shewanella sp.IND20中分离出一株具有纤溶活性的酶[39]。沈阳药科大学的李占强等报道了来源于海洋短小芽孢杆菌的纤溶酶[40]。兰州生物制品研究所的赵红等用产芽孢梭菌培养上清,纯化得到了纤溶酶[41];肖璐等报道了一株产纤溶酶的藤黄微球菌,并且进行了基因克隆研究[42];西北农林科技大学的王高学等再青藏高原冻土内筛选得到一株溶栓菌,鉴定为金黄色杆菌[43],该株菌属于放线菌门。重庆师范大学的和七一等筛选到一株产纤溶酶的粪肠球菌EF608,并进行了发酵工艺优化,纤溶酶活性达到1 833 U/ml[44]。
4 关于产纤溶酶的微生物分类比较细菌和真菌中都有能产生纤溶酶的种类,特别是细菌中种类最多。由于细菌和真菌的多样性,导致同一发酵物的纤溶酶也具有多样性,具体详细比较分别见表 2和表 3。
| 表 2 产纤溶酶的细菌 Table 2 Bacteria that produce fibrinolytic enzymes |
| 表 3 产纤溶酶的真菌 Table 3 Fungi that produce fibrinolytic enzymes |
不论是来源于动物还是微生物的纤溶酶,都属于丝氨酸蛋白酶,是为了自身获得营养而进化的功能蛋白。例如蚯蚓是为了分解营养原料,水蛭、蝙蝠等是为了吸取不凝固的血液,微生物也是为了分解目的蛋白以获得营养和自身繁殖,一些致病细菌或者虫生真菌同样是分解体细胞或虫体蛋白的需要,所以一般也可以分泌纤溶酶。总观各种来源的纤溶酶产物,虽然分子量大小稍有差异,从15~40 KD之间,并且大多数是丝氨酸蛋白酶类,针对基因序列比对(见图 2)和氨基酸序列比较(见图 3)后发现,不同纤溶酶基因序列虽然有很大差异,由于密码子的简并性,翻译出来的氨基酸序列一致性比较高,说明丝氨酸蛋白酶活性功能区域是相对保守的,也符合生物繁衍过程中的趋同进化和趋异进化的理论。

|
图 2 不同菌株纤溶基因序列比对 Figure 2 Comparison of plasmin gene sequences of different strains |

|
图 3 不同菌株纤溶酶氨基酸序列比对 Figure 3 Comparison of plasmin amino acid sequences of different strains |
进一步推测:新发现微生物的菌株产纤溶酶的概率比较高,但是产新型纤溶酶的可能性很低。即便如此,由于微生物发酵具有周期短、成本低的特点, 从不同环境中筛选微生物,并利用分子生物学和基因工程技术进行改造,生产不同作用方式的纤溶酶, 一直还是生物和制药行业关注的热点。
| [1] |
庞兴学, 王显. 血栓形成的过程与机制研究进展[J]. 医学综述, 2011, 17(11): 1613-1616. PANG Xingxue, WANG Xian. Research progress in thrombosis and its mechanism[J]. Medical Recapitulate, 2011, 17(11): 1613-1616. DOI:10.3969/j.issn.1006-2084.2011.11.005 (  0) 0) |
| [2] |
吕翠平, 董小黎. 肺血栓栓塞的治疗进展[J]. 临床荟萃, 2005, 20(14): 836-838. LV Cuiping, DONG Xiaoli. Treatment progress in pulmonary thromboembolism[J]. Clinical Focus, 2005, 20(14): 836-838. DOI:10.3969/j.issn.1004-583X.2005.14.039 (  0) 0) |
| [3] |
LOSI M A, GOLINO P, BETOCCHI S, et al. Massive chronic atrial thrombosis[J]. International Journal of Cardiology, 2003, 90(2): 323-324. DOI:10.1016/S0167-5273(02)00508-9 (  0) 0) |
| [4] |
奉涛. 溶栓药物的临床应用及其进展[J]. 临床合理用药杂志, 2011, 04(17): 145-146. FENG Tao. Advancement and clinical application on thrombolytic[J]. Chinese Journal of Clinical Rational Drug Use, 2011, 04(17): 145-146. DOI:10.3969/j.issn.1674-3296.2011.17.132 (  0) 0) |
| [5] |
NELSON H, SARGENT D J, WIEAND H S, et al. A comparison of laparoscopically assisted and open colectomy for colon cancer[J]. New England Journal of Medicine, 2004, 350(20): 2050-2059. DOI:10.1056/NEJMoa032651 (  0) 0) |
| [6] |
SUMNER-SMITH G. The safety and tolerability of lumbrokinase DLBS1033 in healthy adult subjects[J]. Drug Research, 2016, 66(06): 293-299. DOI:10.1055/s-0035-1569406 (  0) 0) |
| [7] |
梁鹏宇, 潘霞, 任宇豪. 溶栓酶的研究进展[J]. 广西科学, 2017, 24(1): 77-82. LIANG Pengyu, PAN Xia, REN Yuhao. Research progress of thrombolytic enzymes[J]. Guangxi Science, 2017, 24(1): 77-82. DOI:10.13656/j.cnki.gxkx.20170116.002 (  0) 0) |
| [8] |
高春杰, 张爱香, 陈轶暖. 蛇毒酶(抗凝溶栓)制剂的应用研究[J]. 中国医药指南, 2010, 08(19): 235-236. GAO Chunjie, ZHANG Aixiang, CHEN Yinuan. Application of snake venom enzyme (anticoagulant thrombolytic) preparation[J]. Guide of China Medicine, 2010, 08(19): 235-236. DOI:10.3969/j.issn.1671-8194.2010.19.079 (  0) 0) |
| [9] |
曹郁. 蛇毒纤溶酶原激活剂TSV-PA在昆虫细胞中的表达[J]. 生物工程学报, 2001, 17(5): 506-509. CAO Yu. Expression of a snake venom plasminogen activator TSV-PA in insect cells[J]. Chinese Journal of Biotechnology, 2001, 17(5): 506-509. DOI:10.3321/j.issn:1000-3061.2001.05.007 (  0) 0) |
| [10] |
GARDELL S J, DUONG L T, DIEHL R E, et al. Isolation, characterization, and cDNA cloning of a vampire bat salivary plasminogen activator[J]. Journal of Biological Chemistry, 1989, 264(30): 17947. DOI:10.1016/S0005-2728(89)80013-1 (  0) 0) |
| [11] |
MA D, MIZURINI D M, ASSUMPCAO T C F, et al. Desmolaris, a novel factor XIa anticoagulant from the salivary gland of the vampire bat (Desmodus rotundus) inhibits inflammation and thrombosis in vivo[J]. Blood, 2013, 122(25): 4094-4106. DOI:10.1182/blood-2013-08-517474 (  0) 0) |
| [12] |
刘堰, 苏畅, 宋小双, 等. 表达食血蝙蝠唾液纤溶酶原激活剂的毕赤酵母菌株的构建[J]. 生物工程学报, 2009, 25(4): 566-574. LIU Yan, SU Chang, SONG Xiaoshuang, et al. Construction of pichia pastoris strain expressing salivary plasminogen activator from vampire bat (Desmodus rotundus)[J]. Chinese Journal of Biotechnology, 2009, 25(4): 566-574. DOI:10.3321/j.issn:1000-3061.2009.04.015 (  0) 0) |
| [13] |
HILDEBRANDT J P, LEMKE S. Small bite, large impact-saliva and salivary molecules in the medicinal leech, Hirudo medicinalis[J]. Naturwissenschaften, 2011, 98(12): 995-1008. DOI:10.1016/j.radonc.2005.10.002 (  0) 0) |
| [14] |
徐文杰, 谭树华. 乳酸菌表达的重组水蛭素的壳聚糖微粒的口服药效学研究[J]. 药物生物技术, 2014(6): 547-549. XU Wenjie, TAN Shuhua. Oral pharmacodynamics of chitosan particles expressed by lactobacillus recombinant hirudin[J]. Pharmaceutical Biotechnology, 2014(6): 547-549. DOI:10.19526/j.cnki.1005-8915.2014.06.013 (  0) 0) |
| [15] |
丁文惠, 高亢. 基因重组链激酶静脉溶栓治疗急性心肌梗塞临床研究[J]. 中国临床药理学杂志, 2000, 16(4): 259-261. DING Wenhui, GAO Kang. Intravenous thrombolysis in patients with acute myocardial infarction-comparison of the efficacy of gene recombined streptokinase[J]. The Chinese Journal of Clinical Pharmacology, 2000, 16(4): 259-261. DOI:10.3969/j.issn.1001-6821.2000.04.005 (  0) 0) |
| [16] |
熊晓辉, 梁剑光, 熊强. 纳豆激酶液体发酵条件的优化[J]. 食品与发酵工业, 2004, 30(1): 62-66. XIONG Xiaohui, LIANG Jianguang, XIONG Qiang. Optimization of Nattokinase production using liquid fermentation[J]. Food and Fermentation Industries, 2004, 30(1): 62-66. DOI:10.3321/j.issn:0253-990X.2004.01.016 (  0) 0) |
| [17] |
董超, 李楠, 程辉彩, 等. 纳豆激酶发酵条件的优化[J]. 食品科学, 2009, 30(1): 151-154. DONG Chao, LI Nan, CHENG Huicai, et al. Optimization of fermentation conditions for production of Nattokinase[J]. Food Science, 2009, 30(1): 151-154. DOI:10.3321/j.issn:1002-6630.2009.01.036 (  0) 0) |
| [18] |
韩慧明, 李咏梅. 纳豆激酶基因在大肠杆菌中的表达及活性分析[J]. 中国生物工程杂志, 2014, 34(10): 49-54. HAN Huiming, LI Yongmei. Secretory expression of Nattokinase from Bacillus natto in Escherichia coli[J]. China Biotechnology, 2014, 34(10): 49-54. DOI:10.13523/j.cb.20141008 (  0) 0) |
| [19] |
CHITTE R R, DEY S. Potent fibrinolytic enzyme from a thermophilic Streptomyces megasporus strain SD5[J]. Letters in Applied Microbiology, 2010, 31(6): 405-410. DOI:10.1046/j.1365-2672.2000.00831.x (  0) 0) |
| [20] |
CHITTE R R, DEY S. Production of a fibrinolytic enzyme by thermophilic Streptomyces species[J]. World Journal of Microbiology and Biotechnology, 2002, 18(4): 289-294. DOI:10.1023/a:1015252607118 (  0) 0) |
| [21] |
MANDER P, CHO S S, SIMKHADA J R, et al. A low molecular weight chymotrypsin-like novel fibrinolytic enzyme from Streptomyces sp. CS624[J]. Process Biochemistry, 2011, 46(7): 1449-1455. DOI:10.1016/j.procbio.2011.03.016 (  0) 0) |
| [22] |
SIMKHADA J R, MANDER P, CHO S S, et al. A novel fibrinolytic protease from Streptomyces sp. CS684[J]. Process Biochemistry, 2010, 45(1): 88-93. DOI:10.1016/j.procbio.2009.08.010 (  0) 0) |
| [23] |
王骏, 王敏, 王以光. 链霉菌产生的新型纤溶酶的纯化和性质的研究[J]. 生物工程学报, 1999(2): 147-153. WANG Jun, WANG Min, WANG Yiguang. Purification and characterization of novel plasmin from Streptomyces sp[J]. Chinese Journal of Biotechnology, 1999(2): 147-153. DOI:10.1088/0256-307X/15/12/024 (  0) 0) |
| [24] |
龚勇, 王以光. 一种来源于链霉菌的纤溶酶的纯化及其基因的克隆[J]. 微生物学报, 2001, 41(2): 186-190. GONG Yong, WANG Yiguang. Purification and gene cloning of a novel fibrinolytic proteasefrom streptomyces SP. C3662[J]. Acta Microbiologica Sinica, 2001, 41(2): 186-190. DOI:10.3321/j.issn:0001-6209.2001.02.010 (  0) 0) |
| [25] |
侯正欣, 董超, 马萱, 等. 海洋来源链霉菌MY0504产纤溶酶的发酵条件优化[J]. 微生物学通报, 2017, 44(5): 1009-1016. HOU Zhengxin, DONG Chao, MA Xuan. Optimization of fermentation for fibrinolytic enzymeproduction by Streptomyces MY0504 from ocean[J]. Microbiology, 2017, 44(5): 1009-1016. DOI:10.13344/j.microbiol.china.160470 (  0) 0) |
| [26] |
刘晨光, 魏香, 刘万顺. 海洋假单胞菌纤溶酶的酶学性质的研究[J]. 中国海洋大学学报(自然科学版), 2001, 31(5): 730-734. LIU Chenguang, WEI Xiang, LIU Wanshun. Study on characteristics of fibrilytic enzyme from marine pseudomonas[J]. Periodical of Ocean University of China, 2001, 31(5): 730-734. DOI:10.3969/j.issn.1672-5174.2001.05.014 (  0) 0) |
| [27] |
璩竹玲, 刘赛, 刘晨光, 等. 海洋假单胞菌碱性蛋白酶的纤溶及抗血栓形成作用[J]. 青岛大学医学院学报, 2003, 39(2): 156-158. QU Zhuling, LIU Sai, LIU Chenguang. Fibrinolysis and antithrombotic action of alkaline protease of marine pseudomonas sp[J]. Acta Academiae Medicinae Qingdao Universitatis, 2003, 39(2): 156-158. DOI:10.3969/j.issn.1672-4488.2003.02.017 (  0) 0) |
| [28] |
孙哲, 孙瑶, 王海宽. 菊芋小孢根霉固态发酵纤溶酶的工艺优化[J]. 天津科技大学学报, 2013(2): 1-5. SUN Zhe, SUN Yao, WANG Haikuan. Solid-state fermentation of rhizopus microsporus var. tuberosus for production of fibrinolytic enzyme[J]. Journal of Tianjing University of Science & Technology, 2013(2): 1-5. DOI:10.3969/j.issn.1672-6510.2013.02.003 (  0) 0) |
| [29] |
高占争, 李兆坤, 赵允麟, 等. 米曲霉发酵产纤溶酶培养基的优化[J]. 河南工业大学学报(自然科学版), 2007, 28(1): 17-20. GAO Zhanzheng, LI Zhaokun, ZHAO Yunlin, et al. Optimizing the medium of asperillus oryzae strains for prdoucing fibrinolytic enzyme[J]. Journal of Henan University of Technology (Natural Science Edition), 2007, 28(1): 17-20. DOI:10.3969/j.issn.1673-2383.2007.01.005 (  0) 0) |
| [30] |
江洁, 杜连祥, 路福平, 等. 里氏木霉306生物合成组织型纤溶酶原激活剂(t-PA)5L罐分批发酵条件的研究[J]. 食品与发酵工业, 2005, 31(11): 18-21. JIANG Jie, DU Lianxiang, LU Fuping, et al. Study on the batch fermentation conditions of tissue-type plasminogen activator (t-PA) producing by trichoderma reesei 306[J]. Food and Fermentation Industries, 2005, 31(11): 18-21. DOI:10.3321/j.issn:0253-990X.2005.11.005 (  0) 0) |
| [31] |
许爱清, 刘晓兰, 吴耘红, 等. 高产纤溶酶的脉孢霉诱变育种研究[J]. 齐齐哈尔大学学报:自然科学版, 2003(4): 5-7. XU Aiqing, LIU Xiaolan, WU Yunhong, et al. Study on mutagenesis breeding of high fibrinolytic enzyme producing Neurospora sitophila[J]. Journal of Qiqihar University, 2003(4): 5-7. (  0) 0) |
| [32] |
吴黎诚. 镰孢霉CPCC 480097来源的纤溶酶的研究[M]. 沈阳: 沈阳药科大学, 2008. WU Licheng. Study on plasmin from fusarium falciparum CPCC 480097[M]. Shenyang: Shenyang Pharmaceutical University, 2008. (  0) 0) |
| [33] |
张静如.白僵菌纤溶酶(fibrinolytic enzyme)之分离纯化与特性研究[D].台北: 朝阳科技大学生物技术研究所, 2006. ZHANG Jingru. Purification and characterization of fibrinolytic enzymes from beauveria bassiana[D]. Taipei: Institute of Biotechnology, Chaoyang University of Science and Technology, 2006. (  0) 0) |
| [34] |
LI H P, HU Z, YUAN J L, et al. A novel extracellular protease with fibrinolytic activity from the culture supernatant of Cordyceps sinensis: Purification and characterization[J]. Phytotherapy Research, 2007, 21(12): 1234-1241. DOI:10.1002/ptr.2246 (  0) 0) |
| [35] |
陈慧鑫, 刘晓兰, 李巍巍, 等. 蛹虫草深层培养产纤溶酶条件的优化[J]. 食品工业科技, 2010, 31(11): 216-220. CHEN Huixin, LIU Xiaolan, LI Weiwei, et al. Optimization of submerged culture conditions for the production of fibrinolytic enzyme with Cordyceps militaris[J]. Science and Technology of Food Industry, 2010, 31(11): 216-220. (  0) 0) |
| [36] |
崔莉, 董明盛, 陈晓红, 等. 一株纤溶酶产生菌——蛹虫草的形态和分子鉴定[J]. 江苏农业学报, 2010, 26(3): 667-669. CUI Li, DONG Mingsheng, CHEN Xiaohong, et al. Morphological and molecular identificationof a cordyceps militaris producing thrombolytic enzyme[J]. Jiangsu Journal of Agricultural Sciences, 2010, 26(3): 667-669. DOI:10.3969/j.issn.1000-4440.2010.03.044 (  0) 0) |
| [37] |
沈明花, 金成俊. 榆干离褶伞溶栓酶的纯化及酶学性质研究[J]. 食品与发酵工业, 2007, 33(8): 45-47. SHEN Minghua, JIN Chengjun. Purification of fibrinolytic enzyme from cultured mycelia of lyophyllum ulmarium[J]. Food and Fermentation Industries, 2007, 33(8): 45-47. (  0) 0) |
| [38] |
徐德钦, 陈海燕, 章海锋, 等. 黄绿蜜环菌产纤溶酶的发酵条件优化研究[J]. 中国食品学报, 2009, 9(6): 96-103. XU Deqin, CHEN Haiyan, ZHANG Haifeng, et al. Studies on the fermentation condition optimization of fibrinolytic enzyme produced by armiilaria luteo-virens sacc[J]. Journal of Chinese Institute of Food Science and Technology, 2009, 9(6): 96-103. DOI:10.3969/j.issn.1009-7848.2009.06.016 (  0) 0) |
| [39] |
VIJAYARAGHAVAN P, PRAKASH VINCENT S G. A low cost fermentation medium for potential fibrinolytic enzyme production by a newly isolated marine bacterium, Shewanella sp. IND20[J]. Biotechnology Reports, 2015, 7: 135. DOI:10.1016/j.btre.2015.06.005 (  0) 0) |
| [40] |
李占强, 胡江春, 王书锦.响应曲面法优化海洋Bacillus pumilus B5815产纤溶酶培养基[C].杭州: 全国抗生素, 2009. LI Zhanqiang, HU Jiangchun, WANG Shujin. Response surface method was used to optimize Marine Bacillus pumilus B5815 fibrinolytic enzyme production medium[C]. Hangzhou: National Antibiotic, 2009. (  0) 0) |
| [41] |
赵红, 程洁, 陆俭, 等. 产芽孢梭菌纤溶酶的纯化及特性[J]. 中国生物制品学杂志, 2002, 15(1): 27-31. ZHAO Hong, CHENG Jie, LU Jian, et al. Purification and characterization of fibrinolytic enzyme of c.sporogenes strain[J]. Chinese Journal of Biologicals, 2002, 15(1): 27-31. DOI:10.3969/j.issn.1004-5503.2002.01.008 (  0) 0) |
| [42] |
肖璐, 张仁怀, 张义正. 纤溶酶产生菌-藤黄微球菌的筛选、鉴定及纤溶酶基因的克隆[J]. 微生物学通报, 2008, 35(9): 1443-1449. XIAO Lu, ZHANG Renhuai, ZHANG Yizheng. Isolation of a micrococcus luteus strain with producing fibrinolysin and cloning of fibrinolitic enzyme gene[J]. Microbiology, 2008, 35(9): 1443-1449. DOI:10.3969/j.issn.0253-2654.2008.09.018 (  0) 0) |
| [43] |
王高学, 黄海洪, 张明. 一株青藏高原冻土溶栓菌的筛选及鉴定[J]. 微生物学报, 2010, 50(2): 148-154. WANG Gaoxue, HUANG Haihong, ZHANG Ming. Isolation and identification of a fibrinolytic bacterium strain from frozen soil in the Tibetan Plateau[J]. Acta Microbiologica Sinica, 2010, 50(2): 148-154. DOI:10.13343/j.cnki.wsxb.2010.02.008 (  0) 0) |
| [44] |
和七一, 文浩平, 张康, 等. 产纤溶酶菌株粪肠球菌EF608液体发酵工艺优化研究[J]. 食品工业科技, 2012, 33(15): 165-168. HE Qiyi, WEN Haoping, ZHANG Kang, et al. Optimization of fermentation process on a fibrinolytic enzyme from Enterococcus faecalis EF608[J]. Science and Technology of Food Industry, 2012, 33(15): 165-168. (  0) 0) |
 2019, Vol. 17
2019, Vol. 17

