2. 长治医学院 中心实验室,山西 长治,046000;
3. 长治医学院 附属和济医院骨科,山西 长治,046000
2. Central Laboratory of Changzhi Medical College, Changzhi 046000, Shanxi, China;
3. Department of Orthopaedics, Heji Hospital Affiliated to Changzhi Medical College, Changzhi 046000, Shanxi, China
在肿瘤的发生发展和转移过程中,肿瘤干细胞、EMT和细胞多能性都发挥重要作用,晚期恶性肿瘤中EMT还与肿瘤干细胞促进肿瘤生长和转移的过程有关[1-2]。DCLK1能够调控这些复杂的细胞信号通路,推测其可作为潜在的基因治疗靶点,也是一个有价值的诊断和预后标志物。但DCLK1的致癌机制和预后价值尚未完全阐明,针对该分子的基因治疗手段也尚未见报道。
肿瘤干细胞与癌症的复发和转移有关,在癌症发生发展的过程中扮演重要角色。超过50%的结直肠癌患者术后会复发,复发的原因尚不清楚,但耐受化疗和放疗的肿瘤干细胞的存在被认为是癌症复发的主要原因之一[3]。研究发现,DCLK1是结直肠癌等胃肠道肿瘤干细胞的分子标志物[4]。DCLK1高表达的肿瘤细胞有干性特征,比DCLK1低表达的细胞有更强的自我更新能力;干扰DCLK1的表达能够清除肿瘤干细胞,降低癌症复发的可能[5]。
越来越多的研究表明,DCLK1在多种肿瘤细胞中高表达,推测其为致癌基因。Gao等发现DCLK1不仅在结直肠癌组织中高表达,还与癌细胞转移和患者预后差有关,过表达DCLK1能够促进结直肠癌细胞发生上皮间质转化(EMT)[6]。Qu等发现胰腺导管腺癌早期患者血清中DCLK1水平高于正常对照组;使用siRNA或激酶抑制剂沉默DCLK1,能够使EMT途径相关因子表达水平下调。在超过50%的循环肿瘤细胞中可检测到DCLK1的表达,推测DCLK1阳性的肿瘤细胞参与调控EMT过程[7]。Sureban等发现肝硬化和肝癌患者的血浆和上皮间质部分DCLK1表达水平显著高于非肝硬化对照组。在裸鼠肝癌皮下移植瘤模型中,使用siRNA沉默DCLK1能够使肿瘤生长停滞,促进let-7a等肿瘤抑制miRNAs的表达[1]。Vega等发现Barrett食管中DCLK1表达水平升高,Barrett食管可恶化为食管腺癌,提示DCLK1可作为预测食管癌进展的早期分子标志物[8]。
利用生物信息学方法对DCLK1的空间结构和理化性质进行分析,发现DCLK1是碱性不稳定的亲水蛋白,属于TGS超家族和PKc_like超家族,在进化过程中高度保守,无信号肽和跨膜区域。该蛋白定位于细胞核的可能性最大,主要二级结构为无规卷曲。与DCLK1相互作用的蛋白中,NOTCH蛋白、PRDM8和PRUNE2引起关注,预示DCLK1存在更为复杂的致癌机制。本研究通过探讨DCLK1蛋白的结构功能和理化性质,旨在为深入探究该蛋白的作用机制提供思路。
1 材料与方法 1.1 DCLK1蛋白序列的获得使用NCBI数据库(https://www.ncbi.nlm.nih.gov/),以“DCLK1+物种名”为关键词,搜索得到人DCLK1蛋白的氨基酸序列信息。由搜索结果可知DCLK1有多个异构体,本文的分析对象是DCLK1异构体1(Accession number:NP_004725.1)。
1.2 DCLK1系统进化树的构建在NCBI中,使用BLASTp搜索得到DCLK1在不同物种中的同源序列。采用Clustal2.1软件比对DCLK1的氨基酸序列。采用MEGA6软件,Neighbor-joining方法,设置Boot-strap分析重复数为1 000,构建DCLK1的分子进化树[9]。
1.3 DCLK1组织表达特异性、亚细胞定位预测、信号肽与跨膜结构域分析采用NCBI的UniGene数据库中EST结果,预测DCLK1在正常组织和癌变组织中的表达情况。采用PSORTII在线工具(https://psort.hgc.jp/)预测DCLK1的亚细胞定位情况。采用SignalP 4.1(http://www.cbs.dtu.dk/services/SignalP/)分析DCLK1有无信号肽,TMHMM 2.0工具(http://www.cbs.dtu.dk/services/TMHMM/)分析DCLK1有无跨膜区域。
1.4 DCLK1理化性质分析采用ExPASy数据分析系统中的ProtParam(http://web.expasy.org/protparam/)工具,对DCLK1的分子量、分子式、酸碱性和稳定性等理化性质进行分析。采用Protscale工具(http://web.expasy.org/protscale/)对DCLK1的亲疏水性进行分析。
1.5 DCLK1空间结构分析采用SOPMA工具(https://npsa-prabi.ibcp.fr/cgi-bin/secpred_sopma.pl)分析DCLK1的二级结构及各成分所占比例。采用NCBI的Conserved Domain数据库分析DCLK1的结构域。采用SWISS-MODEL建模服务器(https://swissmodel.expasy.org/)预测DCLK1的三维结构。
1.6 DCLK1相互作用蛋白预测使用GeneMANIA(http://genemania.org/)预测DCLK1相互作用蛋白。
2 结果与分析 2.1 DCLK1蛋白多序列比对和进化关系分析在NCBI数据库中搜索哺乳动物、两栖类和鱼类中人DCLK1蛋白的同源序列。人DCLK1蛋白的氨基酸序列与狨猴、牛、野猪、猫、鸡、小鼠、非洲爪蟾和斑马鱼的相似性分别为93.65%、93.39%、93.39%、93.39%、90.41%、90.08%、86.88%和70.50%。由图 1可知,人DCLK1蛋白与其他几种哺乳动物的氨基酸序列相似性较大,而与两栖类和鱼类的序列相似性较小,与物种进化程度相一致,表明DCLK1蛋白在进化过程中具有保守的分子功能。

|
图 1 人DCLK1蛋白与其同源序列比对的系统进化树 Figure 1 Phylogenetic tree of human DCLK1 protein and its homologous sequence alignment |
NCBI中UniGene数据库的EST结果表明,DCLK1在以下正常组织均有表达,拷贝数分别是:脑248,垂体181,脂肪组织155,神经128,耳62,胚胎组织46,肺41,肾14,肠12。由此可知,DCLK1的组织表达特异性不强,在多数组织中均有表达。诸多研究表明,DCLK1能够调控神经发生、神经元迁移、糖皮质激素受体逆行转运及成神经细胞有丝分裂过程中纺锤体的形成[10],与EST预测DCLK1在脑中表达水平较高的结果一致。此外,研究人员发现DCLK1是小肠绒毛细胞的标志物,主要在小肠隐窝上皮的下端2/3部分表达,在隐窝柱状细胞中也有表达[11-12]。
DCLK1在癌组织中也有表达,拷贝数分别是:神经胶质瘤130,生殖细胞肿瘤121,肾癌29,乳腺癌10,结直肠癌8,消化道肿瘤8。在神经母细胞瘤细胞中,敲除DCLK1能够促进细胞凋亡,提示DCLK1有望成为神经母细胞瘤潜在的治疗靶点[10]。
PSORTII预测,DCLK1定位于细胞核的可能性最大(34.8%),其次可能定位于线粒体(17.4%),细胞质(13.0%),高尔基体(13.0%),细胞膜(8.7%),细胞骨架(4.3%),分泌囊泡(4.3%)和细胞外(4.3%)。由此推测,DCLK1主要在细胞核中发挥生理功能,同时动态存在于其他亚细胞结构中。
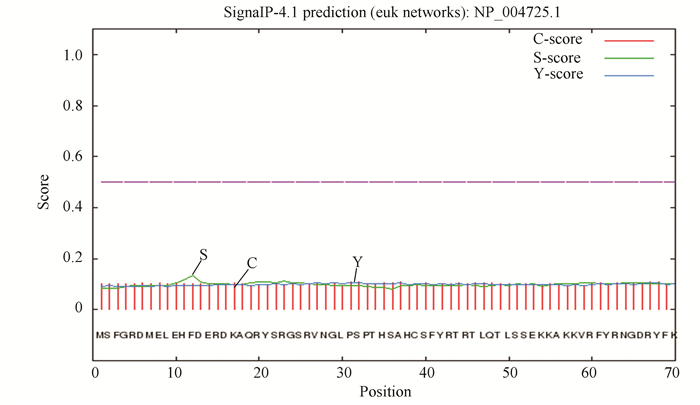
SignalP 4.0预测DCLK1蛋白无信号肽序列(见图 2)。原始剪切位点C值最高点在第68位氨基酸,分值为0.109;被结合的剪切点Y值最高点在第31位氨基酸,分值为0.106;信号肽S值最高点位于第12位氨基酸,分值为0.134;1-30位氨基酸序列的平均信号肽分值为0.103,不足以形成经典的信号肽区域。TMHMM 2.0预测DCLK1无跨膜结构域(见图 3)。
|
图 2 DCLK1蛋白的信号肽分析结果 Figure 2 Analysis result of DCLK1 signal peptide |

|
图 3 DCLK1蛋白跨膜结构分析 Figure 3 Trans-membrane domain analysis of DCLK1 protein |
人DCLK1基因位于13号染色体上(13q13.3),共有21个外显子,编码产物NP_004725.1为该基因的蛋白质共识编码序列。DCLK1蛋白分子式为C3581H5700N1000O1100S23,分子量为81 100.07 Da,含有729个氨基酸,理论等电点预测为8.84,分类为碱性蛋白质。在哺乳动物网织红细胞内半衰期为30 h,不稳定系数为40.17,分类为不稳定蛋白质。脂肪系数为79.79,总的平均亲水性为-0.431。
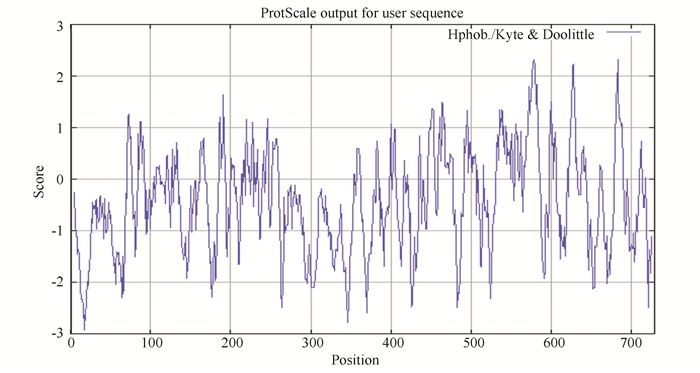
由ProtScale在线工具预测结果可知,DCLK1亲水性最强的位点是第17位的赖氨酸,分值为-2.933;疏水性最强的位点是第578位的酪氨酸,第579位的异亮氨酸和第683位的丝氨酸,分值都为2.322。由图 4可知,DCLK1蛋白的亲水区域多于疏水区域,分类为亲水蛋白质。
|
图 4 DCLK1蛋白的亲疏水性分析 Figure 4 Hydrophilic-hydrophobic analysis of DCLK1 protein |
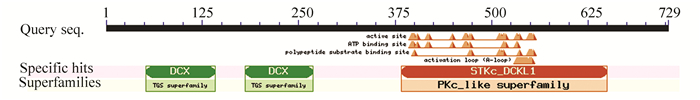
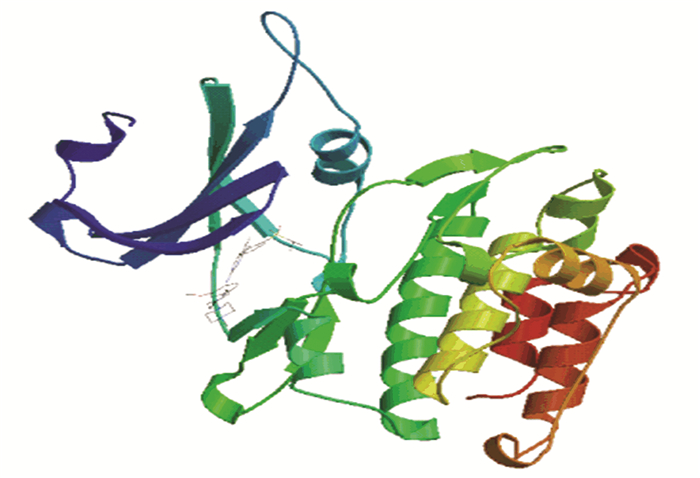
由SOPMA结果可知,DCLK1的二级结构中无规卷曲(图中红色)占38.27%,α-螺旋(图中蓝色)占28.4%,延伸链(图中紫色)占21.81%,β-转角(图中绿色)占11.52%(图 5彩图见电子版:http://swxxx.alljournals.cn/ch/index.aspx.2018年第4期)。NCBI的Conserved Domain数据库预测DCLK1属于TGS超家族和PKc_like超家族(见图 6),在N-末端有两个双皮质素(DCX)结构域,在C-末端有一个Ca2+/钙调蛋白依赖性激酶结构域。双皮质素结构域能够与微管蛋白结合,介导蛋白质之间相互作用,提示DCLK1是一个微管相关蛋白。PKc_like超家族中的STKc结构域能够催化γ-磷酸基团从ATP转移到蛋白底物的丝氨酸/苏氨酸残基上,从而使蛋白底物磷酸化。使用SWISS-MODEL建模服务器预测DCLK1蛋白的三维结构(见图 7),序列相似度为100%,GMQE为0.33,QMEAN为-0.3,该模型结构合理。

|
图 5 SOPMA预测DCLK1蛋白二级结构 Figure 5 Predicted secondary structure of DCLK1 protein by SOPMA |
|
图 6 DCLK1蛋白保守结构域 Figure 6 Conserved domain of DCLK1 protein |
|
图 7 DCLK1三维结构预测 Figure 7 Three dimensional structure prediction of DCLK1 protein |
使用GeneMANIA预测与DCLK1相互作用的蛋白质,构建DCLK1蛋白相互作用网络(见图 8)。与DCLK1相互作用的蛋白质主要包括NOTCH1、NOTCH2、NOTCH3、PRDM8(PR domain 8)、PRUNE2(Prune homolog 2)、TNKS(Tankyrase)、SLC4A1AP(Solute carrier family 4 member 1 adaptor protein)、CALM1(Calmodulin 1)、CABP1(Calcium binding protein 1)和DCX(Doublecortin)。DCLK1含有DCX结构域和Ca2+/钙调蛋白依赖性激酶结构域,此结果可以解释DCLK1与CALM1、CABP1和DCX之间存在相互作用。
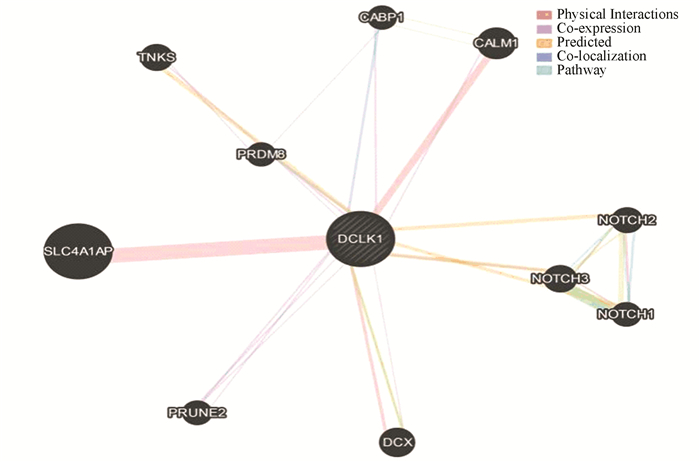
|
图 8 DCLK1蛋白相互作用网络 Figure 8 Protein-protein interaction networks for DCLK1 protein 注:彩图见电子版:http://swxxx, alljournals.cn/ch/index.aspx.2018年第4期. |
对以上互作蛋白的基因进行GO分析和KEGG通路分析。GO分析结果表明,互作基因参与DNA螺旋酶活性、ATP结合和DNA结合等分子功能(见表 1),涉及DNA复制和细胞周期中G1 / S期转换等生物过程(见表 2),富集于核质、MCM复合体、核复制起始复合体和微管细胞骨架(见表 3)。KEGG通路分析结果表明,互作基因显著富集于细胞周期和DNA复制等通路中(见表 4)。由此推测,DCLK1与NOTCH受体蛋白(NOTCH1、NOTCH2和NOTCH3)、PRDM8和PRUNE2关系值得进一步探究。
| 表 1 GO分子功能分类结果 Table 1 GO molecular function results |
| 表 2 GO生物学过程分类结果 Table 2 GO biological process results |
| 表 3 GO细胞组成分类结果 Table 3 GO cellular component results |
| 表 4 KEGG pathway路径列表 Table 4 KEGG pathway list |
DCLK1作为一个潜在的基因治疗分子靶点,本研究通过生物信息学方法,分析得到DCLK1是碱性不稳定的亲水蛋白质,无信号肽和跨膜区域,主要在细胞核中发挥生理功能。DCLK1的主要二级结构是无规卷曲,属于TGS超家族和PKc_like超家族,是一个微管相关蛋白。
由DCLK1互作蛋白的基因GO分析和KEGG通路分析结果可知,互作基因涉及DNA复制和细胞周期中G1/S期转换等生物过程,显著富集于细胞周期和DNA复制等通路中。因此,在DCLK1互作蛋白中,NOTCH1、NOTCH2和NOTCH3引起关注。NOTCH1、NOTCH2和NOTCH3都是Notch信号通路的受体蛋白,细胞中Notch信号通路高度保守,该通路紊乱会导致细胞发生恶性增殖、干性、EMT、基因组不稳定和血管新生[13]。Notch受体和配体相互作用后激活Notch信号通路,引发γ-分泌酶复合物进行受体切割,γ-分泌酶复合物能够释放Notch胞内结构域进入细胞核,形成转录激活复合体发挥作用。根据具体的细胞环境,NOTCH1能够作为致癌基因,亦可作为抑癌基因起作用[14]。研究发现,NOTCH1促进腺样囊性癌细胞增殖,沉默NOTCH1抑制肿瘤发生,引起细胞死亡[15]。Jin等发现Notch信号通路在结直肠癌干细胞中过量表达,推测其在结直肠癌干细胞存活、致癌和自我更新过程中发挥重要作用[16]。DCLK1与Notch信号通路之间的关系尚未见报道,本文分析得出它们之间存在相互作用,有望成为阐明DCLK1作用机制的突破口。
此外,由GO分析结果可知,互作基因参与DNA螺旋酶活性和DNA结合等分子功能,富集于核质、MCM复合体、核复制起始复合体和微管细胞骨架中。因此,DCLK1与PRDM8之间的关系引起关注。PRDM8蛋白是一个高度保守的转录因子,其N-末端含有一个PR结构域和多个锌指重复序列,能够调控序列特异性的DNA结合和蛋白质间相互作用。PR结构域与组蛋白甲基转移酶SET(The drosophila factors suppressor of variegation 3-9, Enhancer of zeste and trithorax)结构域有关,研究发现,PRDM8的PR结构域具有组蛋白甲基转移酶活性,能够招募组蛋白修饰酶或作为组蛋白甲基转移酶靶向启动子,从而调控基因表达[17]。此外,PRDM8是中枢神经系统神经发生的关键调控因子,能够调控发育过程及癌细胞增殖[18]。从DCLK1与PRDM8的关系入手,探讨DCLK1在调控发育过程中的作用机制,有助于深化对DCLK1分子功能的理解。
进一步,根据GeneMANIA预测结果,DCLK1与PRUNE2存在相互作用。PRUNE2是阿尔茨海默病的易感基因,也是Rho信号通路的关键调控因子[19]。在人脑、神经系统和小鼠脊髓中都发现PRUNE2高表达,Machida等发现PRUNE2能够调控神经母细胞瘤细胞的分化、增殖和侵袭,该蛋白过量表达与人神经母细胞瘤预后良好呈正相关[20]。Salameh等研究发现,PRUNE2过量表达能够抑制前列腺癌细胞增殖,提示其起到抑癌作用[21]。DCLK1作为致癌因子,在肿瘤细胞中与PRUNE2作用相反,目前也尚无关于DCLK1和PRUNE2之间关系的报道,深入探究两者之间的相互作用,有助于进一步认识DCLK1的作用机制。
4 结论1) DCLK1的不稳定系数为40.17,预测为不稳定蛋白质。理论分子量为81 100.07 Da,理论等电点为8.84,预测为碱性蛋白质。脂肪系数为79.79,总平均亲水性为-0.431,预测为亲水蛋白质。
2) DCLK1的二级结构主要为无规卷曲,属于TGS超家族和PKc_like超家族,含有双皮质素(DCX)结构域和Ca2+/钙调蛋白依赖性激酶结构域。无信号肽和跨膜结构域。
3) DCLK1表达的组织特异性不强,定位于细胞核的可能性较大。
4) 系统进化树显示,人DCLK1蛋白与其他几种哺乳动物的氨基酸序列相似性较大,而与两栖类和鱼类的序列相似性较小,与物种进化程度相一致。
5) 与DCLK1相互作用的蛋白主要参与DNA复制和细胞周期中G1/S期转换等生物过程。
| [1] |
SUREBAN S M, MADHOUN M F, MAY R, et al. Plasma DCLK1 is a marker of hepatocellular carcinoma (HCC):Targeting DCLK1 prevents HCC tumor xenograft growth via a microRNA-dependent mechanism[J]. Oncotarget, 2015, 6(35): 37200-37215. DOI:10.18632/oncotarget.5808 (  0) 0) |
| [2] |
TSAI J H, YANG J. Epithelial-mesenchymal plasticity in carcinoma metastasis[J]. Genes & Development, 2013, 27(20): 2192-2206. DOI:10.1101/gad.225334.113 (  0) 0) |
| [3] |
LI L, BELLOWS C F. Doublecortin-like kinase 1 exhibits cancer stem cell-like characteristics in a human colon cancer cell line[J]. Chinese Journal of Cancer Research, 2013, 25(2): 134-142. DOI:10.3978/j.issn.1000-9604.2013.03.02 (  0) 0) |
| [4] |
GAGLIARDI G, MOROZ K, BELLOWS C F. Immunolocalization of DCAMKL-1, a putative intestinal stem cell marker, in normal colonic tissue[J]. Pathology Research & Practice, 2012, 208(8): 475-479. DOI:10.1016/j.prp.2012.05.015 (  0) 0) |
| [5] |
KANTARA C, O'CONNELL M R, LUTHRA G, et al. Methods for detecting circulating cancer stem cells (CCSCs) as a novel approach for diagnosis of colon cancer relapse/metastasis[J]. Laboratory Investigation, 2015, 95(1): 100-112. DOI:10.1038/labinvest.2014.133 (  0) 0) |
| [6] |
GAO T, WANG M, XU L, et al. DCLK1 is up-regulated and associated with metastasis and prognosis in colorectal cancer[J]. Journal of Cancer Research & Clinical Oncology, 2016, 142(10): 2131-2140. DOI:10.1007/s00432-016-2218-0 (  0) 0) |
| [7] |
QU D, JOHNSON J, CHANDRAKESAN P, et al. Doublecortin-like kinase 1 is elevated serologically in pancreatic ductal adenocarcinoma and widely expressed on circulating tumor cells[J]. PLoS One, 2015, 10(2): e0118933. DOI:10.1371/journal.pone.0118933 (  0) 0) |
| [8] |
VEGA K J, MAY R, SUREBAN S M, et al. Identification of the putative intestinal stem cell marker doublecortin and CaM kinase-like-1 in Barrett's esophagus and esophageal adenocarcinoma[J]. Journal of Gastroenterology & Hepatology, 2012, 27(4): 773-780. DOI:10.1111/j.1440-1746.2011.06928.x (  0) 0) |
| [9] |
TAMURA K, DUDLEY J, NEI M, et al. MEGA4:Molecular evolutionary genetics analysis(MEGA) software version 4.0[J]. Molecular Biology and Evolution, 2007, 24(8): 1596-1599. DOI:10.1093/molbev/msm092 (  0) 0) |
| [10] |
VERISSIMO C S, MOLENAAR J J, MEERMAN J, et al. Silencing of the microtubule-associated proteins doublecortin-like and doublecortin-like kinase-long induces apoptosis in neuroblastoma cells[J]. Endocr Relat Cancer, 2010, 17(2): 399-414. DOI:10.1677/ERC-09-0301 (  0) 0) |
| [11] |
MAY R, SUREBAN S M, HOANG N, et al. Doublecortin and CaM kinase-like-1 and leucine-rich-repeat-containing G-protein-coupled receptor mark quiescent and cycling intestinal stem cells, respectively[J]. Stem Cells, 2009, 27(10): 2571-2579. DOI:10.1002/stem.193 (  0) 0) |
| [12] |
GERBE F, VAN ES J H, MAKRINI L, et al. Distinct ATOH1 and Neurog3 requirements define tuft cells as a new secretory cell type in the intestinal epithelium[J]. Journal of Cell Biology, 2011, 192(5): 767-780. DOI:10.1083/jcb.201010127 (  0) 0) |
| [13] |
ASTER J C, PEAR W S, BLACKLOW S C. The varied roles of Notch in cancer[J]. Annual Review of Pathology, 2017, 12(1): 245-275. DOI:10.1146/annurev-pathol-052016-100127 (  0) 0) |
| [14] |
FERRAROTTO R, HEYMACH J V. Taking it up a NOTCH:A novel subgroup of ACC is identified[J]. Oncotarget, 2017, 8(47): 81725-81726. (  0) 0) |
| [15] |
PANACCIONE A, CHANG M T, CARBONE B E, et al. NOTCH1 and SOX10 are essential for proliferation and radiation resistance of cancer stem-like cells in adenoid cystic carcinoma[J]. Clinical Cancer Research:An offical Journal of the Americian Association for Cancer Research, 2016, 22(8): 2083-2095. DOI:10.1158/1078-0432.CCR-15-2208 (  0) 0) |
| [16] |
JIN H, CHEN L, WANG S, et al. Portulaca oleracea extract can inhibit nodule formation of colon cancer stem cells by regulating gene expression of the Notch signal transduction pathway[J]. Tumour Biology:The Journal of the International Society for Oncodevelopmental Biology and Medicine, 2017, 39(7): 1010428317708699. DOI:10.1177/1010428317708699 (  0) 0) |
| [17] |
EOM G H, KIM K, KIM S M, et al. Histone methyltransferase PRDM8 regulates mouse testis steroidogenesis[J]. Biochemical & Biophysical Research Communications, 2009, 388(1): 131-136. DOI:10.1016/j.bbrc.2009.07.134 (  0) 0) |
| [18] |
HOHENAUER T, MOORE A W. The Prdm family:Expanding roles in stem cells and development[J]. Development, 2012, 139(13): 2267-2282. DOI:10.1242/dev.070110 (  0) 0) |
| [19] |
POTKIN S G, GUFFANTI G, LAKATOS A, et al. Hippocampal atrophy as a quantitative trait in a genome-wide association study identifying novel susceptibility genes for Alzheimer's disease[J]. PloS One, 2009, 4(8): e6501. DOI:10.1371/journal.pone.0006501 (  0) 0) |
| [20] |
MACHIDA T, FUJITA T, OOO M L, et al. Increased expression of proapoptotic BMCC1, a novel gene with the BNIP2 and Cdc42GAP homology (BCH) domain, is associated with favorable prognosis in human neuroblastomas[J]. Oncogene, 2006, 25(13): 1931-1942. DOI:10.1038/sj.onc.1209225 (  0) 0) |
| [21] |
SALAMEH A, LEE A K, CARDO-VILA M, et al. PRUNE2 is a human prostate cancer suppressor regulated by the intronic long noncoding RNA PCA3[J]. Proceedings of the National Academy of Science of the United Stations of America, 2015, 112(27): 8403-8408. DOI:10.1073/pnas.1507882112 (  0) 0) |
 2018, Vol. 16
2018, Vol. 16


