2. 中药基础与应用研究重点实验室, 遵义医学院 珠海校区,广东 珠海 519000
2. Key Laboratory of Fundamental and Applied Research of Traditional Chinese Medicines, Zhuhai Campus of Zunyi Medical University, Zhuhai 519000, Guangdong, China
随着分子生物学和医学技术的快速进步,分离技术正朝着简便快捷、高质量、高纯度、高通量方向发展,以满足大样本、高质量的实验要求。近年来磁性纳米材料在核酸分离领域越来越受瞩目,其具有比表面积大、稳定性好、多种表面官能团修饰等优点[1],此外,磁珠颗粒的固相提取方法大大简化了核酸的提取流程,基于此已经广泛应用[2-5]。目前市面上所销售基于磁性分离技术的核酸分离试剂盒等商品,绝大多数为国外产品,这类试剂盒价格昂贵,很难得到广泛应用。据此,本实验针对提取基因组DNA,通过对分离流程改进和试剂体系开发,对不同提取条件和步骤进行了量化比较和条件优化,同时比较了市售类似产品,建立了快速提取基因组DNA的方法和试剂体系; 对影响DNA提取效率的各个因素以及DNA与磁珠的结合情况分析与探讨,建立了一种快速提取基因组DNA的磁性分离技术。
1 材料与方法 1.1 材料小鼠肺组织[SPF级小鼠,品系:CD-1(ICR) IGS Mice,购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2011-0011],二氧化硅包覆磁性纳米微球(河南惠尔生物科技有限公司)
1.2 试剂蛋白酶K、溶菌酶、盐酸胍(Gu-HCl)及琼脂糖(均购于Sigma公司); 核酸染料GlodView(北京索莱宝生物); DNA Marker DL2000及上样缓冲液(均购于大连宝生物); EDTA、SDS、Triton-100、氯化钠、柠檬酸钠、柠檬酸钾、氯化锂及MOPS(均为分析纯,购于麦克林公司); β-巯基乙醇、Tris、异丙醇、盐酸、无水乙醇、硼酸(均为分析纯,购于天津大茂)。
1.3 仪器微型分光光度计、台式高速离心机、单道移液器(Eppendorf公司); 凝胶成像系统、水平电泳系统(Bio-Rad公司); 磁性分离架(上海生工); 电热恒温鼓风干燥箱(上海博迅实业有限公司医疗设备厂); 酸度计(上海仪电分析仪器有限公司); 漩涡混合器、电热恒温振荡水槽(江苏海门麒麟医用仪器厂); TS-24多样品组织研磨机(上海净信)。
1.4 方法 1.4.1 组织样品准备与处理小鼠颈椎脱臼法处死后,取新鲜肺组织置于-20 ℃冰箱中快速冷冻,待完全冻实后放入组织粉碎机中快速粉碎(粉碎时间为10 min),取粉碎后的组织匀浆于-20 ℃冰箱中备用。
1.4.2 磁珠法提取DNA取试管加100 mg匀浆样本,参考双酶解方法,加入10 μL混合酶工作液(蛋白酶K的浓度为40 mg/mL,溶菌酶的浓度为10 mg/mL),56 ℃水浴5 min; 加入750 μL裂解液(盐酸胍的浓度为6 mol/L,Tris-HCl的浓度为10 mmol/L,EDTA的浓度为1 mmol/L、异丙醇的体积比为1:3,SDS为0.1%,Triton-100为0.5%,β-巯基乙醇为0.5%,氯化钠的浓度为800 mmol/L,柠檬酸钠的浓度为200 mmol/L,pH=6)和磁珠工作液(磁珠浓度100 μg/mL,液态介质为异丙醇),上下颠倒试管5~10次充分混合,在室温下放置3 min; 用磁分离架分离磁珠并弃上清; 用800 μL洗涤液(氯化锂的浓度为800 mmol/L,MOPS的浓度为50 mmol/L,氯化钠的浓度为100 mmol/L,乙醇的体积比为60%,其中乙醇的pH=7.0)洗2次,然后分离磁珠弃上清; 用1 000 μL漂洗液(乙醇的浓度为70%)漂洗2次,分离磁珠弃上清; 室温放置3 min,挥干乙醇,加入100 μL洗脱液(EDTA的浓度为0.5 mmol/L,Tris-HCl的浓度10 mmol/L,其中Tris-HCl的pH=8.0)上下吹打沉淀,使微球充分悬浮,在室温下放置3 min,得纯化的基因组DNA[6-9]。
1.4.3 琼脂糖凝胶电泳检测于锥形瓶中加入0.5 g琼脂糖,加l×TBE50 mL,加热溶解后取出置冷,加3 μL GlodView混匀,倒入制胶板中,插梳子。冷却凝固。取出梳子后置于电泳槽中。将提取得到的样品液取4 μL与l μL上样缓冲液(Loading buffer)混匀后,加入点样孔中。另取4 μL Marker,加入点样孔中。打开电源,将电压调节为110 V,电泳30 min。然后,取出凝胶,拍照。
1.4.4 DNA纯度和浓度测定取上述提取的DNA样品2 μL注入微型分光光度计加样孔中,读数,每个样品测定3次,取均值,得基因组DNA纯度和浓度。
1.4.5 盐酸胍和碘化钠浓度对DNA提取效果的影响取小鼠肺组织分成100 mg的小份,共16份,依次加入等浓度梯度的盐酸胍裂解液(盐酸胍的浓度为1~8 mol/L,Tris-HCl的浓度为10 mmol/L,EDTA的浓度为1 mmol/L、异丙醇的体积比为1:3,SDS为0.1%,Triton-100为0.5%,β-巯基乙醇为0.5%,氯化钠的浓度为800 mmol/L,柠檬酸钠的浓度为200 mmol/L,pH=6)和等浓度梯度的碘化钠裂解液(碘化钠的浓度为1~8 mol/L,盐酸胍的浓度为6 mol/L,Tris-HCl的浓度为10 mmol/L,EDTA的浓度为1 mmol/L、异丙醇的体积比为1:3,SDS为0.1%,Triton-100为0.5%,β-巯基乙醇为0.5%,氯化钠的浓度为800 mmol/L,柠檬酸钠的浓度为200 mmol/L,pH=6),按照上述实验过程分别进行肺组织的基因组DNA提取,其它过程同上(1.4.2),得基因组DNA样品,测定基因组DNA样品纯度和浓度,方法同上(1.4.4),最后借助软件Image J(v1.8.0),1%凝胶电泳,分子量标准为DL 2 000 DNA Marker,每孔样品加入量为4 μL,进行凝胶电泳对比分析。
1.4.6 裂解液pH值对DNA提取效果影响取小鼠肺组织分成100 mg的小份,共5份,加入不同pH的裂解液(盐酸胍的浓度为6 mol/L,Tris-HCl的浓度为10 mmol/L,EDTA的浓度为1 mmol/L、异丙醇的体积比为1:3,SDS为0.1%,Triton-100为0.5%,β-巯基乙醇为0.5%,氯化钠的浓度为800 mmol/L,柠檬酸钠的浓度为200 mmol/L,盐酸调节pH分别为4、4.5、5、5.5、6),1%凝胶电泳,分子量标准为DL 2 000 DNA Marker,每孔样品加入量为4 μL。按照上述实验过程分别进行肺组织的基因组DNA提取、检测、分析比较。
1.4.7 磁珠用量对DNA提取效果影响取小鼠肺组织分成100 mg的小份,共8份,加入750 μL裂解液(同1.4.2)和不同体积(20、30、40、60、70、80、90、100 μL)的磁珠工作液(同1.4.2),按照上述实验过程分别进行肺组织的基因组DNA提取、检测、分析比较。
1.4.8 裂解液中其它盐类对DNA提取效果的影响取小鼠肺组织分成100 mg的小份,共11份,分别加入不同浓度的含K+(柠檬酸钾)的裂解液(其他成分同1.4.2,K+浓度分别为0.1、0.2、0.4、0.8、1.0、1.2 mol/L)和含Na+(氯化钠)的裂解液(其他成分同1.4.2,Na+浓度分别为1 250、1 000、750、500、250 mmol/L),1%凝胶电泳,分子量标准为DL 2000 DNA Marker,每孔样品加入量为4μL。按照上述实验过程分别进行肺组织的基因组DNA提取、检测、分析比较。
2 结果 2.1 基因组DNA提取纯度、浓度及所耗时间采用二氧化硅修饰的磁珠试剂盒提取DNA与传统同类试剂盒[5]提取DNA实验对比(见表 1)。在DNA提取质量方面,本试剂盒提取的基因组DNA样品纯度高,蛋白含量低,盐残留少,可直接用于PCR扩增; 在DNA提取时效方面,本试剂盒单次提取时间为25 min,优于国内众多试剂盒。
| 表 1 基因组DNA提取情况及耗时情况对比 Table 1 Comparison of extraction and time-consumption of genomic DNA |
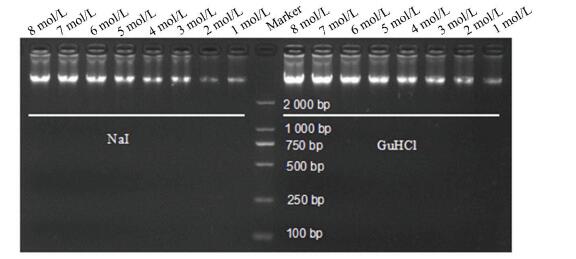
本研究采用不同浓度的盐酸胍裂解缓冲液和不同浓度的碘化钠裂解缓冲液进行了小鼠肺组织基因组DNA的提取。从其平行实验结果(见图 1)可以看出,当盐酸胍和碘化钠浓度1~3 mol/L时,出现电泳条带,说明洗脱液中含有基因组DNA,但基因组DNA含量较少,当盐酸胍和碘化钠浓度高于4 mol/L,随浓度的增加电泳条带也加粗、加亮,表明所提取得的基因组DNA的量也随之增加。当盐酸胍浓度高于6 mol/L后,DNA提取效率呈现饱和趋势,增加效果不明显。碘化钠亦相同。
|
图 1 不同盐类浓度对基因组DNA提取效果的影响 Figure 1 Effects of different salt concentrations on the extraction of genomic DNA |
裂解液的pH对核酸的提取效果影响较大,本实验采用不同pH的裂解液对小鼠肺组织提取所得基因组DNA的电泳图(见图 2)。当pH在4~6范围内有亮条带显示有基因组DNA,pH为6时DNA条带最亮,表明该pH下提取DNA量多,pH4-6时则条带色浅,表明DNA量少,因此,本试剂盒将裂解液的pH选定在6.0左右。

|
图 2 不同pH对基因组DNA提取效率的影响 Figure 2 Effects of different pH on the extraction of genomic DNA |
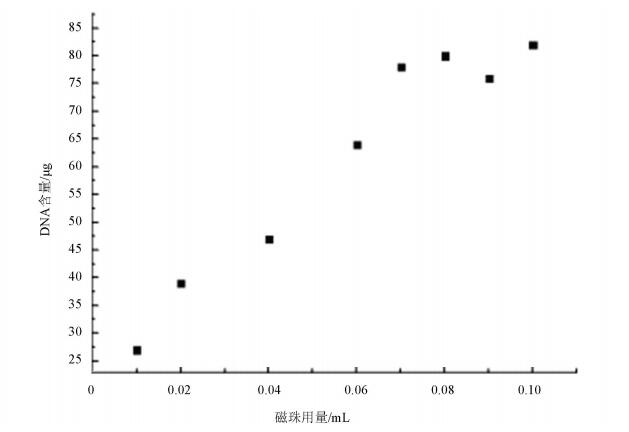
磁珠用量的多少也影响着提取的DNA量,使用不同量的磁珠对小鼠肺组织中提取DNA (见图 3)。本实验对于100 mg肺组织,适宜的磁珠用量为80 μg。从图中可见,磁珠用量40 μg/100 mg时DNA产量在低,当在40~70 μg/100 mg时,DNA产量随着磁珠的用量增加而显著增加,而高于70 μg/100 mg,DNA产量变化不明显。理论上,当吸附未达到饱和时,对于一定量的DNA,随着磁珠用量增加,吸附表面积增大而增加吸附DNA量,当所有DNA被吸附后,不会再随磁珠用量增加而增加。此外,根据UV检测,样品DNA的OD260/OD280比值在1.68~ 1.82范围之间,说明用本方法提取所得基因组DNA的纯度较高。
|
图 3 不同磁珠用量提取基因组DNA的饱和吸附曲线 Figure 3 Saturation adsorption curves of genomic DNA extracted with different magnetic beads |
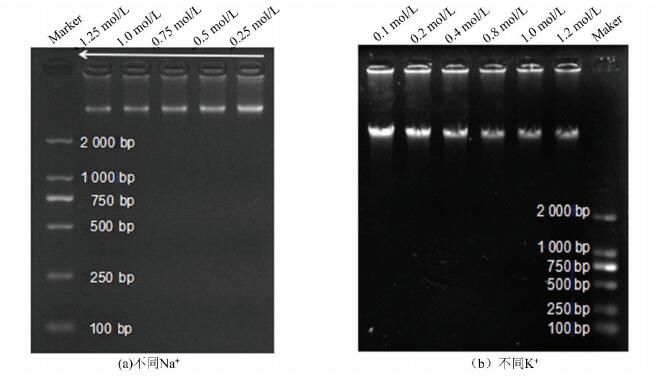
裂解液极性会影响DNA提取效率,其中某些离子强度(如加入KCl、NaCl等)的增加可以增加溶液的极性。本研究采用含有不同浓度的K+和Na+的裂解液对小鼠肺组织的基因组DNA进行提取(见图 4)。显示增加Na+浓度DNA得率不随之增加,相反,低Na+时,DNA得率相对较高。随着K+浓度增加显示有挂孔现象,表明其浓度增加较大影响提取率,综上分析,裂解液中钠离子强度在0.75 mol/L左右,钾离子强度暂时不添加,避免挂孔。
|
图 4 不同Na+和K+浓度对基因组DNA提取效率的影响 Figure 4 Effect of different Na+ and K+ concentrations on extraction efficiency of genomic DNA |
目前,仅有少量文献报道运用磁珠法快速提取基因组DNA,这些方法的提取试剂由于成分的限制均针对某一种特定的样本,例如:大肠杆菌、组织、细胞、血液等,缺乏广泛适用性。本研究通过对提取过程工艺优化,使用了复合酶解法,可以裂解不同的组织样品,并初步找到了一种适用于大多数实验样本的快速提取基因组DNA的实验方法,并且对实验方法中的关键试剂的最佳用量进行摸索,最终确定了上述试剂配方及反应体系,本文以肺组织为例介绍该实验研究,其他的样本结果将在以后的文章中介绍,课题组也将继续研究,进一步优化该体系。
文中选择盐酸胍作为裂解液中发挥裂解作用的成分,它可使结构中氢键断裂,溶解蛋白质,破坏蛋白质二级结构,使蛋白质从核酸上解离下来。盐酸胍在提取基因组DNA时效率较高,其作用机理有以下两点,其一可能是促使核膜破裂,降解了蛋白质,其二促使DNA的吸附,盐浓度越高溶液中的自由水分子就越少,盐离子的水化能力就越强,导致核酸分子暴露的磷酸基团越多,与磁珠表面修饰的基团增加,形成氢键的结合位点,增加DNA的吸附。随着分子诊断及分子育种等技术的兴起,快速、高效、保质保量的提取样本的基因组DNA是进行分子诊断、分子育种等技术的首要条件[10-12]。
4 结论1) 本实验方法提取的基因组DNA样品纯度高,蛋白含量低,盐残留少。
2) 本实验方法可提取样本种类多样:组织、细胞、致病菌和血液都可。
3) 提取方法简便、快捷,有进行产业化应用的价值。
| [1] |
曹菁菁.高响应性磁性微球的制备及其生物分离应用[D].天津: 天津大学, 2009. CAO Jingjing. Preparation of highly magnetizable spheres for bio-Separations[D]. Tianjin: Tianjin University, 2009. (  0) 0) |
| [2] |
王爱迪.磁性/磁性荧光微球的制备及在转基因食品检测中的应用[D].天津: 天津大学, 2012. WANG Aidi, Preparation of magnetic and magnetic fluorescent microspheres for genetically modified good detection[D]. Tianjin : Tianjin University, 2012. (  0) 0) |
| [3] |
王雅凡, 黄艳凤, 杨华, 等. 制备硅包覆的磁性微球用于蓖麻叶DNA的提取[J]. 现代生物医学进展, 2010, 10(17): 3205-3208. WANG Yafan, HUANG Yanfeng, YANG Hua, et al. Synthesis of silica coated magnetic microspheres for genomic DNA extraction from CastorLeaves[J]. Progres in Modern Biomedicine, 2010, 10(17): 3205-3208. DOI:10.13241/j.cnki.pmb.2010.17.001 (  0) 0) |
| [4] |
张彩权.四氧化三铁磁性复合微球的制备及其在全血基因组DNA自动化提取中的应用[D].西安: 西北大学, 2010. ZHANG Caiquan. Preparation of magnetic Fe3O4 composite particles and its application in automated purification of genomic DNA in whole blood[D]. Xi'an: Northwest University, 2010. (  0) 0) |
| [5] |
王森. Fe3O4/SiO2复合纳米磁性微球制备及用于DNA分离纯化研究[D].雅安: 四川农业大学, 2007. WANG Sen. Preparation of Fe3O4/SiO2 magnetic composite nanoparticles and its study of application in DNA purification[D]. Ya An: Sichuan Agricultural University, 2007. (  0) 0) |
| [6] |
李海洋, 王飞, 雷红涛, 等. 硅羟基磁珠的制备及全基因组DNA提取优化[J]. 生物技术通报, 2017, 33(06): 223-229. LI Haiyang, WANG Fei, LEI Hongtao, et al. Optimization of genomic DNA extraction with silica hydroxyl magnetic beads[J]. Biotechnology Bulletin, 2017, 33(06): 223-229. DOI:10.13560/j.cnki.biotech.bull.1985.2016-1045 (  0) 0) |
| [7] |
杨合宇, 李发根, 翁启杰, 等. KingFisher Flex核酸纯化系统上树木叶片DNA的提取方法[J]. 分子植物育种, 2017, 15(05): 1854-1861. YANG Heyu, LI Fagen, WENG Qijie, et al. A method for using KingFisher Flex purification system to isolate DNA from tree leaves[J]. Molecular Plant Breeding, 2017, 15(05): 1854-1861. DOI:10.13271/j.mpb.015.001854 (  0) 0) |
| [8] |
盛伟.磁性核壳和介孔结构二氧化硅纳米粒子的制备及DNA提取应用[D].南京: 南京理工大学, 2017. SHENG Wei. Preparation of magnetic core-shell and mesoporous silica nanoparticles for DNA separation[D]. Nanjing: NanJing University of Science & Technology, 2017. (  0) 0) |
| [9] |
袁家龙, 袁红. Kingfisher FLEX自动工作站在批量提取脱落细胞检材DNA中的应用[J]. 刑事技术, 2017, 42(01): 83-84. YUAN Jialong, YUAN Hong. Batch extraction of DNA from epithelial cells by the automatic workstation of kingfisher FLEX[J]. Forensic Science and Technology, 2017, 42(01): 83-84. (  0) 0) |
| [10] |
杜鲜, 孙培培, 张虹, 等. 水热法制备磁性微球及其在植物基因组DNA提取分离中的应用[J]. 安徽农业科学, 2016, 44(13): 149-152. DU Xian, SUN Peipei, ZHANG Hong, et al. Preparation of magnetic nano-microsphere by solvothermal synthesis and its application in genomic DNA purification from plant tissues[J]. Journal of Anhui Agriculture Sciences, 2016, 44(13): 149-152. DOI:10.13989/j.cnki.0517-6611.2016.13.049 (  0) 0) |
| [11] |
蒋娜, 汪崇文, 周标, 等. 一种高性能磁性复合微球的制备及其在DNA提取中的应用[J]. 军事医学, 2016, 40(06): 520-524. JIANG Na, WANG Chongwen, ZHOU Biao, et al. Preparation of high-performance magnetic composite microspheres and their application in DNA extraction[J]. Military Medical Sciences, 2016, 40(06): 520-524. DOI:10.7644/j.issn.1674-9960.2016.06.017 (  0) 0) |
| [12] |
董妍, 胡文忠, 何煜波, 等. 食源性致病菌分子生物学检测中菌体分离富集与DNA提取技术研究进展[J]. 食品工业科技, 2015, 36(23): 371-375. DONG Yan, HU Wenzhong, HE Yibo, et al. Research progress in separation, enrichment and DNA extraction of foodborne pathogens based on molecular biological technology[J]. Science and Technology of Food Industry, 2015, 36(23): 371-375. DOI:10.13386/j.issn1002-0306.2015.23.069 (  0) 0) |
 2018, Vol. 16
2018, Vol. 16


