衰老是一个复杂的生物学过程,其主要特征表现为生物体维持个体生理完整性能力的逐步丧失、生物体对各种压力及疾病的抗性逐步下降[1]。衰老几乎发生于每一个物种中。近期研究显示,衰老是衰老相关疾病(包括糖尿病、心血管疾病、神经退行性疾病及部分癌症等)的主要风险因子[2-3]。寻找抗衰老活性分子或策略并研究其作用机制是现今衰老领域的研究热点,其中两种广泛被研究的抗衰老策略包括雷帕霉素处理及卡路里限制[4-5], 寻找更多更好的抗衰老活性分子正在领域内得到越来越多的重视。
琥珀酸(Succinic acid,简称SA,分子式为C4H6O4),又称丁二酸酸,是一种水溶性晶体。由于其无色且低毒,被广泛用在药品和食品中[6]。琥珀酸作为一种代谢中间体,主要在线粒体中产生并富集[7]。琥珀酸对细胞代谢(包括三羧酸循环、氨基酸、脂肪酸及血红素等物质代谢)至关重要[8]。研究显示,琥珀酸可作为激素样信号分子参与调控多种细胞代谢过程(如血液细胞、脂肪组织、免疫细胞等)[9]。同时发现琥珀酸可作为炎症调控信号分子(如在先天免疫细胞中琥珀酸可通过稳定HIF1-alpha或GPR91信号而调控炎症因子的产生[10])。但除在线虫中报道过琥珀酸可介导热抗及氧抗外[11], 目前尚琥珀酸介导寿命及其他抗性调控的直接报道。
本文首次报道了琥珀酸可延缓芽殖酵母细胞的衰老,并增强了细胞对重金属铁的压力抗性。随后,利用DNA微阵列及生物信息学手段分析了琥珀酸对基因表达谱的影响,发现核糖体生物发生及线粒体可能是琥珀酸调控的主要靶点。对进一步了解琥珀酸介导的寿命及抗性调控机制提供了重要参考和研究线索。
1 材料与方法 1.1 菌株及培养基本研究中使用的菌株有:DBY746(MATα leu2-3, 112 his3Δ1 trp1-289 ura3-52 GAL+), R1158(MATa his3-1 leu2-0 met 15-0 URA3::CMV-tTA), RCD956(MATa his3-1 leu2-0 met 15-0 URA3::CMV-tTA KAN::Tet O7::LCB1)及RCD957(MATa his3-1 leu2-0 met 15-0 URA3::CMV-tTA KAN::Tet O7::LCB2)。使用的培养基SDC(Synthetic Dextrose Complete)同前[12-13]。除特殊标明外,大部分实验中琥珀酸的使用浓度为200 mmol/L。
1.2 寿命检测方法芽殖酵母细胞寿命测定方法同前[12-13]。主要实验过程为:30 ℃过夜培养细胞,得到饱和细胞悬液,次日稀释到25 ml SDC中扩大培养,保证起始OD600 nm值为0.005,扩大培养72 h后定义为寿命测定的第一天(即CLS day 1),此时细胞存活率被测定并设定为100%。后续每隔2~3 d分别测定细胞存活率,并与第1天存活率做比较,得出细胞存活比例,并进行统计学分析。
1.3 重金属压力抗性检测压力抗性检测方法同前[12-13]。主要实验过程为:在SDC中培养细胞至一定OD600nm值(见图 1注),取OD600nm值为0.5个单位的细胞,在磷酸钾缓冲液(pH 6.0)中进行梯度稀释(10倍梯度),将梯度稀释后细胞分别点样于含有重金属铁/琥珀酸或对照固体平板上,细胞生长3~5 d后观察琥珀酸对细胞铁压力抗性的保护效应。
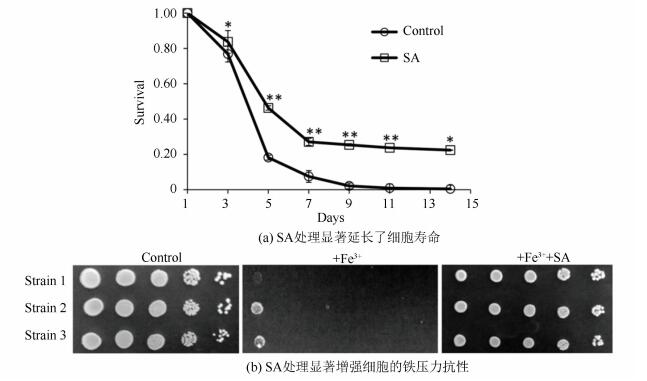
|
图 1 SA对细胞寿命及压力抗性的影响 Figure 1 Effects of SA treatment on CLS and stress resistance 注(a): SA=200 mmol/L, *:P < 0.05, **:P < 0.01, SA Vs对照; (b):Fe3+=2.5 mmol/L,Strain 1=R1158, Strain 2=RCD956, Strain 3=RCD957. |
细胞培养及处理同上寿命实验。取SA处理组及对照组细胞各20个单位(OD600nm值为2.0),利用RNeasy试剂盒(Qiagen, Cat#74104, Gaithersburg, MD, USA)提取总RNA,在各组中筛选出组内RNA质量浓度相近且质量好的3个样本,进行基因芯片检测,得到微阵列MAS5信号值作为原始数据。
1.4.2 主成分分析主成分分析(Principal component analysis, PCA)使用R软件(版本3.3)及R Studio(版本1.0.136),通过扩展包“psych”,对每个样本的5 900个探针信号值数据做降维处理,提取3个主成分; 通过扩展包“rgl”,将3个主成分的因子载荷作为三维坐标,进行可视化。
1.4.3 差异表达基因通过使用R语言平台(版本3.3,https://www.r-project.org/)下载“Bioconductor”扩展包分析基因芯片数据,得到差异表达基因(differentially expressed genes, DEGs)列表(DEGs lists)。采用在线程序DAVID (database for annotation, visualization and integrated discovery, 版本6.8, https://david-d.nciFold Changerf.gov/)补充探针注释,利用YEASTRACT (yeast search for transcriptional regulators and consensus tracking, http://www.yeastract.com/)补充ORF/Gene Symbol。
1.4.4 基因本体聚类(GO Terms clustering)采用在线程序DAVID (database for annotation, visualization and integrated discovery, https://david-d.nciFold Changerf.gov/) Functional Annotation Clustering工具对DEGs lists (P < 0.05)进行基因本体聚类, 选择Benjamin=0.05为阈值筛选clusters,选择Benjamin < 0.05,得到Go Terms。
同时,利用软件cytoscape(version 3.6.1)对DAVID获得的GO Terms进行网络绘图,以考察各GO Terms间的作用关系。
1.4.5 信号通路分析(Pathways analysis)采用在线程序DAVID (database for annotation, visualization and integrated discovery, https://david-d.nciFold Changerf.gov/) Functional Annotation Clustering工具,对DEGs list (P < 0.05)进行信号通路聚类,选择Benjamin=0.05为阈值筛选聚类簇,选择Benjamin < 0.05,得到信号通路。
同时,利用软件cytoscape(version 3.6.1)对DAVID获得的KEEG Pathways进行网络绘图,以考察各KEGG Pathway间的作用关系及各KEGG Pathway内部的关键基因。
2 结果分析 2.1 SA处理延长细胞寿命,增强细胞的压力抗性SA对细胞寿命及重金属压力抗性实验结果见图 1。结果显示200 mM的SA处理显著延长了野生型酵母细胞DBY746的寿命,图 1(b)显示同样浓度的SA显著增强了三种不同细胞株对铁离子压力的抗性。
2.2 主成分分析主成分分析结果见表 1。在提取的3个主成分中,SA处理组(SA)的主成分因子载荷与对照组表现出显著差异。对表 1中数据进行可视化结果如图 2所示,可直观看出SA与对照组也呈显著差异,与表 1结论相吻合。
| 表 1 主成分分析数据 Table 1 PCA Data |
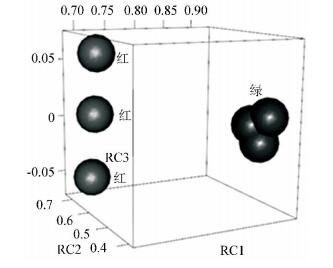
|
图 2 主成分分析 Figure 2 Principle component analysis 注:红色、绿色分别为对照组及SA处理组(祥见电子版:http://swxxx.alljournals.cn/ch/login.aspx.) |
分析差异表达基因数目(见表 2)可知,相比于对照组,SA处理导致3 485个基因的表达水平发生显著变化(P < 0.05),其中包括1 335个表达上调基因及2 150个表达下调基因。
| 表 2 差异表达基因数目 Table 2 Number of differentially expressed genes(DEGs) |
为了更好理解SA处理导致的DEGs如何调控细胞寿命及压力抗性,对DEGs进行了聚类分析。结果显示(见图 3、表 2及图 1),上调的DEGs主要聚类在rRNA的核输出(GO:0006407~rRNA export from nucleus)、核糖体大小亚基的组装(GO:0000028~ribosomal small subunit assembly, GO:0000027~ribosomal large subunit assembly)、核糖体大小亚基的生物合成(GO:0042274~ribosomal small subunit biogenesis, GO:0042273~ribosomal large subunit biogenesis)及rRNA的甲基化和加工(GO:0031167~ rRNA methylation and GO:0006364~rRNA processing),而这些聚类均与核糖体的生物发生相关,推测核糖体生物发生是SA作用的一个主要靶点。上调基因的其他聚类还包括:氨基酸的跨膜转运(GO:0003333~ amino acid transmembrane transport)、离子运输(GO:0006811~ion transport)、跨膜运输(GO:0055085~transmembrane transport)等。
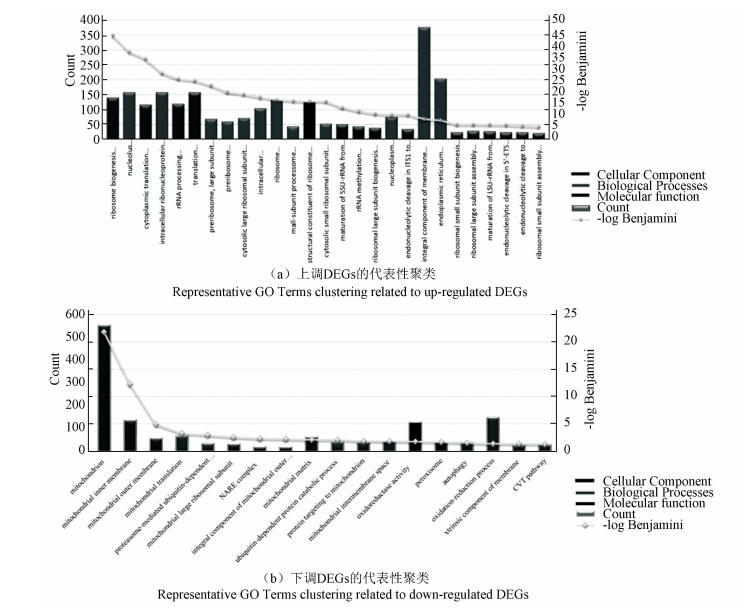
|
图 3 GO聚类分析 Figure 3 GO Terms Cluster Analysis 注:彩图见电子版:http://swxxx.aujournals.cn/ch/login.aspx |
而下调的DEGs则主要聚类在:氧化还原过程(GO:0055114~oxidation-reduction process)、线粒体翻译(GO:0032543~mitochondrial translation)、线粒体基质及线粒体内外膜(GO:0005743~mitochondrial inner membrane及GO:0005743~mitochondrial outer membrane),可以看出,这些聚类均与线粒体功能相关,推测线粒体也可能是SA作用的一个主要靶点。下调基因的其他聚类还包括:细胞自噬(GO:0006914~autophagy及GO:0032258~CVT pathway)、过氧化物酶体(GO:0005777~peroxisome)等。
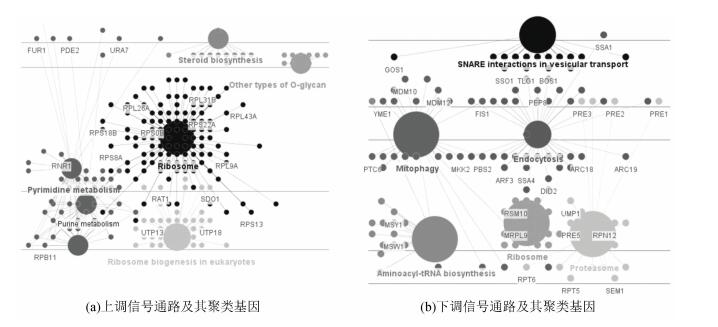
2.5 信号通路分析信号通路分析结果(见图 4、图 5、表 3)显示,相比于对照组,SA处理导致了12条信号通路发生显著变化(Benjamin < 0.05),上调的信号通路主要富集于核糖体相关信号通路(如sce03008:Ribosome biogenesis in eukaryotes,sce03020:RNA polymerase及sce03010:Ribosome),而下调信号通路则集中在线粒体相关的信号通路(包括sce00020:Citrate cycle (TCA cycle)及sce00514:Other types of O-glycan biosynthesis),信号通路间的相互作用及各信号通路中显著调控基因详见图 5,信号通路分析结果与基因本体聚类结果相吻合。
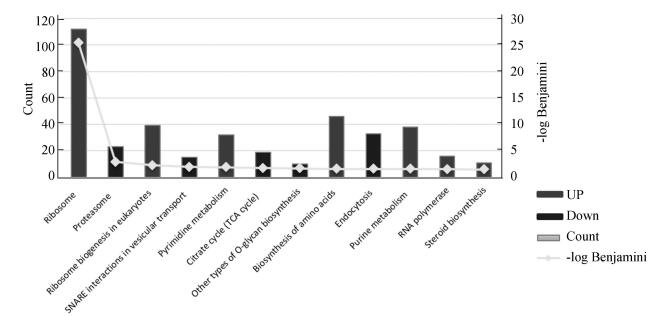
|
图 4 信号通路分析 Figure 4 Signaling pathways analysis upon SA treatment. Both activated and depressed signaling pathways were presented herein |
|
图 5 信号通路间关系及信号通路内关键基因分析 Figure 5 Network of signaling pathways and key genes in each signaling pathways |
SA作为一种重要的药品和食品中间体,已有研究表明,SA可介导多种细胞功能(如炎症发生[10]、肿瘤发生[14-15]及缺血再灌注损伤修复[8]等),但尚无SA介导寿命调控的相关研究。本文首次报道了SA可延缓酵母细胞衰老(见图 1A),并利用DNA微阵列结合生物信息学分析了SA对细胞转录组的影响,从PCA结果可看出,SA对细胞转录组产生了显著影响(见图 2),并导致了3 485个差异表达基因(见表 1),本文结果为下一步深入研究SA介导的寿命机制建立了整体框架并提供了若干研究切入点。
SA主要在线粒体中产生和富集,有研究显示SA可作为一个反映细胞代谢状态的信号分子[16]。与此背景一致,我们的GO Terms聚类显示,SA处理酵母细胞后,富集了大量与线粒体相关的GO Terms(见图 3、表 2及图 1),如氧化还原过程(GO:0055114~oxidation-reduction process)、线粒体翻译(GO:0032543~mitochondrial translation)、线粒体内膜空间及基质(GO:0005758~mitochondrial intermembrane space及GO:0005759~mitochondrial matrix)、氧化还原酶活性(GO:0016491~oxidoreductase activity)。同时,三羧酸循环信号通路也被富集(sce00020:Citrate cycle (TCA cycle))(Fig. 4及Table.S3),这些结果显示,线粒体可能是SA作用的一个靶点。线粒体在细胞寿命和压力抗性调控中的作用已有文献报道[4-5], 但SA如何靶向线粒体进而作用于细胞寿命调控还需要进行深入研究。
本研究中另一个被富集的GO Term是核糖体的生物发生(见图 3、表 2及图 1),包括核糖体大小亚基的组装(GO:0000027~ribosomal large subunit assembly及GO:0000028~ribosomal small subunit assembly)、核糖体大小亚基的生物发生(GO:0042273~ribosomal large subunit biogenesis及GO:0042274~ribosomal small subunit biogenesis)、核糖体(GO:0005840~ribosome)及核糖体RNA的结合(GO:0019843~rRNA binding)。同时,核糖体相关的信号通路也被大量富集(见图 4、图 5及表 3)。值得指出的是,在被富集的核糖体KEGG信号通路(包括sce03010:Ribosome、sce03008:Ribosome biogenesis in eukaryotes及sce03020:RNA polymerase)中共有237个基因,其中167个基因是SA诱导的差异表达基因(见表 3,其中部分关键差异表达基因也直观地呈现在图 5中),显示核糖体可能是SA作用的一个主要靶点,核糖体功能也参与了雷帕霉素及CR介导的寿命调控[4-5],但SA如何作用于核糖体相关功能进而调控细胞寿命及SA介导的寿命调控是否与雷帕霉素/CR介导的寿命调控在机制上是否有交叉融合等问题还需要深入研究。
最后,鉴于SA在工业上的广泛应用及前期发现的SA对人体多个组织(如心脏[9]、免疫细胞[17]、血小板及肾脏[18]等)的潜在有益影响,结合衰老分子机制的物种间保守性,后期SA有望被开发成一种新型抗衰老活性分子。
4 结论1) 本文首次报道了SA可以显著延长芽殖酵母细胞寿命并增强细胞对重金属铁离子的抗性,显示出其作为抗衰老活性分子的巨大潜力。
2) SA处理对细胞转录组产生了显著影响,导致3 485个差异表达基因,进一步分析显示线粒体及核糖体相关功能可能是SA作用的主要靶点。
| [1] |
LOPEZ-OTIN C, BLASCO M A, PARTRIDGE L, et al. The hallmarks of aging[J]. Cell, 2013, 153(6): 1194-217. DOI:10.1016/j.cell.2013.05.039 (  0) 0) |
| [2] |
KENNEDY B K, BERGER S L, BRUNET A, et al. Geroscience: linking aging to chronic disease[J]. Cell, 2014, 159(4): 709-713. DOI:10.1016/j.cell.2014.10.039 (  0) 0) |
| [3] |
He S, Sharpless N E. Senescence in health and disease[J]. Cell, 2017, 169(6): 1000-1011. DOI:10.1016/j.cell.2017.05.015 (  0) 0) |
| [4] |
ARRIOLA APELO S I, LAMMING D W. Rapamycin: An InhibiTOR of aging emerges from the soil of easter island[J]. The Journals of Gerontology Series A: Biological Sciences and Medical Sciences, 2016, 71(7): 841-849. DOI:10.1093/gerona/glw090 (  0) 0) |
| [5] |
KWON Y Y, LEE S K, LEE C K. Caloric restriction-Induced extension of chronological lifespan requires intact respiration in budding yeast[J]. Molecules & Cells, 2017, 40(4): 307-313. DOI:10.14348/molcells.2017.2279 (  0) 0) |
| [6] |
SADHUKHAN S, VILLA R, SARKAR U. Microbial production of succinic acid using crude and purified glycerol from a Crotalaria juncea based biorefinery[J]. Biotechnology Reports, 2016, 10(C): 84-93. DOI:10.1016/j.btre.2016.03.008 (  0) 0) |
| [7] |
LEE J W, YI J, KIM T Y, et al. Homo-succinic acid production by metabolically engineered Mannheimia succiniciproducens[J]. Metabolic Engineering, 2016, 38: 409-417. DOI:10.1016/j.ymben.2016.10.004 (  0) 0) |
| [8] |
PELL V R, CHOUCHANI E T, FREZZA C, et al. Succinate metabolism: a new therapeutic target for myocardial reperfusion injury[J]. Cardiovascular Research, 2016, 111(2): 134-41. DOI:10.1093/cvr/cvw100 (  0) 0) |
| [9] |
MATHEUS D C F, AGUIAR C J, DA R F J A, et al. GPR91: expanding the frontiers of Krebs cycle intermediates[J]. Cell Communication & Signaling, 2016, 14(1): 1-9. DOI:10.1186/s12964-016-0126-1 (  0) 0) |
| [10] |
MILLS E, O'NEILL L A. Succinate: a metabolic signal in inflammation[J]. Trends in Cell Biology, 201, 24(5): 313-20. DOI:10.1016/j.tcb.2013.11.008 (  0) 0) |
| [11] |
EDWARDS C B, COPES N, BRITO A G, et al. , Malate and fumarate extend lifespan in Caenorhabditis elegans[J]. PLoS One, 2013, 8(3): e58345. DOI:10.1371/journal.pone.0058345 (  0) 0) |
| [12] |
HUANG X, LIU J, WITHERS B R, et al. Reducing signs of aging and increasing lifespan by drug synergy[J]. Aging Cell, 2013, 12(4): 652-660. DOI:10.1111/acel.12090 (  0) 0) |
| [13] |
HUANG X, LIU J, DICKSON R C. Down-regulating sphingolipid synthesis increases yeast lifespan[J]. PLoS Genet, 2012, 8(2): e1002493. DOI:10.1371/journal.pgen.1002493 (  0) 0) |
| [14] |
YANG M, SOGA T, POLLARD P J. Oncometabolites: linking altered metabolism with cancer[J]. Journal of Clinical Investigation, 2013, 123(9): 3652-3658. DOI:10.1172/jci67228 (  0) 0) |
| [15] |
SCIACOVELLI M, FREZZA C. Oncometabolites: Unconventional triggers of oncogenic signalling cascades[J]. Free Radical Biology & Medicine, 2016, 100: 175-181. DOI:10.1016/j.freeradbiomed.2016.04.025 (  0) 0) |
| [16] |
TRETTER L, PATOCS A, CHINOPOULOS C. Succinate, an intermediate in metabolism, signal transduction, ROS, hypoxia, and tumorigenesis[J]. Biochim Biophys Acta, 2016, 1857(8): 1086-1101. DOI:10.1016/j.bbabio.2016.03.012 (  0) 0) |
| [17] |
CHOUCHANI E T, PELL V R, GAUDE E, et al. Ischaemic accumulation of succinate controls reperfusion injury through mitochondrial ROS[J]. Nature, 2014, 515(7527): 431-435. DOI:10.1038/nature13909 (  0) 0) |
| [18] |
TRAUELSEN M, REXEN ULVEN E, HJORTH S A, et al. Receptor structure-based discovery of non-metabolite agonists for the succinate receptor GPR91[J]. Molecular Metabolism, 2017, 6(12): 1585-1596. DOI:10.1016/j.molmet.2017.09.005 (  0) 0) |
 2018, Vol. 16
2018, Vol. 16


